血浆脂蛋白a与老年钙化性主动脉瓣膜病的关系
孙占京,赵红,王虹璎,崔灿,刘培光,李静,张薇薇
钙化性主动脉瓣膜疾病(CAVD)是继缺血性心脏病和高血压后常见的心血管疾病,是老年人面临的主要问题之一。瓣膜置换术是治疗该病的主要方法,在美国,每年有近10万例患者接受该手术,接受手术的患者一般年纪较大,身体虚弱,常伴发相关并发症,后期的康复治疗成本高。目前还没有任何治疗方法可以预防或延缓CAVD的进展,从而减少对瓣膜置换的需要。有研究发现,由脂蛋白a[Lp(a)]水平介导的LPA基因的遗传变异与一般人群中主动脉瓣钙化和主动脉瓣狭窄(AS)的发生相关[1-3]。本文就Lp(a)与CAVD相关性进行探讨。
1 资料与方法
1.1 研究对象选择2015年1月~2017年12月于华北理工大学附属医院内科住院的年龄在60岁以上的CAVD患者343例作为研究对象(其中81例同时合并二尖瓣钙化),男性163例,女性180例,年龄均值(71.381±8.231)岁;选取同期住院年龄、性别、吸烟史、饮酒史相匹配的,心脏超声提示无主动脉瓣膜钙化的住院患者343例为对照组。病例组入选标准符合华北理工大学附属医院超声回报结果:主动脉瓣膜回声增强、钙化并且年龄≥60岁。对照组入选标准:同期住院年龄、性别匹配的患者,华北理工大学附属医院心脏超声未见主动脉瓣膜回声增强、钙化。排除标准:①主动脉瓣先天性畸形 ;②瓣膜置换者;③风湿性心脏病患者;④严重肝肾功能不全者;⑤免疫性疾病;⑥感染性心内膜炎;⑦钙磷代谢紊乱者;⑧急性心肌梗死;⑨马凡氏综合征;⑩甲状旁腺疾病;⑪甲状腺功能异常者。病例组依据跨主动脉瓣峰值流速(APV)两组:①主动脉瓣硬化组(APV≤2.5 m/s);②主动脉瓣狭窄组(>2.5 m/s)[4]。
1.2 研究方法
1.2.1 一般资料和生化指标采集患者一般基线资料,包括性别、年龄 、身高、体重、吸烟史、饮酒史、脑血管病史、冠心病史、糖尿病史、高血压病史;生化指标包括血清总胆固醇(TC)、三酰甘油(T G)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、尿酸(UA)、血钙(Ca)、血磷(P)、血浆Lp(a)均为空腹12 h后抽取血标本, Lp(a)水平测定采用免疫比浊法,余指标均应用日立7600全自动生化分析仪进行测定。
1.3 统计学分析将所有数据输入SPSS 22.0软件包中,符合正态分布的计量资料采用均数±标准差表示,计量资料两组间比较应用独立样本t检验,计数资料采用例数(百分数)表示,计数资料两组间比较采用χ2检验,各项危险因素与CAVD的相关性应用二元Logistic回归进行分析,关联程度用相对危险度(OR)及其95%可信区间(CI)表示,α=0.05为检验水平,以P<0.05为差异有统计学意义。
2 结果
2.1 临床基本资料两组基线资料相比性别、年龄、饮酒史、吸烟史、糖尿病史差异无统计学意义(P>0.05),两组高血压病史相比差异有统计学意义(P<0.05),两组血脂指标相比TC、TG、HDL-C、LDL-C、载脂蛋白a[Apo(a)]、载脂蛋白b[Apo(b)]差异无统计学意义(P>0.05),两组Lp(a)相比差异有统计学意义(P<0.001),两组Ca、P、UA相比差异无统计学意义(P>0.05),(表1)。
2.2 病例组危险因素分析通过二元Logistic回归分析可知高血压、Lp(a)为CAVD的危险因素,差异有统计学意义(P<0.05)(OR>1)且Lp(a)与CAVD的相关性最强(OR=5.486);性别、LDL-C、HDL-C的OR>1,但P>0.05,差异无统计学意义(表2)。
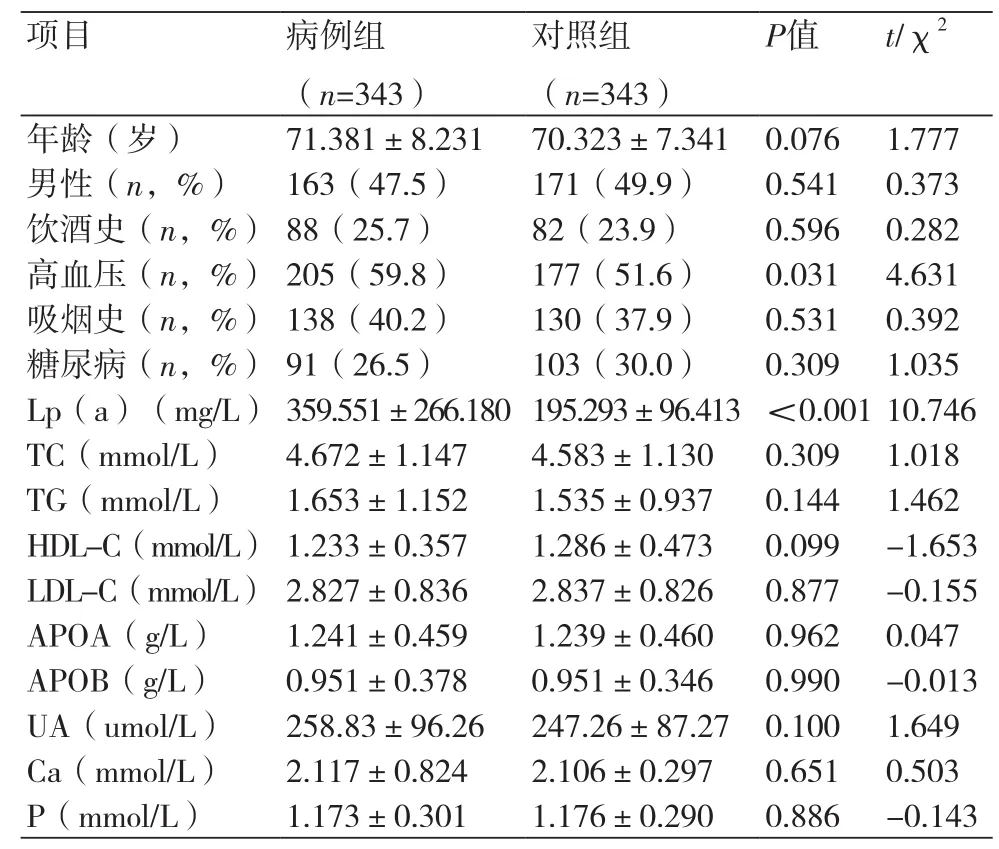
表1 两组患者一般资料比较(x±s)

表2 CAVD危险因素的二元Logistic回归分析
2.3 主动脉瓣膜硬化组和狭窄组的比较主动脉硬化组与狭窄组相比,Lp(a)差异有统计学意义(P<0.001),HDL-C、LDL-C、TC、TG等相比差异无统计学意义(P>0.05)(表3)。

表3 硬化组与狭窄组血脂资料的比较(x±s)
3 讨论
以往的观点认为CAVD是一个瓣膜被动的磨损和退化撕裂的疾病,过去的20多年间,大量新证据表明,CAVD是一个连续的病理变化导致的疾病,与冠状动脉粥样硬化有着相似的病理特点[6]。大量的流行病学资料显示,他汀类药物与延缓CAVD的进展有关[7],但最新的多项大型临床研究显示通过他汀类药物降低胆固醇未能减少CAVD患者的临床终点(即死亡,主动脉瓣置换,AS住院率等)[8]。这些结果表明单纯控制血脂水平不能使CAVD患者获益。通过本文的研究也未能发现HDL-C、LDL-C、TG、TC与CAVD的相关性,这与以往的研究不一致[9]。虽然CAVD的患者与年龄有明显相关性,但本文的研究未发现与年龄的显著性关系,可能年龄是导致CAVD某些危险因素的先决条件,及尚未发现的原因[10]。
50多年前Berg发现了Lp(a),近几年它一直被大家所关注[11]。有研究表明,Lp(a)与冠心病、脑卒中及其他血管疾病的发病有关[12]。同时发现Lp(a)是CAVD的独立危险因素[1-3]。通过本文的研究亦发现Lp(a)是CAVD的独立危险因素,且血浆中Lp(a)水平越高瓣膜狭窄越严重,其机制可能为 ①Lp(a)参与内皮组织修复,Lp(a)通过载脂蛋白(a)的蛋白质部分结合在损伤和裸露的内皮区域[13]。这对于维持血管完整性以及将胆固醇递送到损伤部位具有重要作用,但由于在心动周期中施加的重复机械应力伴随着高压和剪切应力,导致主动脉瓣膜(AV)瓣叶和Lp(a)的过度结合。② Lp(a)颗粒可以促进泡沫细胞形成和早期瓣膜病变的发生,AV硬化和血管动脉粥样硬化都是由于脂蛋白胆固醇在内膜下沉积而导致,但两者的病理生理不同。天然未修饰的脂蛋白可以使组织巨噬细胞内部化不良。脂蛋白胆固醇的氧化使未调节的脂蛋白通过清道夫受体(即CD36和SR-A)[14]摄入巨噬细胞中,导致泡沫细胞形成、脂肪条纹和动脉粥样硬化。在适当的情况下,Lp(a)与含有磷酸胆碱(PC)的氧化磷脂(OxPL)也可诱导巨噬细胞凋亡,这是导致早期瓣膜病变进展的重要因素[15]。③Lp(a)是OxPL在血浆中的主要载体,OxPL是Lp(a)致病性的关键因素,在CAVD中起主要作用。Lp(a)的生理学作用是结合和转运血浆中促动脉粥样硬化的OxPL[16]。OxPL刺激内皮细胞的机制主要有:(1)上调化学引诱物和细胞粘附分子在炎症细胞募集中的表达[17];(2)增加活性氧的产生[18];(3)增加炎症基因的表达(IL-1,IL-6,IL-8)。这种促炎性的表型在瓣膜硬化的早期阶段可能是重要的,并且通过募集免疫细胞和细胞外基质蛋白的沉积来促进瓣叶的硬化。④Lp(a)可引起瓣膜钙化,Lp(a)将胆固醇运输到瓣膜可导致胆固醇结晶的钙化灶。Lp(a)促进心血管(CV)的钙化,也是通过OxPL的氧化应激[19]。OxPL水平在人类瓣膜中的钙化沉积物周围升高,并且与活性钙重塑的信号共定位[20]。 已经发现OxPL通过氧化应激上调相关转录因子-2(runx-2)水平(涉及骨形成的主要调节转录因子)引起内皮细胞的成骨化[21]。已经证明了OxPL以剂量依赖的方式诱导体外成骨细胞分化和血管细胞中矿化基质(即羟基磷灰石)的生成[22],这个性质可以由磷脂酶释放的OxPL衍生物溶血磷脂酰胆碱介导[23]。本研究通过多因素回归分析显示CAVD的发病与高血压可能相关,机制可能为高血压使收缩压增高,主动脉瓣所承受的压力也增高,加速瓣膜纤维层的受损,这也能解释老年性瓣膜钙化多见于主动脉瓣,而二尖瓣少见。
综上所述,血浆Lp(a)、高血压是CAVD的高危因素,通过控制这些危险因素可能使患者获益,尚需更大样本的临床研究和基础实验来进行验证。

