腹主动脉支架术中移位1例
薛 明 李 刚 徐 磊 孔祥骞 吴学君 金 星
1 威海市市立医院介入科,山东 威海 264200 2 山东大学附属省立医院血管外科,济南 250021
腹主动脉瘤腔内修复术(endovascular aneurysm repair,EVAR)较开放手术早期生存优势明显[1],已经成为国内外治疗腹主动脉瘤样扩张性疾病的主要治疗手段[2-4]。支架移位与I型和III型内漏息息相关,继发瘤体破裂是致死性并发症[5-6]。多个国外中心对其进行了长期随访研究[7-10],其发生率在3%~28%,其中术中发生率为3.8%、术后12个月发生率为3.6%、术后24个月发生率为9.4%、术后36个月发生率为13.6%。国内鲜有腹主动脉支架移位相关文献报道。本文旨在通过对1例术中支架移位患者的临床资料进行分析,加深对支架移位的认识,总结治疗经验,现报告如下。
1 临床资料
患者,男性,63岁。因“查体发现腹主动脉瘤20 d”于2018年9月18日入院。脑梗死病史4年,高血压病史10年,吸烟史40年。入院CT血管造影(computed tomography angiography,CTA)示:符合腹主动脉中下段动脉瘤并附壁血栓形成,双侧髂总动脉动脉瘤、左侧髂内动脉闭塞;双侧椎动脉起始段闭塞、陈旧性脑梗。病变特点:(1)梯形瘤颈,长度20 mm,肾动脉水平主动脉直径:20 mm,肾动脉下20 mm主动脉直径:24 mm;(2)双侧髂动脉起始部动脉瘤样扩张,右侧最大径23.6 mm,左侧24.8 mm(图1)。术前计划:选用(30×140)mm主体支架;右侧裙摆技术,保留右侧髂内,拟选(24×120)mm、(18×120)mm髂支;左侧髂内动脉闭塞,直接封至髂外,拟选(12×140)mm髂支。
于2018年9月25日行EVAR,全麻后在双侧腹股沟斜行切开暴露股动脉,穿刺双侧股动脉置入导管鞘,由左股动脉送入Lunderquist导丝,近端至降主动脉,由右股动脉送入猪尾导管至肾动脉上方,造影显示:肾下腹主动脉瘤样扩张,髂动脉瘤样扩张,病变数据与术前相符。术中收缩压控制在120 mm Hg以下。按术前计划由左侧股动脉送入支架主体,覆膜开始处平左肾动脉(低位)开口下缘顺利释放,双侧髂支先后送入支架主体短腿支架内,重叠(约30 mm)部分支架后释放,使用CODA顺应性球囊依次扩张主体近端锚定区、双侧髂支连接处、双侧髂支远端。造影显示:主体支架及左髂支位置准确固定,右侧髂支近端可见游离倾向,可见内漏。随后透视下发现右侧髂支与主体短腿成角移位(图2)。处理过程:左肱动脉入路引入抓捕器通过主体支架分支进入瘤腔,右髂支近端球囊支撑下保持导丝头端位置固定,使用抓捕器成功抓捕导丝,沿导丝送入(16×80)mm覆膜支架连接右侧主体短腿及右侧髂支,重叠部分后释放,再次造影显示:支架准确固定、无内漏、无造影剂外溢(图3)。扯管、缝合切口。患者术后恢复顺利,无近期严重并发症发生,于2018年9月30日出院。
2 讨论
主体支架系统移位多数发生在近端瘤颈及远端髂支锚定部位。其原因复杂,与生物力学及形态学的变化密切相关,包括瘤腔大小、长度、厚度,血压、瘤颈近端血栓数量、髂动脉形态、瘤颈及髂分叉角度、主体支架与髂支直径比以及移植物的大小等。一般来说,向下的力(F1)影响近端颈部固定,侧向力(F2)影响髂支固定,当F1≥F2时可能导致支架移位[11-12]。瘤颈角度α、髂分叉角度β、主体支架与髂支直径比等因素共同影响F1。当α>40°时F1显著增加,近端支架移位发生率可增30%[13];而β=90°较之β=23°时,F1也明显增加。瘤颈扭曲较大时,应尽量采用柔顺性和顺应性较好的肾上锚定系统,延长锚定距离,使支架与动脉壁之间紧密贴合,从而避免远期移位。也有研究认为术后瘤颈角度较术前明显变化,但术后1、2年主体与分支支架直径比过大会迫使更多的血液突然汇聚到相对较小的分支支架内,从而显著影响F1。而对于F2而言,支架的大小、近远端锚定区的距离、支架间重叠的距离产生重要作用。近远端oversize不足,支架重叠距离不够可能出现内漏及支架移位;但对于瘤壁薄,瘤颈角度大的病例,过大的oversize可能导致锚定区动脉壁形态变化及扩张。Sternbergh等[14]研究报道称,主动脉覆膜支架oversize>30%,术后12月支架移位(>5mm)风险增加约14倍,而在24个月时,瘤体扩张风险增加了大约16倍。
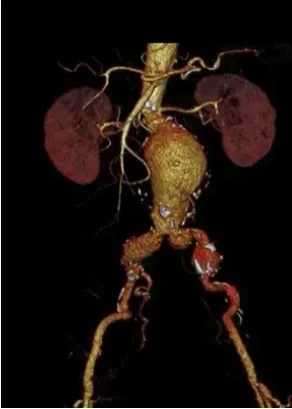
图1 患者术前CTA情况:肾下偏心型腹主动脉瘤体,双侧髂动脉瘤样扩张
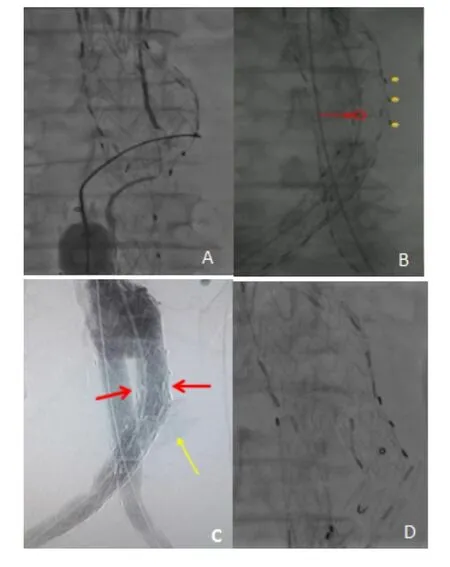
图2 主体支架及两侧髂支释放后发现右侧髂腿移位到完全分离过程
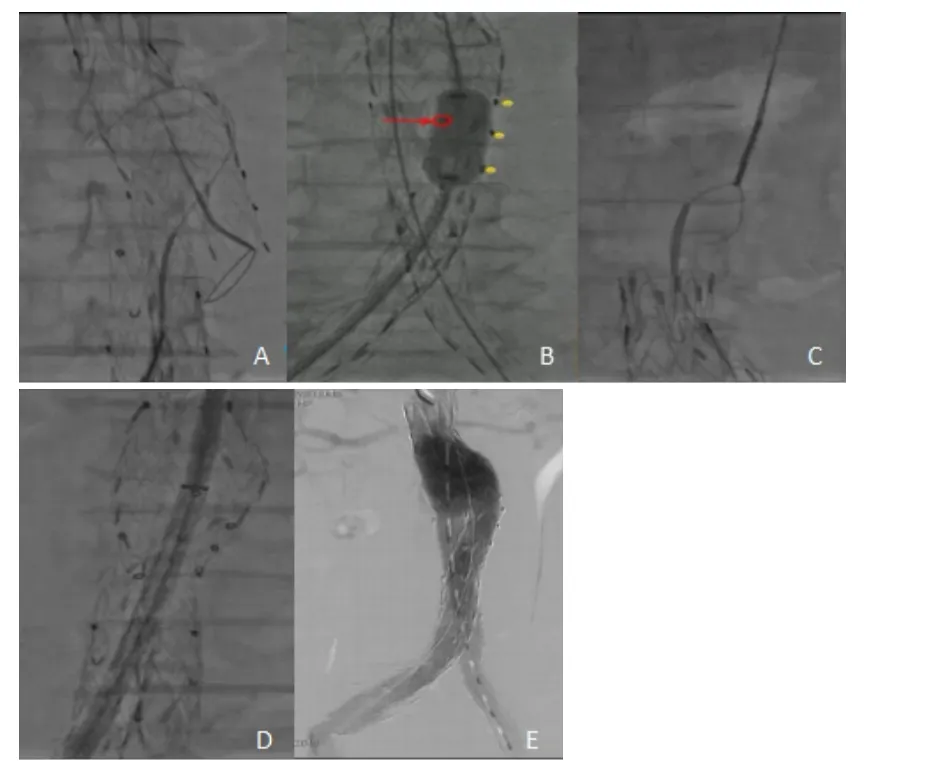
图3 髂支移位处理过程
术中支架移位指移植物在完全释放后发生任何可被检测到的移位,但不包括输送系统问题引起的移植物移位。Kalliafas等[15]回顾了176例接受EVAR患者的病例资料,其中6例(3.8%)出现术中支架移位,且均为肾下锚定支架系统,其原因与当时覆膜支架工艺及锚定距离相关。在EVAR手术相关的并发症中,术中支架移位国内外报道较少,本中心属首次发生。分析本例出现术中支架移位的原因:(1)瘤腔体积较大且向左侧偏心膨出,应用交叉腿技术释放支架后,未能充分评估髂腿支架与主体角度和血流动力学产生的下向力;(2)髂支与主体支架短腿重叠距离不足,髂支最上端Mark点应略超过短腿最上端Mark点;(3)术毕Lunderquist导丝撤出支架失去支撑,进一步向瘤腔左侧移位直至完全分离。
支架移位多出现在术后远期,可导致严重内漏,增加二次破裂风险,降低远期生存率[5]。支架移位的处理多采用植入Cuff和支架延长段,其适应症有:(1)支架主体近端向远端移位;(2)髂支向近端回缩;(3)近远端锚定区进展性瘤样扩张;(4)主体与分支支架分离;(5)支架覆膜破裂。本例术中髂支近端与主体短腿成角分离,血液在瘤腔中形成湍流,导丝通过极为困难,反复尝试后通过导丝抓捕技术将导丝重新连接主体短腿与髂支,结果较为满意。研究者还考虑过以下处理方案:(1)球囊辅助将髂腿支架推入腹主动脉瘤腔内、重新接腿;(2)单腿覆膜支架(AUI)封闭主体短腿脱出侧、弹簧圈封闭远端髂动脉、下方行股-股动脉转流;(3)中转开腹手术。
综上,随着EVAR术在我国广泛开展,需要认识到其有别于传统外科治疗,预后受血流动力学、生物力学、血管形态学等多方面影响,对于介入技术及支架工艺提出了很大的挑战。EAVR术中移位较之中远期移位的发生罕有报道,一旦出现,处理方法复杂,首选腔内处理。临床医生需要加深对EVAR手术的认识,多学科交叉学习。术前应进行严谨的影像学评估,充分做好手术准备,并向患者及家属交待支架移位可能,远期进行有效随访。

