人脑胶质瘤组织中神经前体细胞表达发育下调蛋白8的表达及其意义*
曾凡涛,王新军,杨 卓,王修成,杨如意,周少龙,张旭阳,袁小威
(郑州大学第五附属医院神经外科,郑州 450052)
胶质瘤是神经系统中最常见的恶性肿瘤,患者生存期短、病死率高、预后差[1]。神经前体细胞表达发育下调蛋白8(NEDD8)是一种类泛素蛋白,与泛素约有60%的氨基酸序列相同,80%同源,主要在心肌和骨骼肌中特异性表达[2]。NEDD8和底物相结合,参与翻译后可逆性修饰的过程称为Neddylation,即NEDD化。该修饰可调控细胞内的多种代谢途径,其异常将导致人类神经退行性疾病和肿瘤的发生[3-4]。目前已有相关研究报道NEDD8蛋白在肺癌[5]、肝内胆管癌[6]及结肠癌[7]中异常高表达,但其在人脑胶质瘤中的表达情况却较少报道。本研究通过免疫组织化学法和Western blot检测胶质瘤组织中NEDD8的表达及分布,并初步探讨NEDD8的表达与临床参数的关系。
1 资料与方法
1.1一般资料 选取2012年3月至2015年3月于本院神经外科手术治疗的89例胶质瘤患者的胶质瘤组织及瘤周组织,获取标本后保存于-80 ℃冰箱内。其中,WHO分级Ⅰ级16例,Ⅱ级39例(少突胶质细胞瘤14例),Ⅲ级20例(少突胶质细胞瘤10例),Ⅳ级14例。纳入标准:首发病例;镜下手术全切除;术前未接受放、化疗及其他治疗。本研究均已获得患者家属同意及本院伦理委员会批准。
1.2方法
1.2.1主要试剂和仪器 兔抗人NEDD8单克隆抗体购自北京索莱宝科技有限公司;二抗反应增强液、二抗增强酶标山羊抗小鼠/兔免疫球蛋白G(IgG)聚合物及二氨基联苯胺(DAB)显色液购自北京中杉金桥生物技术有限公司;聚偏二氟乙烯(PVDF)膜购自美国Milipore公司;荧光显微镜购自日本Nikon公司。
1.2.2免疫组织化学检测NEDD8表达 89例标本在离体后经10%甲醛固定,行常规石蜡包埋等处理,将包埋标本以3 μm厚度连续切片,置于防脱剂预处理后的载玻片上。滴加NEDD8抗体(稀释比为1∶100)于4 ℃冰箱中孵育过夜;磷酸盐缓冲液(PBS)清洗后添加反应增强液、增强酶标山羊抗小鼠/兔IgG复合物,DAB显色液镜下显色观察;苏木素复染,清水返蓝后中性树胶封片,于镜下观察。以PBS液代替一抗作阴性对照。
1.2.3Western blot检测 取冰冻组织标本250 mg,剪碎后放入匀浆器中,加入预冷的蛋白裂解液1 mL,在冰上匀浆30 min,使蛋白质充分裂解;将匀浆后的液体倒入1.5 mL EP管中,煮沸5 min后10 000 r/min离心。将离心后的上清液析出,在冰上分装至200 μL的EP管中,置于-70 ℃冰箱保存。二喹啉甲酸(BCA)法进行蛋白定量,十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分离样品后电转移至PVDF膜。5%脱脂奶粉4 ℃封闭过夜。加入兔抗人NEDD8抗体(1∶1 000)4 ℃孵育过夜,加入羊抗兔二抗(1∶10 000)37 ℃孵育1 h。采用凝胶成像系统进行分析,测定各条带的吸光度值。将每个标本测得的NEDD8条带吸光度值与内参甘油醛-3-磷酸脱氢酶(GAPDH)条带吸光度值相比,所得比值代表该标本中NEDD8蛋白的表达水平。
1.2.4结果判断 由本院两名经验丰富的病理医师采用双盲法阅片和双评分半定量法进行评分,光镜下观察8个高倍镜视野,计数NEDD8阳性细胞。其中以阳性细胞百分比小于或等于25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。按染色程度评分:无染色者为0分,淡黄色者为1分,黄色或棕黄色者为2分,褐色者为3分。最后以两者评分总和为最终评分结果:0分为阴性,1~7分为阳性,其中1~3分为低表达,4~7分为高表达。

2 结 果
2.1NEDD8在脑组织中的表达和分布 NEDD8在肿瘤组织细胞核中高度表达,而在细胞质中表达相对较弱,可见黄色或棕黄色的阳性颗粒物质(图1)。NEDD8蛋白水平在瘤周组织中为0.11±0.02,在肿瘤组织中为0.43±0.06,WHO低病理级别(Ⅰ、Ⅱ)中为0.32±0.14,高病理级别(Ⅲ、Ⅳ)中为0.52±0.08,瘤周组织与肿瘤组织比较差异有统计学意义(t=-9.801,P=0.001),WHO低病理级别与WHO高病理级别比较差异有统计学意义(t=-6.684,P=0.003),见图2。NEDD8表达分布情况见表1。
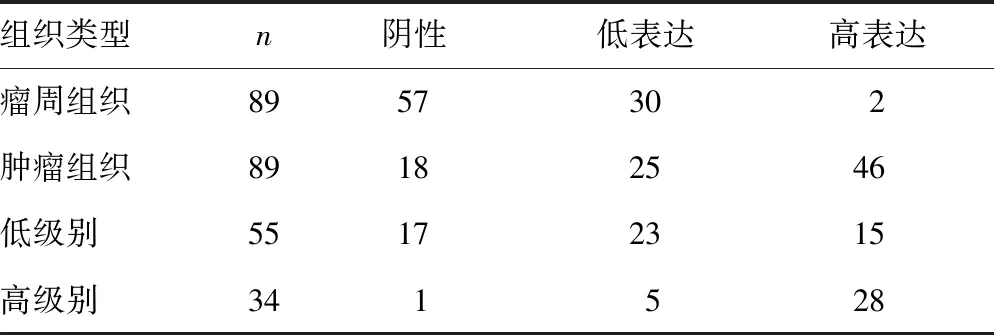
表1 NEDD8在不同级别和不同组织中的表达(n)

表2 肿瘤组织中NEDD8蛋白的表达与临床病理因素的关系(n)
a:采用连续性校正χ2检验
图1 免疫组织化学检测胶质瘤组织和瘤周组织中NEDD8的表达
2.2NEDD8的表达与临床病理因素的关系 NEDD8的表达与WHO分级、肿瘤直径有相关性(P<0.05),与患者性别、年龄、胶质瘤成分及肿瘤部位无相关性(P>0.05),见表2。
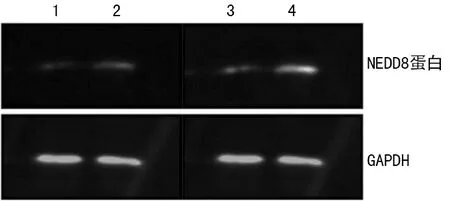
1:瘤周组织;2:肿瘤组织;3:低病理级别胶质瘤组织;4:高病理级别胶质瘤组织;GAPDH:对照内参
图2 Western blot检测脑组织中NEDD8蛋白水平
3 讨 论
NEDD8是由NEDD8基因编码的由81个氨基酸残基构成的多肽,又称Rub1,在大多数真核生物中广泛表达,高度保守,在细胞功能的调控中发挥了重要作用[8]。NEDD化是一种蛋白质翻译后修饰途径,通过该途径,NEDD8与底物蛋白结合可调节蛋白质的功能,此过程中涉及3种酶:激活酶E1、结合酶E2及连接酶E3[9]。目前已知NEDD8修饰的主要底物是cullin家族,该蛋白家族可作为cullin-RING泛素连接酶(CRLs)的分子骨架[10],且在多种人类癌症中发现CRLs的亚基存在着过表达、突变或者扩增等现象。已有研究表明,NEDD化途径过度激活将会导致人类恶性实体瘤的进展[5-7];此外,NEDD8通路的抑制因子MLN4924也已显示出了较好的抗肿瘤特性[11]。
人脑胶质瘤的发生和发展是一个多因素、多环节的病理性改变过程。由于内部分子结构异常复杂,人脑胶质瘤在临床上的治疗效果不容乐观。在肿瘤细胞中,蛋白质主要参与增殖、迁移等重要活动并为肿瘤的生长提供营养物质[12]。目前已有少量研究报道NEDD化过度激活有可能与胶质瘤(Ⅳ级)组织的恶性程度相关联[13],此外,肿瘤组织中NEDD8蛋白的高表达也提示了患者预后不良。
本研究显示,NEDD8在肿瘤组织中的阳性表达为79.8%(71/89),明显高于瘤周组织中的35.9%(32/89),这提示NEDD8可能在胶质瘤的发生和发展中起重要作用。NEDD8在WHO高病理级别中的阳性表达为97.1%(33/34),明显高于WHO低病理级别中的69.1%(38/55),本研究还通过检测不同WHO病理级别中的蛋白水平,更加明确了NEDD8蛋白在胶质瘤组织中表达上调,且随着肿瘤WHO病理级别的升高而升高,这与文献[13]报道情况基本一致,这表明NEDD8可能在胶质瘤的进展过程中发挥重要作用。由于大多数胶质瘤与周围组织分界不明显,术中难以保证对肿瘤做到全切除[14],这可能导致胶质瘤术后复发,因此,NEDD8蛋白的表达程度是否可作为快速判断肿瘤边界的定量指标,对临床一线医生后续手术全切胶质瘤有重要意义。此外,本课题组发现,胶质瘤组织中NEDD8的表达与患者WHO病理分级、肿瘤直径有关(P<0.05),而与年龄、性别、肿瘤细胞成分及肿瘤部位无明显相关性(P>0.05)。NEDD8的表达随着肿瘤直径的增大而增加,可能是肿瘤组织中NEDD8蛋白经NEDD化抑制Cullins与CAND1的相互作用,促进了Cullin与接头蛋白和底物识别亚基的结合,增强CRLs的生物活性,从而加速了肿瘤的生长和增殖[15]。据此,本研究假设NEDD8表达水平的增高促进了胶质瘤的病理级别及体积的改变,NEDD8蛋白可能有望作为判断胶质瘤生物学特征的分子新靶点。
综上所述,本研究初步分析了NEDD8蛋白在胶质瘤组织中的表达情况,为研究胶质瘤的生长机制、侵袭进展提供了理论依据和参考。然而,NEDD8蛋白的异常表达是通过何种途径来增强胶质瘤的生物活性目前尚未明了。接下来本课题组将进行NEDD8参与胶质瘤发生、发展过程的机制研究,并对肿瘤患者术后进行随访,进一步探讨NEDD8与胶质瘤患者预后的关系。

