替格瑞洛对急性心肌梗死患者冠脉血流和短期预后的影响*
李其勇,苏 莱,陶剑虹
四川省医学科学院·四川省人民医院 心血管内科(成都 610072)
急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction, STEMI)是急性冠状动脉综合征(acute coronary syndrome, ACS)中最严重的类型,起病急、预后差、致死率高[1-3]。STEMI发生机制多为冠状动脉粥样斑块破裂致内皮损伤,暴露内皮下胶原,引起血小板黏附、聚集和血栓形成,从而导致罪犯血管急性闭塞致心肌严重缺血坏死。在时间窗内通过经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)尽早开通心肌梗死相关血管,恢复冠脉血流已成为治疗STEMI最主要的手段[1, 4]。由于STEMI患者常处于高凝状态和冠脉高血栓负荷,直接PCI术中慢血流或无复流及术后早期支架内血栓发生率颇高,是影响STEMI患者预后的重要因素。PCI术前负荷抗血小板药物能减少术后支架内血栓发生率,减少严重心血管事件风险,改善临床预后[5],目前已成为STEMI患者直接PCI术前的标准化治疗[6]。
替格瑞洛是一种新型的环戊基三唑嘧啶类口服抗血小板药物,比经典的抗血小板药物氯吡格雷起效更快、作用更强。研究[7-8]显示PCI前早期负荷替格瑞洛能显著降低ACS患者PCI术后30 d支架内血栓发生率,但是否影响直接PCI术中冠脉血流灌注情况及术后患者心功能尚不清楚,且其相对较高的出血发生率也备受争议。本研究旨在探讨STEMI患者直接PCI术前早期负荷替格瑞洛对PCI术中冠脉血流灌注情况及短期预后的影响,现报道如下。
1 资料与方法
1.1 临床资料
选取2016年11月至2017年10月在四川省人民医院心内科诊断为STEMI且行直接PCI治疗的患者187例为研究对象,纳入标准:1)急性发病时间在12 h内;2)符合STEMI诊断标准:心电图有下列任何一条改变:心电图有≥2个相邻导联ST段抬高超过0.1 mv,且有动态改变;新发左或右束支传导阻滞,伴或不伴胸痛。排除标准:1)对P2Y12受体抑制剂不能耐受或过敏者;2)需要同时口服抗凝药物者;3)其他PCI手术禁忌者。PCI术前负荷阿司匹林肠溶片300 mg(德国拜耳公司,商品名拜阿司匹林)+替格瑞洛180 mg(阿斯利康制药有限公司,商品名倍林达)128例(T组),术后拜阿司匹林100 mg/d +替格瑞洛180 mg/d ;术前负荷阿司匹林肠溶片300 mg+氯吡格雷300 mg(赛洛菲制药有限公司,商品名波立维)59例(C组),术后拜阿司匹林100 mg/d +氯吡格雷75 mg/d 。记录两组患者从发病至血管开通时间(总缺血时间)和负荷双联抗血小板药物到血管开通时间(服药时间),将两组患者均按总缺血时间平均中位数180 min分组:T1组(<180 min,n=57)和T2组 (≥180 min,n=71); C1组(<180 min,n=33)和C2组 (≥180 min,n=26)。所有入选病例均经患者知情并签署同意书。
1.2 研究方法
PCI术中及术后观察以下心肌血流灌注指标:各组患者冠状动脉TIMI血流变化、心电图ST段回落(ST-segment resolution, STR)、校正的TIMI血流计数帧数(corrected TIMI frame count, CTFC)。出院后2周、1个月、3个月进行门诊和电话随访,监测其心功能:左心室收缩末期内径(LVEDD)和左心室射血分数(LVEF)及出血[9]、呼吸困难、心绞痛、主要不良心血管事件(major adverse cardiovascular events, MACEs)(再发心肌梗死、心源性死亡、卒中及靶血管再次血运重建)发生率。心电图STR定义为术前抬高最多的ST段与术后同导联ST段之差除以术前ST段值,STR≥50%定义为ST段完全回落(STR50%),STR<50%定义为ST段未完全回落。
1.3 统计学方法
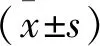
2 结果
2.1 基本情况
2.1.1 基线资料 两组患者性别、年龄、危险因素(糖尿病、吸烟史、高血压、冠心病家族史、血脂异常)、肌酐清除率(eGRF)等相关指标比较,差异无统计学意义(P>0.05),具有可比性(表1)。
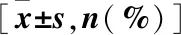
表1 两组患者基本临床资料比较
2.1.2 冠状动脉造影 两组患者均进行急诊冠脉造影检查和PCI治疗,显示两组患者在病变血管数、梗死相关动脉、院内完全血运重建率等方面比较,差异无统计学意义(P>0.05)(表2)。
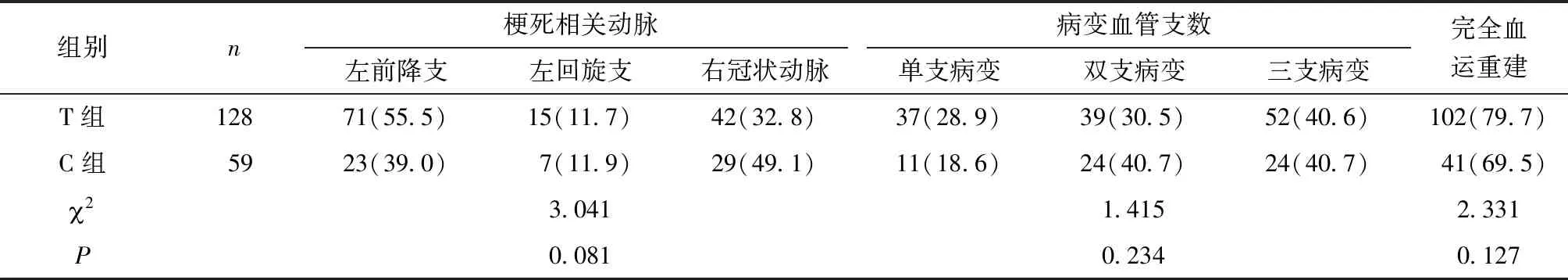
表2 两组患者冠状动脉造影情况比较[支,n(%)]
2.2 总缺血时间对心肌血流灌注的影响
T1组、T2组比较,PCI术前两组患者梗死相关血管均无TIMI Ⅲ级血流,术后各组TIMI Ⅲ级血流患者比例均较术前明显增加,但组间比较差异无统计学意义(P=0.417);T1、T2组PCI术后CTFC值显示,T1组CTFC值(21.68±7.75)帧低于T2组(27.72±11.52)帧,差异有统计学意义(P=0.001); T1组PCI术后2 h STR50%(91.2%)高于T2组(76.1%),差异有统计学意义(P=0.024)。
C1组、C2组患者比较显示,PCI术前两组梗死相关血管也无TIMIⅢ级血流,PCI术后的两组TIMIⅢ级血流患者比例均明显增加,但组间比较差异无统计学意义(P=0.431);C1、C2两组患者PCI术后CTFC值显示,C1组CTFC值(27.11±11.79)帧低于C2组(34.95±11.99)帧,差异有统计学意义(P=0.015);C1组PCI术后2 h STR(75.8%)高于C2组(50.0%)(P=0.040),差异有统计学意义(表3)。

表3 总缺血时间对心肌血流灌注情况的影响
2.3 不同抗血小板药物对心肌血流灌注的影响
T1组和C1组心肌灌注情况结果显示:PCI术后T1组CTFC值(21.68±7.75)帧低于C1组(27.11±11.79)帧,差异有统计学意义(P=0.010); T1组PCI术后2 h STR50%(91.2%)高于C1组(75.8%),差异有统计学意义(P=0.044)。T2组和C2组心肌灌注情况结果显示:PCI术后T2组CTFC值(27.72±11.52)帧低于C2组(34.95±11.99)帧,差异有统计学意义(P=0.008); T2组PCI术后2 h STR50%(76.1%)高于C2组(50.0%),差异有统计学意义(P=0.014)(表4)。

表4 不同抗血小板药物对心肌血流灌注的影响
2.4 患者住院期间及3个月随访结果
T、C两组患者在住院期间心功能指标LVEDD和LVEF比较,差异均无统计学意义 (P>0.05);3个月随访时T组LVEF水平高于C组(P<0.05),差异有统计学意义;两组LVEDD差异无统计学意义(P>0.05)。术后随访3个月, MACE事件发生情况:T组1例(脑卒中),C组4例(心源性死亡1例,急性心肌梗死1例,脑卒中2例);T组再发心绞痛4例,C组6例,T组MACE事件和心绞痛发生率均低于C组,差异有统计学意义(P<0.05)。
两组轻微出血:T组16例,C组5例,没有1例发生大出血、颅内出血或危及生命的出血,总出血事件发生率比较差异无统计学意义(P=0.439)。轻微呼吸困难:T组8例,C组1例,均未进行医疗干预后自行消失。两组患者均未出现药源性心动过缓情况(表5)。
表5 患者住院期间及3个月随访结果
3 讨论
STEMI患者最重要的治疗是尽早开通冠脉血流,恢复心肌水平再灌注,最大程度挽救频死的心肌。目前急诊直接PCI无疑是心肌再灌注治疗最有效的手段。临床5%~20%患者在直接PCI术中虽然开通了闭塞的冠状动脉,但却不能达到TIMI Ⅲ级的血流,难以实现心肌水平的再灌注,即无复流现象。无复流现象是影响急性心肌梗死患者近期预后及远期心血管事件、死亡的独立危险因素,严重影响STEMI患者直接PCI治疗的临床获益[10],其发生机制尚不明确。多数研究[11]认为与缺血再灌注损伤、微血管痉挛、微栓塞、内皮功能损伤、炎症反应等多种因素相关。
直接PCI术中发生无复流实际是心肌损伤在缺血时间上的延续和程度上的叠加,患者常会出现胸痛、心律失常甚至血流动力学紊乱,严重者危及生命,因此PCI术中防治无复流是介入医生难以回避的难题。无复流发生的始动因素是心肌缺血损伤和后续炎症反应,因此心肌缺血时间和损伤程度是决定无复流发生和预后的最重要因素。无复流分为功能性及结构性,功能性无复流一般缺血时间相对较短,心肌损伤程度相对较轻,微血管内皮功能尚完整,局部炎症反应致微血管痉挛、栓塞及再灌注损伤等,一般可逆;结构性无复流缺血时间长,心肌损伤程度重,微血管内皮功能损伤、炎性水肿、微血管阻塞,多为不可逆。评估无复流和微循环功能障碍的方法有CTFC、STR、心肌声学造影和心脏磁共振成像等[12],由于在STEMI急性期心肌声学造影和心脏磁共振成像往往难以实现,因此CTFC和STR是临床最方便实用的方法。本研究中T组和C组均显示总缺血时间越短,心电图STR50%越高,CTFC值越小,即恢复心肌水平再灌注的比例越高,这可能与总缺血时间较长组梗死心肌范围更广、更易发生结构性无复流有关。
如前所述,STEMI患者常处于高凝状态和冠脉高血栓负荷,直接PCI术中易发生无复流,且术后早期支架内血栓发生率高,二者均是影响STEMI患者预后的重要因素。大量临床研究[13]已证实,STEMI患者早期行抗血小板药物治疗可显著减少支架内血栓和改善预后。 2017年欧洲心脏病学会(ESC)指南[6]推荐一旦STEMI诊断成立,应尽早启动抗血小板药物预治疗。尽管阿司匹林联合氯吡格雷双联抗血小板治疗可显著减少STEMI患者心血管事件发生率,但1年内MACE事件发生率仍高达5%~15%。研究[14]表明,ACS患者中,阿司匹林和氯吡格雷组成的双联抗血小板方案血小板抑制率仅达50%。究其原因,氯吡格雷为噻吩吡啶类抗血小板药物,口服吸收后需在肝细胞内经细胞色素P450酶系亚家族CYP2C19活化,85%酯化为无活性的代谢产物,仅15%代谢成具有抗血小板作用的活性产物,且不同患者对氯吡格雷的反应呈现明显的个体差异,即氯吡格雷反应多样性。甚至部分患者出现无反应或低反应现象称为氯吡格雷抵抗[15-16]。
替格瑞洛属新型P2Y12受体抑制剂,结构上为环戊基三唑并吡啶类药物,由于无需经过肝脏代谢激活,因此抑制血小板起效更快、作用更强。研究[17]表明,首次负荷替格瑞洛180 mg后30 min血小板抑制率已达41%, 2 h达88%(而首次负荷氯吡格雷600 mg后2 h血小板抑制率仅达38%)。此外,替格瑞洛不经过细胞色素P450代谢,不易受基因多态性和药物相互作用影响,抗血小板作用强且稳定[18]。本研究显示在相同总缺血时间中位数时,替格瑞洛组比氯吡格雷组心电图STR50%更高,CTFC值更低,提示替格瑞洛能够更好改善直接PCI患者梗死相关血管的血流和心肌水平的再灌注。
此外,替格瑞洛还可通过改善冠脉微循环、微血管内皮功能以及抗炎作用等多重活性以减少再灌注损伤和无复流的发生,改善ACS患者的预后[18]。研究[19]表明,人体红细胞、心肌细胞、血管内皮细胞内均含有腺苷重摄取转运体, 通过Glycosylic信号转导通路再摄取腺苷以恢复细胞内ATP含量。替格瑞洛可抑制腺苷的再摄取[20],导致内、外源性腺苷增加,后者通过作用于腺苷A2a受体发挥扩血管作用,改善冠脉局部血流;高浓度的腺苷激活A2b受体, 可抑制中性粒细胞的趋化、氧自由基及炎性介质的释放,从而保护血管内皮,减少氧化应激和再灌注损伤。本研究显示替格瑞洛组在3个月随访时LVEF更高,可能与替格瑞洛的强效抗血小板作用、改善冠脉微循环和内皮功能、以及抗炎作用等多种因素有关。研究[17]表明,STEMI亚组显示替格瑞洛组MACE发生率低于氯吡格雷组(9.4%和10.8%),两组发生TIMI大出血风险比较,差异无统计学意义(2.5%和2.2%)。
综上所述,替格瑞洛应用于STEMI患者具有良好疗效和安全性。本研究STEMI患者PCI术后随访3个月显示T组比C组短期内MACE发生率更低;T组患者呼吸困难和总出血概率与C组比较有增多趋势,但差异无统计学意义,更大的样本量和更长的观察时间也许能提供更多的临床证据。