能量变化图示法在热化学解题中的应用
黑龙江 张显峰
高考题中数图形式呈现信息已成为增大试题难度的常考形式,平时教学过程中,要引导学生利用对图象类习题的研究,加深对化学反应原理的理解。现针对“能量与反应过程”的系列图象的分析基础上,利用“能量变化图”体现物质之间的能量关系,借以挖掘物质能量的大小关系、守恒关系、物质的稳定性等信息,突破此类难题,形成策略性知识。
在高考试卷中,考查盖斯定律的试题出现频率较高,属于热点问题,命题的背景材料、信息的呈现形式变化多样,考查学生对问题的分析思考能力,区分度较高。请看下面两道高考题。
【例1】(2014·北京卷·26节选)NH3经一系列反应可以得到HNO3,如图所示。

(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。


下列能量变化示意图中,正确的是________(选填字母)。

A
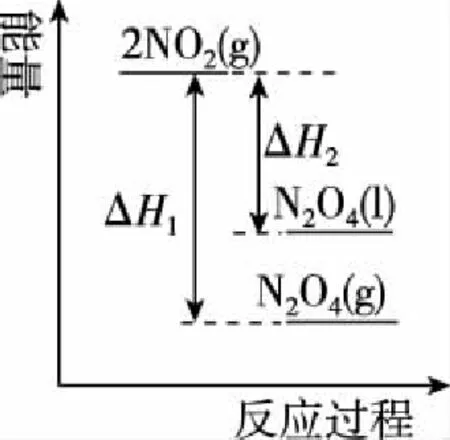
B

C
【答案】A
【解析】题目提到“降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸”说明降温有利于NO2转化为N2O4,则该反应是放热反应,ΔH1<0,ΔH2<0,而等量的N2O4(g)的能量大于N2O4(l)的能量,所以A项正确。

( )
A.ΔH2>ΔH3B.ΔH1<ΔH3
C.ΔH1+ΔH3=ΔH2D.ΔH1+ΔH2>ΔH3
【答案】B
【解析】这类题的常规处理方法是把过程的描述转化为热化学方程式:



由以上热化学方程式可知,ΔH2<ΔH3,所以A项错误;由盖斯定律可以得出反应(Ⅱ)+反应(Ⅲ)=反应(Ⅰ),即ΔH2+ΔH3=ΔH1,所以C项错误,由ΔH2+ΔH3=ΔH1,以及ΔH1>0、ΔH2<0、ΔH3>0推出ΔH1<ΔH3,所以B项正确;再由ΔH1<ΔH3和ΔH2<0可得出ΔH1+ΔH2<ΔH3,所以D项错误。
从上面两道高考题的难易程度分析,前者简单的原因,是题中出示的图象蕴含了丰富信息,按号入座即可;但后者需要学生掌握盖斯定律和利用数学知识来解决问题,不仅过程复杂,还要兼顾反应热的正负,稍有疏漏就会得出错误的结论。
提高这类试题的解题效率,最有效手段便是改变解题方法。我们先研究一下教材对能量问题的设计。在人教版必修二教材第33页出示了“水能、化学能变化示意图”(图1),与生活中的事实进行对比联系,直观形象,清晰明了。人教版选修四第3页采用二维图象形式说明反应过程中物质能量的变化(图2),抽象成对应的数学形式,有前面的具体铺垫和后面的数学处理,学生在头脑中建立起放热反应、吸热反应的立体模型。
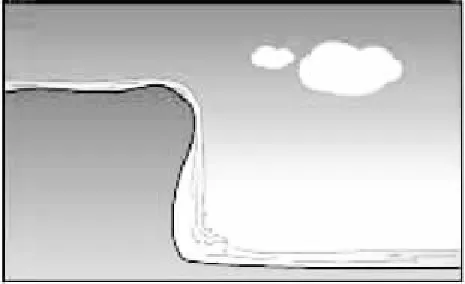
水由高处向低处流要释放能量(势能转化为低能)

将水由低处抽向高处需供能量(电能转化为机械能,再转化为势能)

反应物的总能量>生成物的总能量化学反应放出能量

反应物的总能量<生成物的总能量化学反应吸收能量


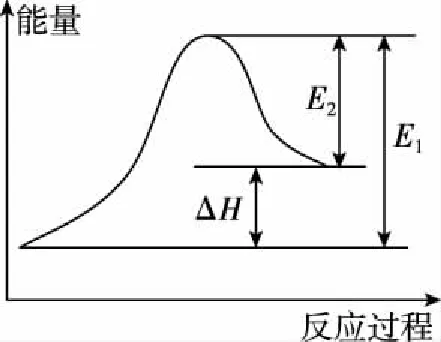
图3
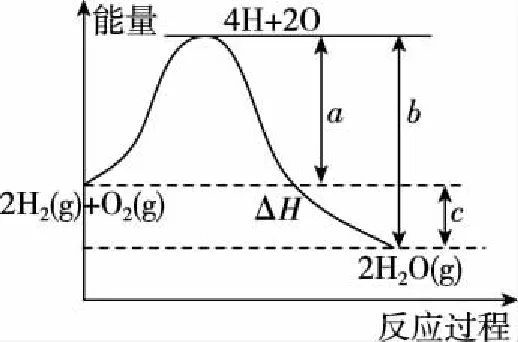
图4
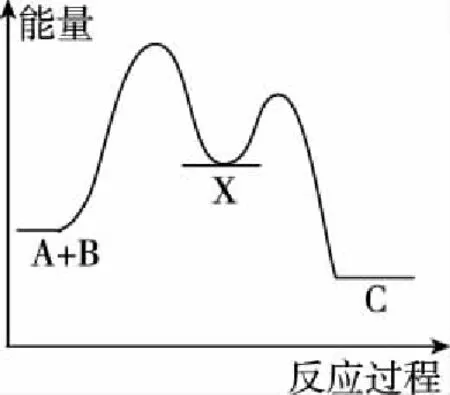
图5
另外,同一物质的聚集状态不同,所具有的能量也不同,又会增加问题的复杂性,因此,图2只能粗略地表现反应过程,利用它解题,信息量不足就体现的非常明显了。下面结合例3、例4体会一下利用图象解题带来的便捷。
【例3】如图所示,下列说法不正确的是
( )


图6
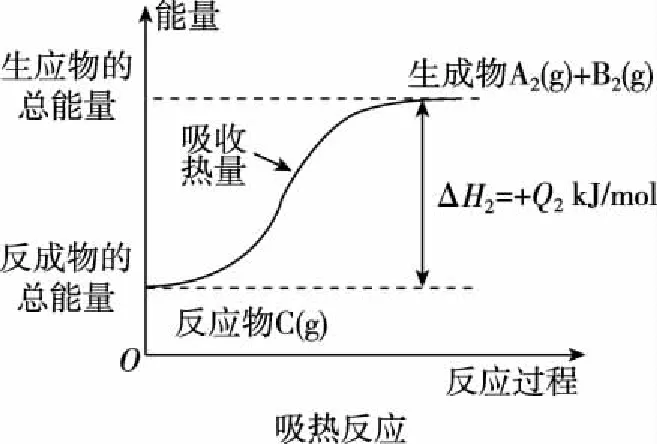
图7
C.Q1与Q2的关系:Q1>Q2
D.ΔH2>ΔH1
【答案】C

【例4】分析如图8所示的能量变化示意图,下列热化学方程式正确的是
( )

图8

【答案】B
【解析】根据图示,2A(g)+B(g)的总能量大于2C(g)的总能量,故a<0,A选项中a>0,故A选项错误;C、D选项中未注明物质的聚集状态,故C、D选项错误;所以B选项正确。
通过以上的分析和研究,利用图象解题,形象直观。所以,对于没有图象的热化学习题,我们要自己建立一个能量变化图,来提高解题的时效性。
【例5】同温同压下,下列热化学方程式中Q值最大的是(均为放热反应)
( )
【答案】C
【解析】利用例4的方法画出能量变化图,如图9,图中(细线)箭头向下表示是放热过程,向上代表是吸热过程,箭头方向代表由反应物指向生成物,水平的粗线代表一定量的物质的能量,综上所述C项正确。

图9
【适应训练1】
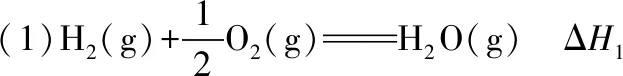


下列关系式中正确的是
( )
A.ΔH1<ΔH3<0 B.ΔH2>ΔH4>0
C.2ΔH1=ΔH2<0 D.2ΔH3=ΔH4>0
【答案】C
【解析】由图10、图11可知A、B项错误,D项,2ΔH3=ΔH4,但小于0,错误;C项,2ΔH1=ΔH2,且小于0,正确。
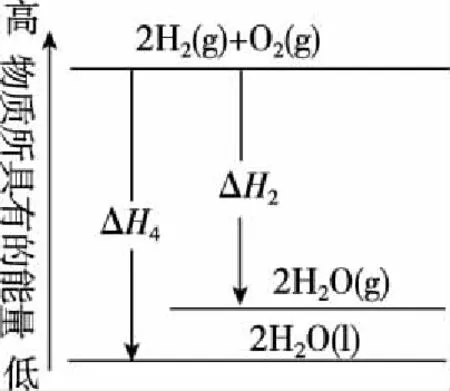
图10
【适应训练2】下列图象(图12)分别表示有关反应的反应过程与能量变化的关系


据此判断下列说法中正确的是
( )
A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定


【答案】A
【解析】反应过程与能量变化的关系图清晰地显示物质的能量大小,可以判定物质的稳定性,以及反应物的总能量与生成物总能量的相对大小,比较反应热的大小,A项正确。
【变式训练1】一些烷烃的燃烧热(kJ/mol)如表:
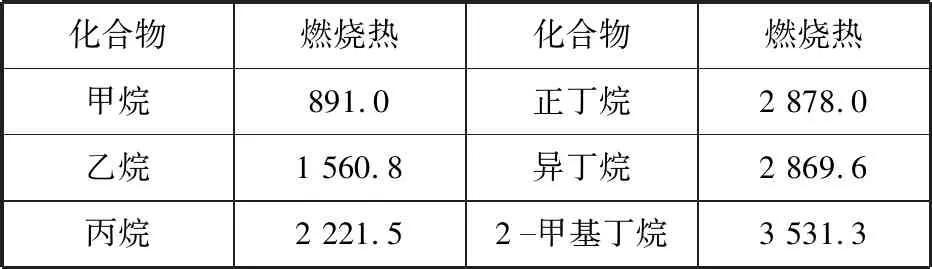
化合物燃烧热化合物燃烧热甲烷891.0正丁烷2 878.0乙烷1 560.8异丁烷2 869.6丙烷2 221.52甲基丁烷3 531.3
下列表达正确的是
( )
A.热稳定性:正丁烷>异丁烷

C.正戊烷的燃烧热大约在3 540 kJ/mol左右
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
【答案】C
【解析】据图13可以快速判断A选项错误;B选项乙烷的计量数应为1,且水的状态应该为液态;根据正丁烷、异丁烷的燃烧热的大小关系,可以推得正戊烷的燃烧热大于2-甲基丁烷的燃烧热,C选项正确;D项根据数据的变化规律可推得是错误的。
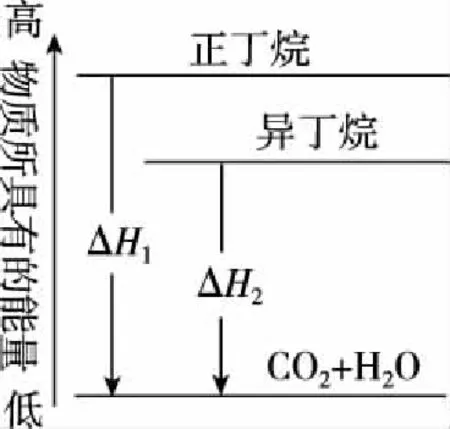
图13
【变式训练2】已知25℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为


据此判断,下列说法正确的是
( )
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
【答案】B
【解析】根据热化学方程式画出图14,根据图象可知,A项正确。
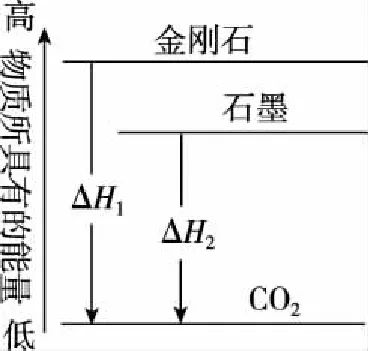
图14
经过以上的分析和总结,我们再来研读例2,画出能量变化图(图15),由图可知,ΔH3>0,ΔH1>0,ΔH2<0,ΔH3>ΔH2,ΔH3>ΔH1,则A项错误、B项正确;ΔH1-ΔH2=ΔH3,ΔH1+ΔH2<ΔH3,则C、D项错误。与常规方法比,这种方法省略了烦琐的过程分析,简单易学。

图15
综上所述,采用能量变化图可以有效回避解题过程中对反应过程的分析以及物质转化过程中能量变化。只要抓住用量、聚集状态及反应物的总能量与生成物总能量的相对大小画出“能量变化图”,不同的反应、不同的过程中无论是ΔH、Q的大小比较,还是守恒关系,就会变得清晰明了。有利于学生加深对能量守恒思想、影响热效应的因素及盖斯定律的理解,有利于把抽象的原理形象化,化繁为简,极大地提高了解题速度和准确性。更重要的是培养了学生利用分析、比较、概括、归纳等方法对所获取的信息进行初步加工和应用的能力,充分挖掘教材中的隐性课程,促进知识的正向迁移。

