慢性酒精摄入通过NO信号通路影响小鼠的运动协调功能
金海燕, 金光林, 董光辉, 崔松彪
酒精,又名乙醇(Ethanol),是最常被滥用的药物之一。当血液中的酒精浓度超过1000 mg/L时,人就有明显的酒精中毒症状,如兴奋、走路不稳、嗜睡、麻醉等。小脑是酒精的重要靶点。小脑参与动物控制运动协调、计划、自主运动的精细调节和认知功能。一氧化氮(Nitric oxide,NO)是一种逆行信使分子,在中枢神经系统中广泛存在,与多种神经系统疾病的发病机制有关[1]。N’-硝基-L-精氨酸(NG-Nitro-L-arginine,L-NNA)是NO合成酶抑制剂。它能够抑制体内合成的NO,从而抑制NO升高所带来的效应。大麻素1受体(Cannabinoid type 1,CB1)分布在脑、脊髓与周围神经中,它与动物的记忆、认知、运动协调等功能方面有关系[2]。在20世纪70~80年代发现,运动学习在一定程度上是在小脑中完成的,且作为一种从适应性控制系统来发挥这一功能[3]。慢性酒精摄入引起的运动行为障碍与脑内NO水平变化有关系,而CB1受体则不参与其中。NO主要在小脑分子层通路中产生,CB1受体也在小脑浦肯野细胞层大量分布[4]。
国内外对急性及慢性酒精对神经系统的研究较多,但对NO信号通路与CB1受体是否参与慢性酒精摄入带来运动行为损伤的研究尚少。本研究主要通过行为学测验方法观察慢性酒精摄入对小鼠运动协调能力的影响,观察慢性酒精摄入对运动行为的影响是否与NO信号通路与CB1受体有关,为探索慢性酒精摄入对小鼠运动协调功能的影响机制提供研究方向。
1 材料和方法
1.1 实验动物 选用6~8周龄,且体重控制在29 g~30 g的ICR小鼠50只,均使用雄性小鼠,由延边大学实验动物中心提供。自由摄食及饮水。本实验的所有操作均未违背国际动物保护条例,并接受延边大学动物保护委员会的监督。
1.2 主要实验器材与材料 行走障碍分析仪,转棒仪,酒精,氯化钠,N’-硝基-L-精氨酸(L-NNA),大麻素1受体抑制剂(AM251)。
1.3 实验动物准备 将小鼠分为5组,即对照组、酒精摄入低剂量组、酒精摄入高剂量组、酒精摄入高剂量+L-NNA组和酒精摄入高剂量+AM251组(每组n=10),并用染毛试剂做好标记。建立动物模型,即对照组腹腔注射9 g/kg生理盐水,低剂量组注射0.8 g/kg酒精,高剂量组注射1.6 g/kg酒精,每组注射周期为28 d。每日上午同一时间段注射,每组注射周期为28 d,起始体重为29 g~30 g。
1.4 行走障碍分析测试 各组模型小鼠腹腔注射结束后第1天,分别将每组小鼠放到行走障碍分析仪上,让小鼠在无任何刺激下主动在行走障碍分析仪上跑动,行走障碍分析仪器的77个传感棒自动记录小鼠步态错误,并自动统计出每根传感棒上的错误次数及时间。每只小鼠测试5次,取5次测试的总错误次数及时间来进行分析。
1.5 加速转棒运动测试 各组模型小鼠腹腔注射结束后第一天,将对照组、低剂量组、高剂量组小鼠进行转棒仪测试。加速模式设定为滚轮的转速在300 s内从4 rpm加速到40 rpm[5]。当小鼠在某个转速下不能被动行走时会掉落,转棒仪自动记录小鼠在转棒仪上持续的时间和掉落时的速度。每只小鼠测3次后取平均值。最后将所有小鼠的持续时间和速度一起进行分析。
1.6 检测慢性酒精摄入是否与NO和CB1受体有关 取20只小鼠,分为两组,先按高剂量浓度酒精注射28 d后的第1天上午分别腹腔注射1 mg/kg剂量的一氧化氮氧合酶抑制剂(L-NNA)和10 mg/kg剂量的大麻素受体1(CB1)受体抑制剂(AM251),然后分别在行走障碍分析仪和转棒仪上测试。研究L-NNA和AM251对酒精摄入引起的运动协调性损伤的影响。
1.7 测试酒精摄入影响的消退时间 将高剂量组的小鼠10只,在结束腹腔注射酒精后的1 d、1 w、2 w、3 w时分别按上述方式在行走障碍分析仪和转棒仪上测试。
2 结 果
2.1 慢性酒精摄入对行走运动协调的影响 经过28 d的酒精摄入,我们利用行走障碍分析仪观察了酒精对行走运动的影响。长期酒精摄入后,可剂量依存地增加四肢行走的错误率。典型例子(见图1A、B),1例酒精高剂量组小鼠四肢在一次测试中一共出现3次错误,错步共持续48 ms,分别出现在第13和38传感棒上。酒精低剂量(0.8 g/kg)组小鼠四肢(见图1C)和前肢(见图1E)行走错误次数显著高于对照组(P<0.05);而高剂量(1.6 g/kg)组小鼠四肢(见图1C)和前肢(见图1E)行走错误次数显著高于低剂量组(P<0.05)。此外, 酒精摄入不仅增加四肢行走错误次数,而且显著增加错步持续时间,低剂量组小鼠四肢(见图1D)和前肢(见图1F)行走错步持续时间显著长于对照组(P<0.05),而高剂量组小鼠四肢(见图1D)和前肢(见图1F)行走错步持续时间显著高于低剂量组(P<0.05)。
2.2 慢性酒精摄入对平衡调节的影响 经过28 d的酒精摄入,利用转棒仪观察了酒精对平衡调节的影响。长期酒精摄入后,可剂量依存地缩短小鼠在加速转棒上的持续时间,同样,掉落时的转速也剂量依存地减慢。低剂量组小鼠在加速转棒上的持续时间显著短于对照组(P<0.05);而高剂量组小鼠在加速转棒上的持续时间短于低剂量组(P<0.05)(见图2A)。低剂量组小鼠掉落时的转速显著慢于对照组(P<0.05);而高剂量组小鼠掉落时的转速慢于低剂量组(P<0.05)(见图2B)。
2.3 NO合成酶抑制剂对酒精摄入引起的行走运动损伤的影响 在高剂量酒精摄入结束后的第一天小鼠腹腔注射NO合成酶抑制剂(L-NNA),然后利用行走障碍分析仪观察了NO合成酶抑制剂对慢性酒精摄入引起的行走运动损伤的影响。给高剂量组小鼠腹腔注射NO合成酶抑制剂后发现,能减少高剂量组小鼠四肢行走的错误率。典型例子(见图3A、B),1例酒精摄入高剂量+L-NNA组小鼠四肢在一次测试中一共出现一次错误,错步共持续16 ms,出现在第27个传感棒上。酒精摄入高剂量+L-NNA组小鼠四肢(见图3C)行走错误次数显著低于高剂量组(P<0.05);酒精摄入高剂量+L-NNA组小鼠四肢(见图3D)错步持续时间显著短于高剂量组(P<0.05)。
2.4 NO合成酶抑制剂对酒精摄入引起的平衡调节损伤的影响 在高剂量酒精摄入结束后的第一天小鼠腹腔注射NO合成酶抑制剂(L-NNA),然后利用转棒仪观察了NO合成酶抑制剂对慢性酒精摄入引起的平衡调节损伤的影响。小鼠腹腔注射NO合成酶抑制剂后也发现,能延长高剂量组小鼠在转棒上的持续时间。酒精摄入高剂量+L-NNA组小鼠在加速转棒上的持续时间(见图4A)显著长于高剂量组(P<0.05);酒精摄入高剂量+L-NNA组小鼠掉落时的转速(见图4B)显著快于高剂量组(P<0.05)。上述结果表明,NO合成酶抑制剂能够改善酒精摄入对行走运动损伤作用。
2.5 抑制CB1受体对酒精摄入引起的行走运动损伤的影响 在高剂量酒精摄入结束后的第一天小鼠腹腔注射CB1受体抑制剂(AM251),然后利用行走障碍分析仪观察了CB1受体抑制剂对酒精摄入引起的行走运动损伤的影响。典型例子(见图5A、B),1例酒精摄入高剂量+AM251组小鼠四肢在一次测试中一共出现两次错误,错步共持续48 ms,分别出现在第33和60传感棒上。给高剂量组小鼠腹腔注射CB1受体抑制剂后发现,不能减少高剂量组小鼠四肢行走的错误率,酒精摄入高剂量+AM251组小鼠四肢(见图5C)行走错误次数与高剂量组没有差异(P>0.05);酒精摄入高剂量+AM251组小鼠四肢(见图5D)错步持续时间与高剂量组没有差异(P>0.05)。上述结果表明,CB1受体阻断剂不能改善酒精摄入对行走运动的损伤作用。
2.6 抑制CB1受体对酒精摄入引起的平衡调节损伤的影响 在高剂量酒精摄入结束后的第1天小鼠腹腔注射CB1受体抑制剂(AM251),然后利用转棒仪观察了CB1受体抑制剂对酒精摄入引起的运动协调损伤的影响。给高剂量组小鼠腹腔注射CB1受体抑制剂后发现,不能延长高剂量组小鼠在转棒上的持续时间,酒精摄入高剂量+AM251组小鼠在加速转棒上持续时间(见图6A)与高剂量组没有差异(P>0.05);酒精摄入高剂量+AM251组小鼠掉落时的转速(见图6B)与高剂量组没有差异(P>0.05)。上述结果表明,CB1受体阻断剂不能改善酒精摄入对平衡调节的损伤作用。
2.7 慢性酒精摄入引起运动协调功能损伤的消退过程 在酒精摄入高剂量组小鼠停止酒精摄入后1 d(0 w)、1 w、2 w、3 w时的行走障碍分析测试及加速转棒测试结果表明:小鼠四肢行走错误次数及错步持续时间逐渐减少(见图7A、B),3 w后消失,行走运动功能恢复到酒精摄入前水平(P<0.05);小鼠在加速转棒上的持续时间及掉落时的转速逐渐延长及加快(见图7C、D),3 w后恢复到酒精摄入前水平(P<0.05)。综上所述,长期酒精摄入引起运动协调功能的损伤作用随着酒精摄入的停止可逐渐消退,恢复到酒精摄入前水平。
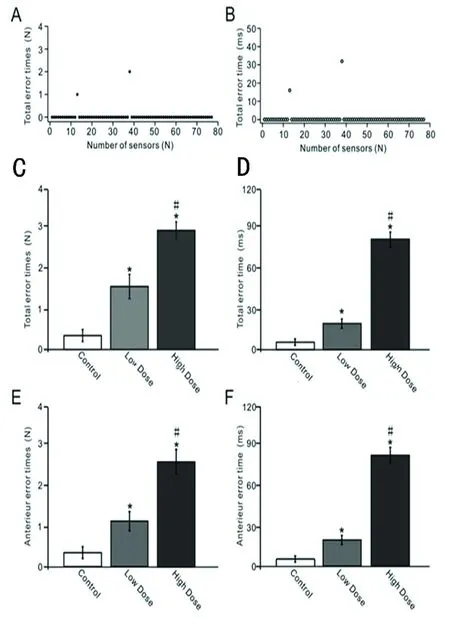
A:1例高剂量组小鼠在一次测试中的四肢行走错误次数;B:1例高剂量组小鼠在一次测试中的四肢行走错步持续时间;C:不同剂量酒精摄入对四肢行走错误次数的影响;D:不同剂量酒精摄入对四肢行走错步持续时间的影响;E:不同剂量酒精摄入对前肢行走错误次数的影响;F:不同剂量酒精摄入对前肢行走错步持续时间的影响。与对照组相比*P< 0.05;与低剂量组比较#P<0.05
图1 慢性酒精摄入对行走运动协调的影响
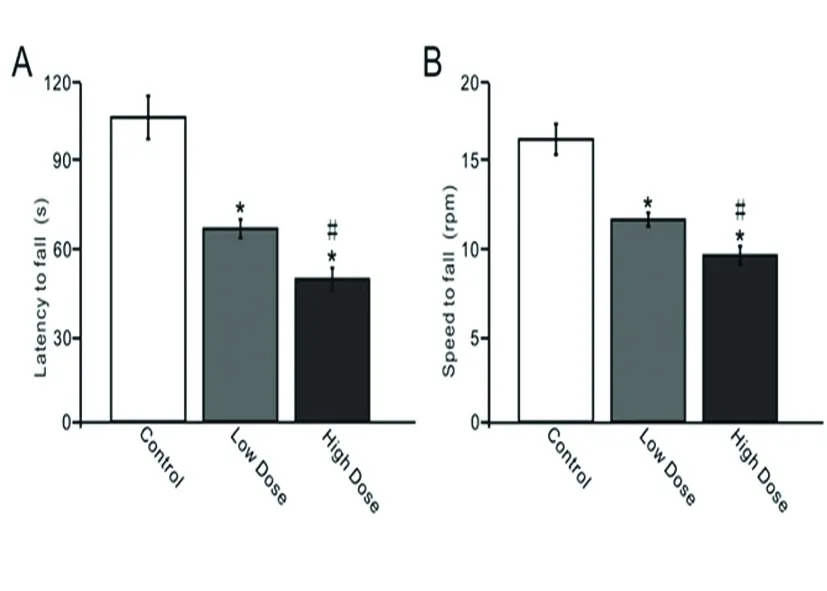
A:不同剂量酒精摄入对小鼠在转棒仪上的持续时间的影响;B:酒精摄入对小鼠从转棒仪上掉落时转速的影响。与对照组相比*P<0.05;与低剂量组比较#P<0.05
图2 慢性酒精摄入对平衡调节的影响
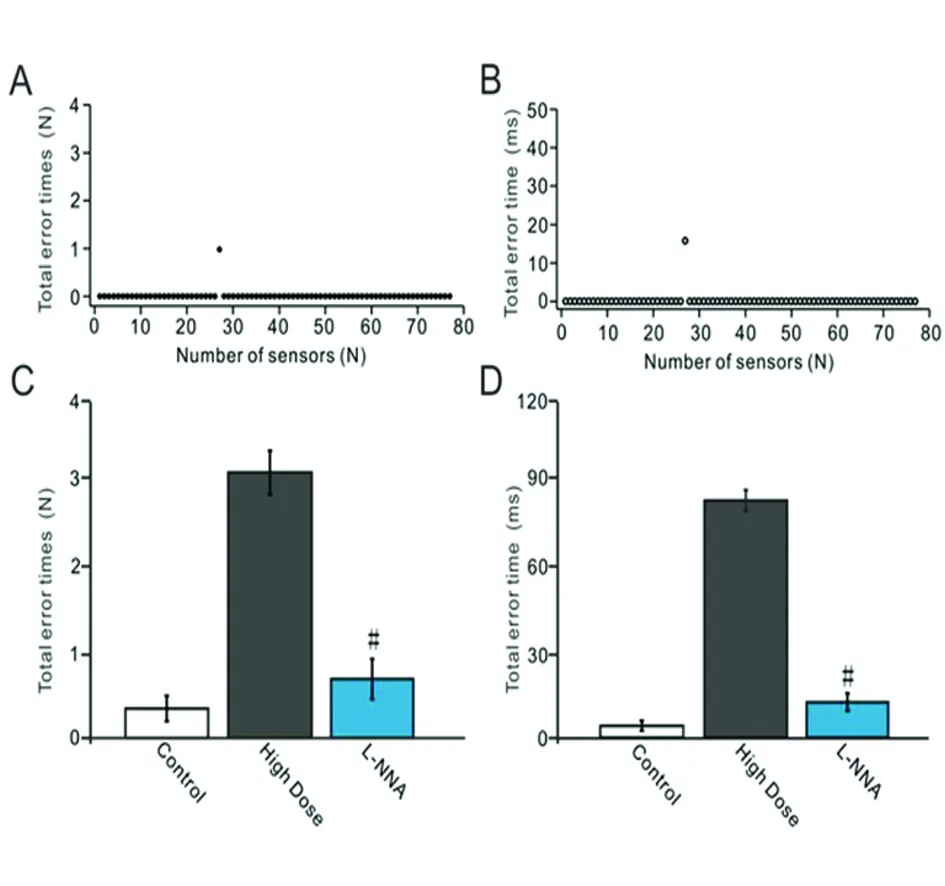
A:NNA组小鼠在1次测试中的四肢行走错误次数;B:1例L-NNA组小鼠在1次测试中的四肢行走错步持续时间;C:对照组、酒精摄入高剂量组和L-NNA组的四肢行走错误次数;D:对照组、酒精摄入高剂量组和L-NNA组的四肢行走错步持续时间。与高剂量组比较#P<0.05
图3 NO合成酶抑制剂对酒精摄入引起的行走运动损伤的影响
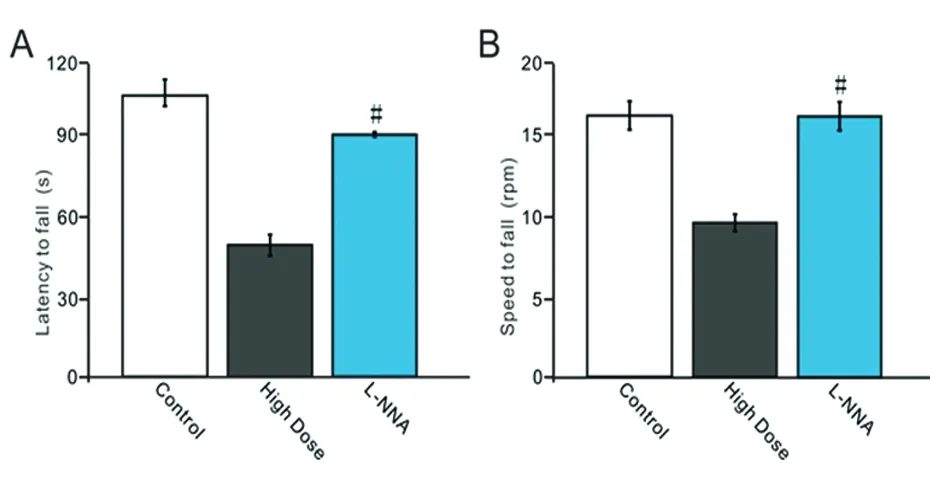
A:对照组、酒精摄入高剂量组和L-NNA组小鼠在转棒仪上的持续时间;B:对照组、酒精摄入高剂量组和L-NNA组小鼠从转棒仪上掉落时的转速。与高剂量组比较#P<0.05
图4 NO合成酶抑制剂对酒精摄入引起的平衡调节损伤的影响
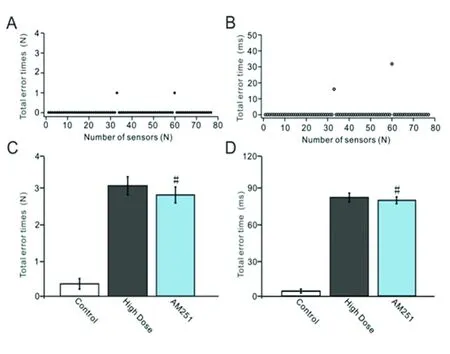
A:1例AM251组小鼠在一次测试中的四肢行走错误次数;B:1例AM251组小鼠在一次测试中的四肢行走错步持续时间;C:对照组、酒精摄入高剂量组和AM251组的四肢行走错误次数;D:对照组、酒精摄入高剂量组和AM251组的四肢行走错步持续时间。与高剂量组比较#P>0.05
图5 抑制CB1受体对酒精摄入引起的行走运动损伤的影响
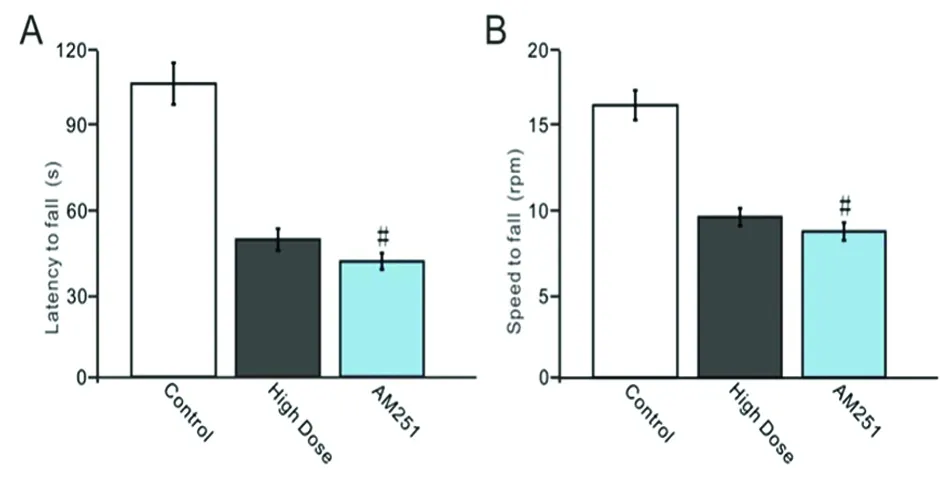
A:对照组、酒精摄入高剂量组和AM251组小鼠在转棒仪上的持续时间;B:对照组、酒精摄入高剂量组和AM251组小鼠从转棒仪上掉落时的转速。与高剂量组比较#P>0.05
图6 抑制CB1受体对酒精摄入引起的平衡调节损伤的影响

A:停止酒精摄入后,四肢行走错误次数的消退过程;B:停止酒精摄入后,四肢行走错误持续时间的消退过程;C:停止酒精摄入后,小鼠在转棒仪上的持续时间逐渐延长的过程;D:停止酒精摄入后,小鼠掉落时的转速逐渐增快的过程。与停止注射酒精后1 d(0 w)比较#P<0.05
图7 慢性酒精摄入引起运动协调功能损伤的消退过程
3 讨 论
本实验主要通过建立不同剂量的慢性酒精摄入的模型小鼠,利用行走障碍分析仪和转棒仪观察慢性酒精摄入对运动协调的影响,观察酒精摄入引起的运动协调损伤作用与酒精摄入停止的关系;观察NO氧合酶抑制剂和CB1受体抑制剂对酒精摄入引起的运动协调损伤的影响。本研究的结果主要发现慢性酒精摄入可剂量依存地导致小鼠的步态错误次数和错步持续时间显著增加,在转棒上的持续时间明显缩短,对转棒仪的转速要求明显减小,提示酒精摄入对运动协调的损伤作用具有剂量依存性。然而值得注意的是:腹腔注射NO合成酶抑制剂改善酒精摄入对运动协调的损伤作用,显著减少步态错误次数和错步持续时间降低,明显增加转棒上持续时间及转速。我们的研究成果表明慢性酒精摄入通过NO信号通路损伤小鼠运动调节功能。
事实上,酒精对大脑功能的影响主要发生在低浓度到100 mmol的范围内[6],且低浓度酒精的作用在人和动物身上表现不同[7]。慢性酒精暴露和酒精使用障碍对社会的负面影响较大,包括人际关系的不协调、失业、精神症状、肝功能衰竭和严重的认知障碍[8]。酒精摄入引起的运动协调、平衡、行为、言语和认知功能的改变被认为一部分是由小脑功能受损所介导的[9]。在本实验结果显示酒精可剂量依存地损伤运动行为功能,此结果与Laurent Servais等研究的结果一致[10],表明慢性酒精摄入对运动协调功能损伤有显著影响,它的影响表现在主动性和被动性的行走功能。慢性酒精中毒导致的肢体震颤及行走不稳等症状甚至可持续到清醒后状态。本实验结果表明:慢性酒精摄入可剂量依存地导致小鼠的步态错误次数和错步持续时间显著增加,在转棒上的持续时间明显缩短,对转棒仪的转速要求明显减小,提示酒精摄入对运动协调的损伤作用具有剂量依存性。
酒精可通过直接增强外源性GABAA受体发挥作用,也可通过抑制钠钾依赖式ATP酶、钾通道和神经元一氧化氮合酶,间接地增加自发性高尔基细胞的放电[11]。在体内条件下,长期系统地给予酒精会导致NO水平的剂量依赖性增加,说明酒精的消耗可能导致NO水平的增加。它还可以促进细胞毒性的形成,如过氧化亚硝酸盐的形成,可能与高度损害蛋白质和细胞膜有关[12]。本实验结果表明,长期腹腔注射高剂量酒精的小鼠注射了L-NNA后,发现其对运动行为的改变明显好转,从而说明酒精的消耗引起NO水平的升高,且NO水平的上升与运动行为损伤机制有关。CB1受体在小脑、基底核有分布,它也参与共济失调、不随意运动等,由此可猜想慢性酒精摄入带来的运动行为障碍可能与CB1受体相关。然而,本实验中发现,当给高剂量组小鼠注射CB1受体抑制剂后,并未发现小鼠运动行为得以改善。这能间接说明,脑消耗酒精导致运动行为损伤时并没有CB1受体参与其中。
综上所述,本研究发现慢性酒精摄入可剂量依存地损伤运动协调功能,腹腔注射NO合成酶抑制剂能够改善酒精摄入对运动协调的损伤作用,显著减少步态错误次数和降低错步持续时间,明显增加转棒上持续时间及转速。本研究结果表明慢性酒精摄入是通过NO信号通路来损伤小鼠运动调节功能。

