阿尔茨海默病谱系患者的海马亚区体积损害特征
罗财妹, 李梦春, 秦若梦, 刘任远, 杨 丹, 黄丽丽, 赵 辉, 柏 峰, 徐 运
阿尔茨海默病(Alzheimer’s disease,AD)以记忆功能逐渐丧失为临床特征。遗忘型轻度认知障碍(amnestic mild cognitive impairment,aMCI)是AD的前驱期[1]。主观认知下降(subjective cognitive decline,SCD)是AD的临床前期,指患者主观感受记忆下降明显,但客观神经心理测试结果正常[2]。
海马是记忆系统的重要组成部分,其由功能特点不同的亚区组成,AD疾病进程中各亚区受累情况不一样[3]。海马萎缩是临床判断AD最有效便捷及应用广泛的生物标志物之一[4]。既往多数研究只关注海马整体在AD过程中的萎缩情况,而在不同病程中对各个亚区萎缩模式缺乏相关研究,尤其是SCD阶段[4]。本研究旨在基于3.0 3DT1结构磁共振及FreeSurfer 6.0[5]软件精细分区的方法,探讨SCD、aMCI及AD患者海马亚区体积的变化规律,并进一步分析亚区体积与记忆功能的相关性。
1 资料与方法
1.1 研究对象及分组 收集2016年6月-2019年5月至南京大学医学院附属鼓楼医院神经内科门诊就诊的151例受试者进行神经心理学测试及3.0T磁共振扫描。本研究经南京大学医学院附属鼓楼医院道德伦理委员会审核批准,所有受试者或其家属签署知情同意书。
神经心理学评估:简明智能状态检查量表(mini-mental state examination,MMSE)、蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)评估总体认知水平。MoCA评分划分认知障碍界值:文盲:≤13分;小学(1~6 y):≤19分;初中(7~12 y):≤24分;高中以上(>12 y):≤25分。听觉词语学习测试(Auditory Verbal Learning Test,AVLT)评估记忆功能[6],延迟回忆得分划分记忆障碍界值为:50~60岁:≤4分;60~70岁:≤3分;70岁以上:≤2分。所有认知测试均由同一位经验丰富的精神科医生执行。研究对象分组:正常对照组(Normal control,NC)纳入标准:(1)无认知障碍主诉;(2)认知功能测试在相应年龄和教育年限正常范围。SCD组纳入条件符合SCD-I[7]推荐标准:(1)与先前自我状态相比,自我感觉记忆持续下降,并为此感到担忧于门诊就诊;(2)记忆下降出现在近5 y内;(3)MMSE、MoCA及AVLT测试评分均在相应教育年限或年龄的正常范围内。aMCI组纳入条件符合Petersen[1]标准:(1)记忆障碍主诉,并被知情人证实;(2)MoCA评分提示认知障碍且MMSE评分≥24分;(3)AVLT-延时回忆评分低于正常对照1.5个标准差;(4)非痴呆。AD的入组标准符合美国老年痴呆症协会(National Institute of Aging Alzheimer’s Association,NIA-AA)[8]推荐标准的很可能AD。所有受试者排除标准:(1)年龄低于50岁;(2)卒中病史;(3)血管性痴呆、帕金森病、癫痫、占位、中枢神经系统感染及其他引起认知下降的神经系统疾病;(4)严重抑郁症、精神分裂症等精神心理疾病患者;(5)严重的系统性疾病和代谢障碍疾病;(6)药物、酒精成瘾病史;(7)核磁不能耐受或不能配合完成神经心理学测试;(8)其他可能影响认知功能的疾病。
1.2 临床资料收集 采集受试者年龄、性别、受教育年限、高血压病史、糖尿病病史、高血脂病史、基础疾病情况及吸烟饮酒个人史。由本院经验丰富的神经科医生进行规范的神经系统体格检查。
1.3 影像数据采集 应用荷兰飞利浦公司3.0 T磁共振仪行头部MRI检查。扫描序列包括:弥散加权成像(DWI)、T1加权成像、T2加权成像。3DT1采用三维快速自旋回波序列,扫描参数:重复时间=9.9 ms,回波时间=4.6 ms,倾倒脚=8°,平面分辨率=1.0 mm2,视野=256×256 mm,矩阵256×256,层厚1 mm,扫描时间6分47秒。
1.4 海马分割及体积计算 FreeSurfer图像分析软件包(version 6.0.0,http://freesurfer.net/)处理3D T1MRI 图像。主要步骤如下:(1)运行dcm2nii和mri_convert命令将原始的DICM格式转化为mgz格式;(2)头动校正,去除非脑组织;(3)配准至Talairach标准空间系统;(4)概率脑图谱分割皮质下和皮质结构;(5)根据FreeSurfer内设模块将海马分割为12亚区[5]:海马尾、下托、CA1、海马裂、前下托、旁下托、分子层、齿状回、CA3、CA4、海马伞及海马杏仁核过渡区(Hippocampus amygdala transition area,HATA),同时估算总颅内体积(estimated total intracranial volume,eTIV),该步骤由recon-all命令完成。

2 结 果
2.1 临床资料和神经心理学测试 4组的年龄、性别、血管危险因素无统计学差异。AD组教育年限显著低于其他3组。SCD组与NC组比较,MMSE、MoCA、AVLT-即刻、AVLT-延时、AVLT-再认评分均无统计学差异。aMCI组和AD组MoCA、AVLT测试评分均显著低于NC组。4组颅内总体体积大小相匹配(见表1)。
2.2 海马整体体积及海马亚区比较 4组左右侧海马整体体积有显著差异(P<0.05/13);除右侧海马裂、右侧旁下托外,其余海马亚区体积4组间均有统计学差异(P<0.05/13)(见图1)。事后比较显示,左右侧海马整体体积、左右侧海马分子层、左侧海马齿状回、左侧CA4体积每两组间存在显著差异(P<0.05)。与NC组比较,SCD组双侧海马尾、分子层、齿状回,左侧CA3、CA4、HATA体积显著下降(P<0.05);aMCI 相比于NC组,双侧海马尾、下托、CA1、前下托、分子层、齿状回、CA3、CA4、HATA以及左侧旁下托体积显著下降;AD组内通过校正的亚区体积均显著低于NC组(见图1)。
2.3 偏相关分析结果 在SCD组内,海马亚区体积与AVLT测试评分无相关性(P>0.05);aMCI组左侧海马尾部与AVLT-再认评分显著相关(P<0.05);AD组左右侧下托,左右侧前下托,左侧海马裂、旁下托、分子层、齿状回、CA4、HATA、右侧海马伞体积与AVLVT-延时回忆评分相关(P均<0.05)(见图2)。

表1 人口统计、临床资料及神经心理评估结果
注:NC:正常对照;SCD:主观认知障碍;aMCI:遗忘型轻度认知障碍;AD:阿尔茨海默病;MMSE:简易智能状态评价量表;MoCA:蒙特利尔认知评估;AVLT:听觉词语学习测试;eTIV:估计总颅内体积;与正常对照相比aP<0.05;与主观认知障碍相比bP<0.05;与遗忘型轻度认知障碍相比cP<0.05
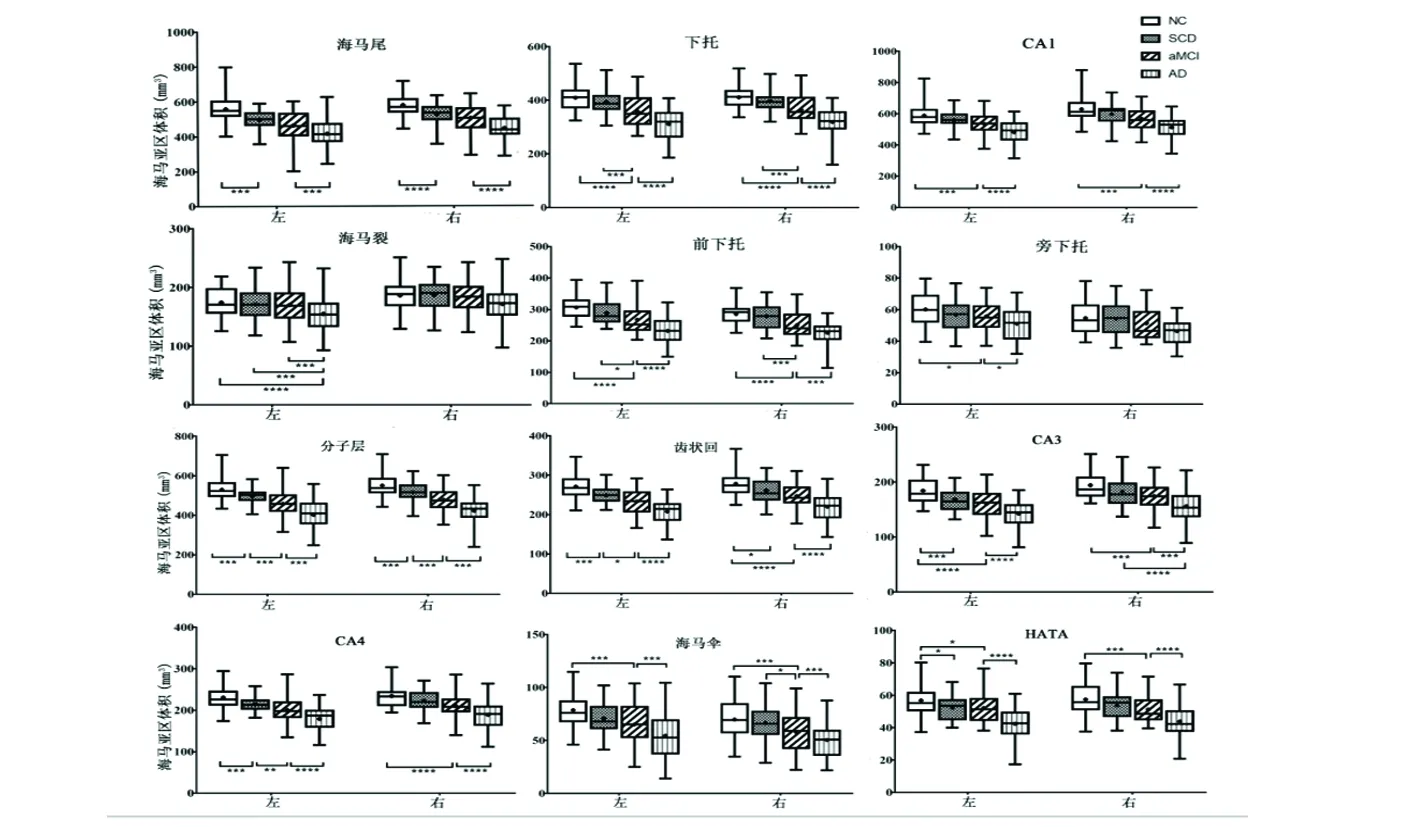
图1 海马亚区组间事后分析,*P<0.05,**P<0.01,***P<0.0083(0.05/6),****P<0.001

图2 aMCI 组、AD组偏相关分析结果(校正年龄、性别、教育年限、颅内总体积)
3 讨 论
海马是储存和检索记忆重要的神经解剖学基础,与皮质及皮质下结构有着广泛联系[3]。AD认知损害以情景记忆为主,其发生发展与海马结构异常密切相关。既往研究证明,aMCI和AD患者海马不同程度萎缩,SCD患者其结构磁共振已可检测到海马萎缩[9]。在AD疾病进展中,海马各亚区受累的情况不尽相同。FreeSurfer 6.0版本的海马亚区分割是一种新颖的全自动算法,该算法比原先低版本算法具有更高的精度,亚区分割的准确性提高[5]。
本研究结果显示,SCD aMCI和AD组双侧海马总体积较NC组显著下降。与本研究结果相似,Nadine等发现SCD患者双侧海马体积减小[10],海马萎缩在AD发展中几乎普遍存在,敏感性较高。既往研究也发现SCD患者脑脊液tau高水平,颞叶淀粉样蛋白沉积增加及低代谢等类似AD的病理改变[11]。临床实践中,相比于其他检测技术,结构磁共振具备无创、经济而便捷等优势。通过计算海马体积对筛查高AD风险SCD患者,助力于AD早期诊断、疗效和预后判断。
与NC比较,AD和aMCI患者的海马尾、下托、前下托、旁下托、分子层、齿状回、CA1、CA3、CA4、海马伞、HATA亚区体积显著下降,SCD患者双侧的海马尾、分子层、齿状回、左侧CA3、CA4、HATA体积显著降低。这与近期研究报道一致[12]。同时SCD组双侧的CA1、左侧前下托、左侧旁下托、右侧的下托、CA3、CA4体积显示下降趋势。海马主要信息输入通路是从内嗅皮质至齿状回和CA3区的椎体神经元,输出通路始于海马脚(CA1-CA4)或下托,投射至前后扣带回皮质、后压部皮质、前额和颞叶等脑区[13],这些通路相互作用共同负责记忆的编码、巩固、提取过程。病理学研究发现,细胞外神经元纤维缠结、神经元和突触的丢失是海马萎缩的主要病理机制,AD患者CA1区神经元丢失率高达68%,下托达47%,是神经元丢失最严重的两个亚区,其次是CA3、CA4/齿状回[4]。MCI患者中也发现相似的亚区萎缩模式,MCI患者CA1和下托体积萎缩率分别为20%、15%,此类患者进展痴呆的风险较高[4]。本研究中观察到AD、aMCI患者CA1和下托萎缩明显,SCD患者只显示出体积下降趋势,可能受样本量小的影响,也可能因为本研究纳入的SCD患者症状轻微。
本研究还发现SCD、aMCI、AD患者分子层、齿状回、CA4体积随疾进展呈现显著下降模式,这几个亚区具有丰富的纤维联系和神经突触,在海马内在联系和外部信息接收中发挥重要作用[14]。分子层体由下托和海马角区之间的中间神经元神经突触组成,起调节海马活动作用[5],体积萎缩提示锥体细胞和中间神经元突触病变,推测其可能在AD致病机制中起一定作用。CA4亚区位于齿状回内部,共同接收大脑皮质的兴奋性信息,是海马三突触环路中的第一个突触连接[5],CA4亚区和齿状回神经突触丢失影响大脑皮质至海马的信息输入,推测CA4亚区及齿状回可能是发病机制中的重要位点。SCD阶段检测CA4和齿状回体积利于筛选高AD风险人群。
Carlesimo等报道AD患者CA3、CA4、齿状回、下托体积与延时回忆和即刻回忆显著相关;前下托体积与延时回忆相关;MCI患者下托、前下托体积与即刻回忆相关[15]。本研究中AD患者CA4、齿状回、下托、前下托、分子层、旁下托和HATA与延时回忆评分相关。旁下托和HATA体积萎缩可能影响海马-杏仁核网络的完整性而导致记忆功能障碍[16]。组织学研究发现分子层突触的数量与延迟回忆能力相关[17]。AD患者右侧海马伞体积也与延时回忆相关。海马伞是海马神经纤维发出的组成穹隆的白质结构,穹隆是海马记忆环路的重要组成部分,穹隆体积减少与延时回忆、即刻回忆相关[18]。海马尾部与内侧前额叶、丘脑、后扣带皮质功能联系紧密,本研究中aMCI患者左侧海马尾与AVLT-再认评分相关,推测海马尾与长期记忆功能密切相关,但需进一步验证。
本文是小样本横断面研究,有待大样本随访研究的验证。研究只关注了海马灰质结构的变化,未考虑海马功能及白质的影响。我们将扩大样本,结合多个模态的影像数据,综合分析海马亚区在阿尔茨海默病病程中的变化,以期找到AD疾病早期诊断和监测病情的有效影像标志物。
4 结 论
SCD患者海马总体积和部分海马亚区体积出现萎缩。随着疾病的加重,海马双侧分子层、左侧海马齿状回、CA4亚区体积显著下降模式。下托、前下托、旁下托、CA4、齿状回、分子层、HATA、海马伞、海马尾部体积与记忆功能相关。

