大脑中动脉深穿支孤立性梗死进展性运动功能缺损的危险因素分析
侯明月, 赵子慧, 宋贵军
进展性运动功能缺损(progressive motor deficits,PMD)是进展性脑梗死的表现形式之一,强调局灶性运动功能的恶化,最终可能进展为严重残疾,导致患者的预后不良[1]。研究表明,由穿支动脉闭塞所致的皮质下梗死是引起PMD的主要卒中类型,约有20%~30%的孤立性皮质下梗死患者在发病后出现PMD,其中最常见病变在大脑中动脉深穿支[2]。与此同时,有研究显示,发病时NIHSS评分、高血压和糖尿病史、血脂、同型半胱氨酸、发热和炎症因子、纤维蛋白原等临床和生化指标都可能预测PMD的发生[3~10],近年来,研究显示脑梗死影像学特征,可能是PMD发生的有力预测因素[11,12]。故本实验拟通过比较PMD组和非PMD组大脑中动脉深穿支孤立性梗死的临床特点、生化指标以及影像学特征等差异,探讨PMD发生的预测因素。
1 对象和方法
1.1 研究对象 本研究前瞻性地连续收集2017年6月-2018年12月大连医科大学附属第二医院神经内科住院部收治的大脑中动脉深穿支供血区脑梗死患者,共185例。符合入选条件:(1)年龄18~85岁;(2)急性起病,症状发生后72 h内收治入院,存在神经功能缺损症状;(3)脑梗死诊断标准符合2014年制定的《中国急性缺血性脑卒中诊治指南》;(4)均经头部磁共振成像(magnetic resonance imaging,MRI)、弥散加权成像(diffusion weighted imaging,DWI)、磁共振血管成像(magnetic resonance angiography,MRA)证实为大脑中动脉深穿支供血区孤立性梗死灶;(5)排除有严重痴呆或精神疾病患者;皮质梗死、分水岭梗死、大面积脑梗死和DWI提示急性多发性脑梗死患者;既往卒中遗留明显神经功能缺损患者;存在心源性脑栓塞、出血性卒中、颅内感染及占位性病变患者;伴有严重心脏、肝脏、肾脏功能衰竭、帕金森病或帕金森综合征患者;起病时伴有意识障碍或病情进展后出现意识障碍的患者;伴有皮质缺损症状,如失语、失用、偏身忽视、视野缺损等患者。入组患者均按照规范化治疗方案,予抗血小板聚集、营养神经、改善循环治疗;对于施行rt-PA溶栓的患者,24 h后复查头部CT未见出血后予以规范化治疗。PMD定义为缺血性卒中发病后5 d内,美国国立卫生研究院卒中量表(National Institute of Health Stroke Score,NIHSS)评分中运动项目评分增加≥2分,且持续时间至少24 h[13]。将患者分为两组,PMD组53例,非PMD组132例。
1.2 研究方法
1.2.1 一般资料 详细记录患者年龄、性别、BMI指数、既往TIA/卒中病史、高血压病史、糖尿病史、入院时收缩压(SBP)和舒张压(DBP)水平、血脂异常、既往用药史、发病至入院时间、是否行rt-PA溶栓治疗、住院天数,患者入院后第1~5天和第7天同一时间,由同一名对患者资料不了解的受规范化培训的神经内科医师重复进行NIHSS评分并记录。对入组患者依据CCS分型标准划分卒中病因亚型[14]。
1.2.2 生化资料 详细记录入院后血脂(总胆固醇、甘油三酯、LDL-C)、同型半胱氨酸、血常规(白细胞计数、血红蛋白、血小板计数)、血凝常规(PT、APTT、INR、纤维蛋白原)、尿素氮。
1.2.3 影像学资料 所有患者在知情同意的情况下于入院后行颈部血管彩超检查,记录颅外段血管动脉粥样硬化情况;入院7 d内完成1.5T磁共振检查,检查序列包括T1加权成像(T1-weighted imaging,T1WI)、T2加权成像(T2-weighted imaging,T2WI)、液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)、弥散加权成像(diffusion-weighted imaging,DWI)和磁共振血管造影(magnetic resonance angiography,MRA),记录患者梗死部位、梗死区直径、梗死累及层数、梗死体积、颅内动脉狭窄情况、脑白质病变情况。
1.2.4 诊断标准 PMD诊断标准:缺血性卒中发病后5 d内,美国国立卫生研究院卒中量表(National Institute of Health Stroke Score,NIHSS)评分中的运动项目评分增加≥2分,且持续时间至少24 h[13]。颅外段颈动脉粥样硬化评估:将彩色超声诊断仪器的探头频率调整为7~14 MHz,充分暴露受检者颈部,利用超声探头观察颅外段动脉直径、狭窄程度和内膜厚度等情况,并记录检查所得数据。动脉粥样硬化阴性:彩超未见明显异常患者;动脉粥样硬化阳性:提示存在均质和/或不均质斑块患者;均质斑块:指提示均匀一致的低回声、等回声或强回声信号;不均质斑块:斑块内回声不均匀,大于20%。梗死灶评估:(1)梗死部位划分:根据头部DWI影像梗死灶分布特点定义放射冠“后部”。分型方法:在包括放射冠在内的所有轴位DWI影像中,自上而下选取第二个层面,在侧脑室前角和后角各画一条切线,并根据这两条线之间的中线将放射冠分为前半部和后半部。后部:邻近侧脑室旁的放射冠病变一半以上位于后半部(见图1、2),其他归为“非后部”梗死(见图3)[15];(2)梗死层数:定义为DWI上可见到梗死灶的层数,以评估病变的垂直延伸;(3)梗死体积:参考多田公式计算梗死灶体积=a、b、c 0.5 层厚。a=DWI最大梗死面积层面的最长直径(cm);b=DWI最大梗死面积层面与最长直径垂直的最长横径(cm);c=DWI梗死层数;层厚=5 mm。颅内动脉狭窄评估:依据头部MRA影像,主要评价病灶侧及病灶对侧颈内动脉海绵窦段和床突上段、大脑中动脉M1段、大脑前动脉A1、A2段、大脑后动脉P1、P2段、椎动脉和基底动脉。狭窄率计算方法:(Da-Db)/Da 100%,Da取正常血管直径,选取该动脉狭窄近端正常动脉最宽处测量;Db代表狭窄处直径。血管狭窄率>50%定义为血管狭窄[16];脑白质病变分级:采用Fazekas分级标准。依据头部MRI的T1和T2序列图像:T2加权图像高信号,而T1加权图像上不存在低信号被认为是脑白质损害的表现。根据T2加权图像分为脑室旁高信号和深部脑白质高信号,脑室旁高信号评分:0分:无病变;1分:铅笔样薄层改变;2分:呈光滑的晕圈;3分:不规则信号,向深部延伸。深部白质高信号评分:0分:无病变;1分:点状病变;2分:点状病变融合;3分:大片融合病灶。分别记分后相加计算总分,划分4级:0级:0分;1级:1~2分;2级:3~4分;3级:5~6分。将0级和1级归为轻度脑白质病变;2级和3级归为重度脑白质病变[17]。
1.2.5 设备参数 (1)颈部血管彩超:超声诊断仪器探头频率范围为7~14 MHz;(2)磁共振成像:应用1.5T HDXT GE美国通用磁共振仪完成头部MRI检查,项目包括垂直脑干轴位常规自旋回波序列T1加权成像(T1WI)、T2加权成像(T2WI)、液体衰减反转恢复序列(FLAIR)和弥散加权成像(DWI),完成磁共振血管造影(MRA)。扫描序列参数如下:(1)T1WI:重复时间(repetition time,TR)/回波时间(echo time,TE):2500/24 ms,层厚:6 mm,视野:240 mm×240 mm,激励次数:2次;T2WI:TR/TE:4000/102 ms,层厚:6mm,视野:240 mm×240 mm,激励次数:2 次;DWI:TR:4800,层厚:5 mm,弥散方式:3-Scan Trace,b值:0/1 000,至少包括脑桥自头端至尾端3个解剖层面。

2 结 果
2.1 进展组与非进展组一般临床资料及实验室指标对比分析 共纳入185例大脑中动脉深穿支孤立性梗死患者,其中53例(28.6%)发生进展性运动功能缺损(PMD组),122例未发生进展性运动功能缺损。将两组患者的人口学特征、临床和实验室资料进行单因素分析提示,女性、既往脑梗死/TIA病史、发病到入院的时间短、平均住院天数长、出院时NIHSS评分高、总胆固醇和纤维蛋白原指标高的梗死患者PMD阳性发生率较高,比较差异有统计性(P<0.05);而年龄、BMI指数、初始NIHSS评分和初始的血压水平等其他卒中危险因素在两组间无显著性差异,本研究的结果提示溶栓并不能显著降低PMD的发生(见表1)。
2.2 进展组与非进展组影像学资料对比分析 PMD组患者后部梗死比例高达93.8%,显著高于对照组(74.7%),差异具有统计学意义;梗死灶的最大直径PMD组大于对照组(P=0.022),同时PMD组病灶累及层数明显多于非PMD组(P=0.002);对于梗死的体积,两组间更具有显著的差异,PMD组体积中位数为166.94,而非PMD组体积中位数为65.36,差异具有统计学意义(P<0.001)。两组中均有超过半数的患者存在动脉粥样硬化病变,但PMD组患者比例更高(PMD组79.2%,非PMD组64.1%,P=0.02);本次纳入研究的患者有38例经头部MRA证实存在动脉狭窄,其中PMD组有8例存在椎-基底动脉狭窄,明显高于对照组(P<0.001),其他动脉狭窄两组间比较,无显著差异;根据Fazekas分级结果所示,两组患者轻度白质病变发生率无明显差异,但非PMD组重度脑白质病变的发生率更高,差异有显著性(P=0.03)(见表2)。
2.3 多因素回归分析 以PMD阳性作为因变量进行多因素的逐步Logistic回归分析,将可能的影响因素作为自变量纳入模型,结果显示,既往脑梗死/TIA病史、发病到入院的时间短、后部梗死、梗死体积大、有动脉粥样硬化以及有椎-基底动脉狭窄是PMD发生的独立危险因素(P<0.05)(见表3)。
注:NIHSS:美国国立卫生研究院卒中量表;*P<0.05
注:*P<0.05
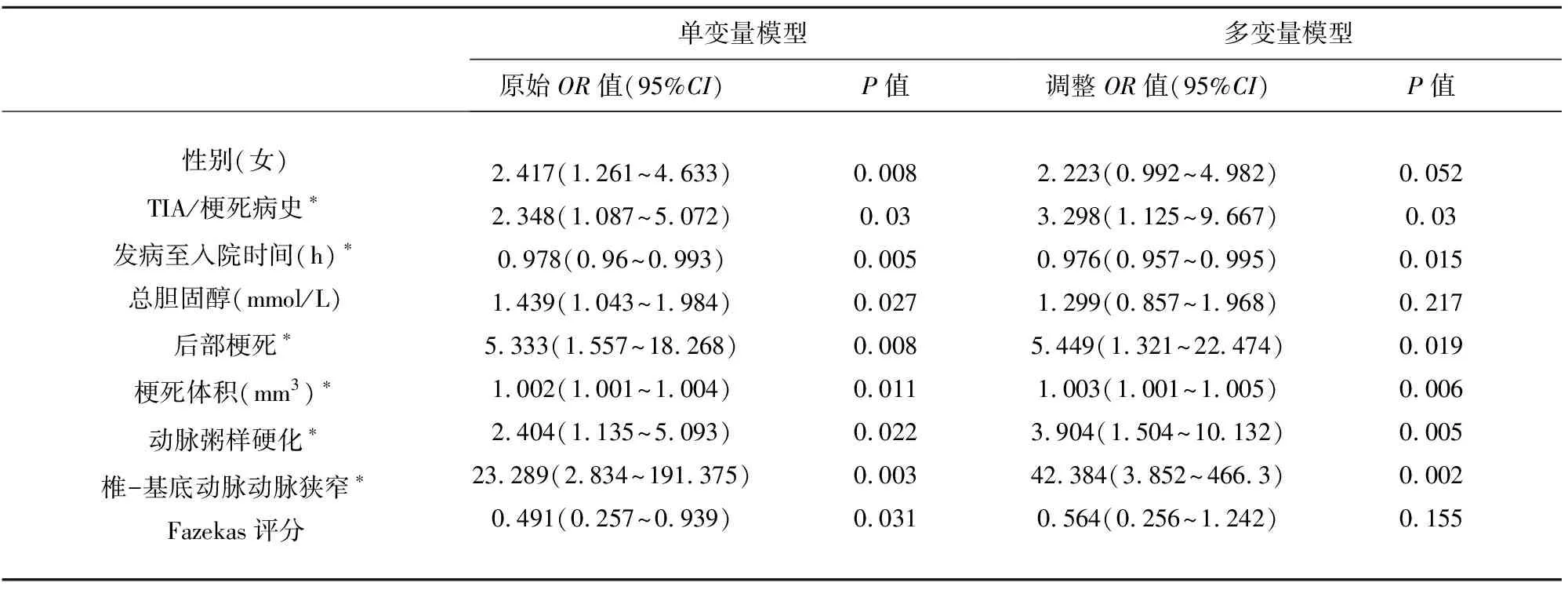
表3 进展组危险因素单因素与多因素对比分析
注:CI:置信区间;*P<0.05
3 讨 论
大脑中动脉深穿支脑梗死是一组临床上常见的卒中类型,其主要累及的范围包括壳核、苍白球外侧部、尾状核头部、内囊前肢、内囊上部和侧脑室旁的放射冠区[15]。该类型梗死发病时往往临床症状轻微,临床上不易引起重视,但一些患者在发病3~5 d内病情逐渐进展达到高峰,造成严重的神经功能损害,其中进展性运动功能缺损(PMD)最为常见。我们的研究中,28.6%的大脑中动脉深穿支梗死患者表现为进展性运动功能缺损。这一比例与之前的研究基本一致。
本研究发现,位于后部的梗死和梗死的体积与PMD的发生密切相关,是影响PMD发生的独立危险因素。这与既往研究探讨进展性脑梗死与MRI影像学特征关系的结论一致。研究指出,肢体的运动功能主要受皮质脊髓束(CST)支配,皮质脊髓束大部分起源于大脑中央前回和中央旁小叶前部的椎体细胞,下行至脑干和脊髓的交界处交叉到对侧,形成椎体交叉,然后在对侧脊髓中继续走行止于脊髓前角细胞,支配运动功能[18],故可推测运动功能缺损的严重程度主要取决于皮质脊髓束的受累程度。Konishi等人利用头部磁共振DTI技术追踪皮质脊髓束走行,发现皮质脊髓束在豆纹动脉供血区域只经过其后上象限,即对应放射冠区的后部[19]。故提示放射冠区后部发生梗死更容易导致运动功能障碍加重。Yamamoto等人的研究结果也提示:大脑中动脉深穿支近端梗死中,梗死部位越靠后,越容易发生PMD。此外,梗死的体积越大,越容易发生PMD。这也与Takase K等人的观点一致。Takase K通过研究发现,豆纹动脉(LSA)供血区梗死灶面积>0.98 cm2是卒中进展的重要独立危险因素[2],并分析梗死灶面积与LSA分支直径大小有关,LSA外侧支直径较内侧支大,故外侧支相应部位的梗死灶体积更大,也更容易发生进展。与此同时,我们猜测可能也与病变范围损伤皮质脊髓束的程度相关。国外研究表明,在脑梗死急性期时,梗死体积增加发生在皮质脊髓束附近较其他部位更容易引起PMD[20]。缺血不耐受是脑梗死发生神经功能恶化的主要机制,小面积梗死灶损伤到颅内运动神经的关键区可能性小或者其缺血半暗带范围较小,发生PMD的概率低,而大面积梗死病灶由于其缺血程度重,范围大,皮质脊髓束及邻近组织受累的可能性较大,进而诱发或加重运动功能缺损,造成PMD。
PMD组动脉粥样硬化的发生率高于非PMD组,并且是PMD发生的独立危险因素。在既往的研究中,深穿支梗死被认为是由脂质玻璃样变性或深部小动脉纤维样素样坏死所致的一种小血管疾病。然而,越来越多的证据表明动脉粥样硬化的形成过程,如微动脉粥样斑块的形成、梗死部位的血流动力学损害等对穿支动脉病有潜在的作用。有研究指出可能在深穿支动脉开口处附着有动脉粥样硬化斑块,引起狭窄或闭塞,并最终导致深穿支梗死[21]。同时有研究表明,发出穿支动脉的母动脉存在动脉粥样硬化可导致体积更大的梗死灶。由此,我们可以推测,穿支动脉的动脉粥样硬化性闭塞的栓子来源可能来自于侵犯穿支动脉口的母动脉粥样硬化斑块的脱落,而并非完全由血流动力学障碍引起的穿支动脉口的原位血栓造成。同时,动脉硬化可导致血管内皮受损,引起血脑屏障功能异常,一氧化氮和内源性纤溶酶原激活剂等保护因子产生减少,引起缺血再灌注损伤也可能加速内皮功能障碍[22];此外,深穿支供血部位缺乏有效的侧支循环,可导致微循环障碍,加重脑组织损伤,导致PMD。
既往脑梗死/TIA病史的患者在发生大脑中动脉深穿支梗死后更容易出现病情的进展,提示多次梗死引起中枢神经组织反复损伤,可造成梗死灶范围逐渐扩大或梗死部位多发,从而造成累积性损伤,导致运动功能缺损[23]。但是,有研究得出相反的结论提示既往脑梗死/TIA病史是神经功能恶化的保护性因素。有国外研究指出,既往脑梗死/TIA病史与本次发病间隔的时间长短是决定因素。如两次缺血间隔时间较短,则下一次发病会加重第一次的损伤,如果间隔时间较长则可激发体内保护机制,即类似于一种缺血预处理,发生脑梗死后,病灶处的脑组织会促进新的基因产物表达,细胞防御能力更加强化,激活内源性保护机制,促进侧支循环建立,从而起到神经保护作用[24]。本实验可针对脑梗死/TIA病史的时间进一步分层,探讨PMD和脑梗死/TIA病史间隔时间的关系。
虽然先前的研究表明颅内ICA或MCA狭窄或闭塞是神经恶化的良好预测指标,但我们并未发现PMD组中ICA和MCA狭窄的发生率很高。既往报道显示,母动脉存在任何程度的狭窄都被认为是深穿支梗死的重要原因,但我们纳入研究存在动脉狭窄的患者少,而且在我们的研究中并没有分析母动脉疾病的轻微程度与PMD发生的关系,因此可能低估了母动脉疾病对PMD的预测价值[25]。有趣的是,本研究发现,存在椎-基底动脉狭窄的患者发生PMD的比例显著增加,是PMD的独立危险因素,这在以往的研究中未见报道。进一步查阅相关文献,既往国外病例报告中指出,表现为颈内动脉系统脑梗死的患者死后,经过尸体颅内的血管解剖发现,椎-基底动脉存在严重的狭窄,在颈内动脉系统和椎-基底动脉系统之间存在一个特殊的血管结构,命名为永存的原始三叉动脉。该动脉的存在使得前循环和后循环的血流连通,后循环长期供血不足而依靠前循环血流通过原始三叉动脉分流代偿,故当患者脑血流出现急性变化时,前循环出现急性供血不足,导致缺血事件的发生[26]。但这种原始三叉动脉发生率低,且该试验中动脉狭窄的患者并未完善脑血管造影术,故该机制不能充分解释试验结果,加之本研究纳入的患者中有动脉狭窄的患者数量很小,存在椎-基底动脉狭窄的患者数量更少,故结果存在很大的偶然性,有待后续进一步研究证实。
本研究显示重度白质病变的患者发生PMD的几率降低,这与国内一些学者得出的结论一致,分析可能与脑慢性缺血的小血管病变启动了体内的保护机制有关。脑白质病变代表脑组织慢性的血流低灌注改变,梗死前,脑组织处于慢性的低灌注状态则可能模拟了缺血预处理机制,促进侧支循环的建立,提高患者抵御下一次脑血管病的能力[27]。但一些国外的研究认为脑白质病变是脑小血管疾病的标志,其病理实质是小动脉结构和功能的改变,如狭窄、伸长、弯曲和自调节功能受损,发生缺血事件后脑组织代偿能力下降,故在任何类型的脑卒中发病过程中,严重的脑白质病变可能都是病情进展的预测因素[28]。此外,严重的白质病变会造成梗死灶周围的微循环紊乱,导致周围的缺血半暗带逐渐扩大而引起病情的恶化。
本研究存在一定的局限性。大部分患者在PMD后未行重复MRI检查,对于进展后的影像学评估尚缺乏有力证据;本研究未采用弥散张量成像(DTI)技术对皮质脊髓束纤维走行进行追踪研究,未来针对这方面深入研究,可能有助于确定锥体束损伤的程度和功能恢复;此外,本试验样本量较小,尤其是颈内动脉和大脑中动脉狭窄患者人数较少,可能降低了大血管病变对于PMD的意义。
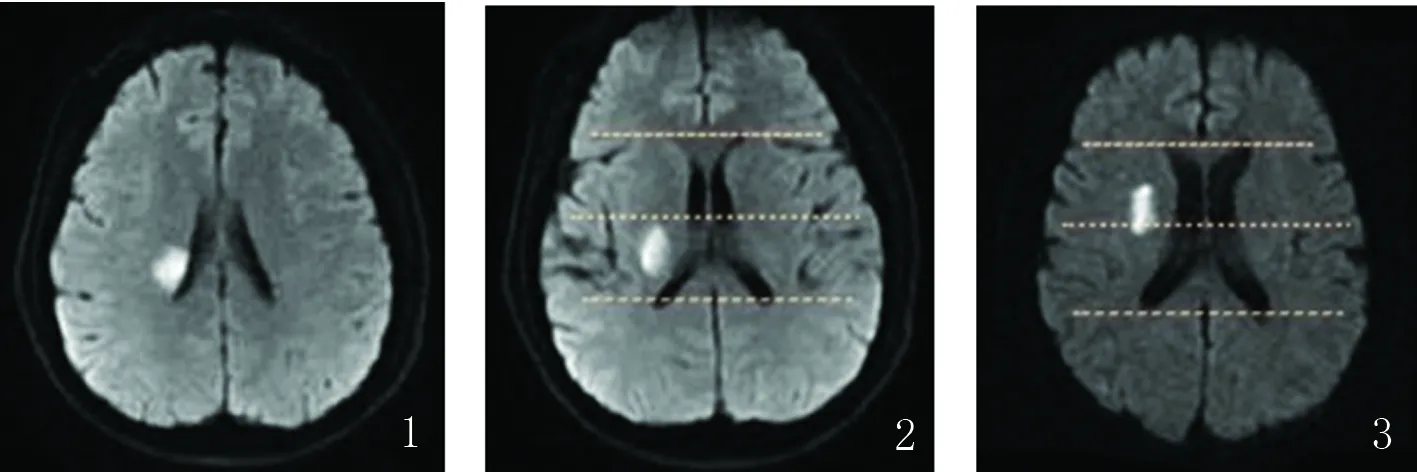
图1、2为后部梗死轴位DWI图像,图1为包括放射冠在内的第一个层面;图2为第二个层面;图3为“非后部”梗死轴位DWI图像

