凋亡抑制蛋白抑制剂LCL161促进人乳腺癌MDA-MB-231细胞凋亡的机制*
陈延松,刘先富,张晓静,高 威,唐经纬,陈 晨,陈玉忠,钱 军,金功圣,郭 伟
(蚌埠医学院第一附属医院,安徽 蚌埠233004)
三阴性乳腺癌是乳腺癌分子分型中预后最差的一种病理类型,目前常用的化疗药物针对这种类型的乳腺癌效果不佳。而新型的靶向药物贝伐单抗以及西妥昔单抗等,治疗结果也取得了一些效果,但仍未得到医疗界的公认。所以针对三阴性乳腺癌有效药物的探索一直备受广大临床医生的关注[1-2]。
凋亡抑制蛋白(Inhibitor of apoptosis proteins,IAPS)的抑制剂LCL161是人工合成的,类似第二个线粒体衍生的半胱氨酸蛋白酶激动剂(Second mitochondria-derived activator of caspases,SMAC)的小分子化合物[3-6]。笔者已经通过体外MTT实验以及体内动物实验,证明该药物能够促进人三阴性乳腺癌MDA-MB-231细胞株细胞的凋亡[7]。目前已有的研究提示该药具有促进凋亡的作用,但是针对乳腺癌MDA-MB-231细胞的促凋亡机制仍未阐明,本研究旨在证实LCL161能够促进人乳腺癌MDA-MB-231细胞的凋亡,并进一步研究其促进凋亡的机制。
1 对象与方法
1.1对象与材料 人乳腺癌MDA-MB-231细胞购于中国科学院上海细胞库。LCL161购自Active Biochemicals(中国香港)公司。线粒体膜电位检测试剂盒(JC-1)购自海门碧云天生物技术研究所;HRP标记的山羊抗小鼠IgG、山羊抗兔IgG购自武汉博士德生物工程有限公司。
1.2方法 线粒体膜电位的检测(JC-1)细胞凋亡,配制MDA-MB-231细胞单细胞悬液,接种于6孔细胞培养板,每孔2×105个细胞,培养24 h后,实验组分别加LCL161试剂0.5μmol/L、1μmol/L、2μmol/L处理。继续培养24 h后按照说明书操作。使用倒置荧光显微镜采集图像。免疫印迹法(western-blot)检测凋亡相关基因的蛋白表达,按照实验计划3孔每组分别加入不同浓度LCL161,达到作用时间点后,收集细胞,每3孔细胞加100μL细胞裂解液,冰上裂解30 min,-20°C保存备用。提取上清进行蛋白定量后,进行SDS-聚丙烯酰胺凝胶电泳,电泳结束将蛋白条带转至PVDF膜,蛋白封闭,分别孵育一抗、二抗,Bio-Rad凝胶成像系统对膜进行曝光获取图像。
2 结果
2.1JC-1单体和多聚体实验结果 通过JC-1实验,可以发现随着LCL161浓度的增加,红色荧光逐渐减弱(图1上行),而绿色荧光逐渐增强(图1下行)。说明随着LCL161浓度的增加,JC-1单体逐渐增多,而JC-1多聚体逐步下降,线粒体电位呈逐步下降趋势,见图1。
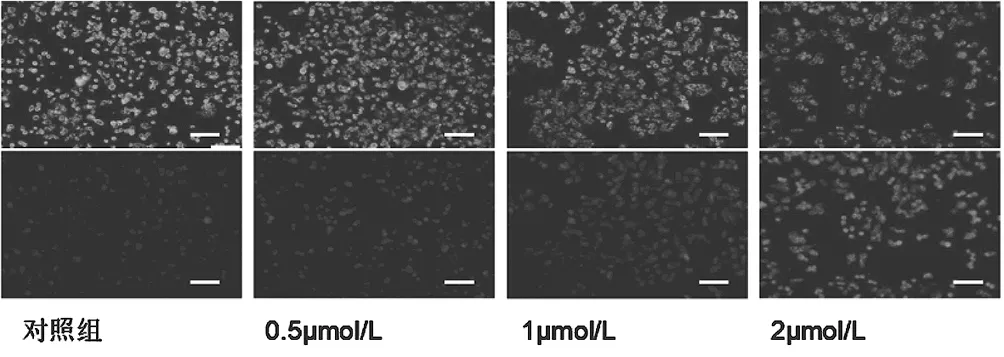
图1 不同浓度LCL161对人乳腺癌细胞株MDA-MB-231细胞线粒体膜电位的影响(×100)
2.2不同浓度和时间段凋亡相关蛋白表达 实验可以观察到,随着LCL161的浓度逐渐增加,Bax蛋白表达呈递增趋势,而Bcl-2,Mcl-1蛋白的表达呈递减趋势,见图2-a。随着药物作用时间的延长,cIAP1蛋白的表达呈逐渐减少的趋势,但是cIAP2、XIAP的蛋白的表达变化不明显,见图2-b。
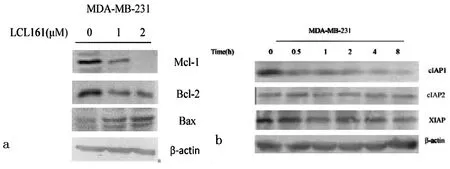
图2 不同浓度LCL161及作用时间凋亡相关蛋白的表达
2-a为(1μmol/L、2μmol/L)人乳腺癌细胞株MDA-MB-231细胞凋亡相关基因(Bax,Bcl-2,Mcl-1)的蛋白表达,2-b为1μmol/L LCL161在不同时间段对人乳腺癌细胞株MDA-MB-231细胞凋亡相关基因(cIAP1、cIAP2、XIAP)的蛋白表达
3 讨论
通过JC-1实验,可以发现随着LCL161浓度的增加,红色荧光逐渐减弱,而绿色荧光逐渐增强,说明随着LCL161浓度的增加,JC-1单体逐渐增多,而JC-1多聚体逐步下降,线粒体电位呈逐步下降趋势。结合前期进行的MTT实验结果,可以得出结论:IAPS的抑制剂LCL161能够促进人乳腺癌细胞株MDA-MB-231细胞的凋亡。
通过western-blot检测凋亡相关基因的蛋白表达情况,发现随着LCL161的浓度逐渐增强,Bax蛋白表达呈递增趋势,而Bcl-2、Mcl-1蛋白的表达呈递减趋势。随着药物作用时间的延长,cIAP1蛋白表达呈逐渐减少趋势,但是cIAP2、XIAP蛋白表达变化不明显。
Bax是促凋亡基因,与Bcl-2同源,而Bcl-2属于抑制细胞凋亡的抗凋亡基因。Bcl-2是一个基因家族,其包含多种基因,主要功能是通过正负调节参与细胞凋亡。这些基因主要分布在线粒体外膜上,参与内源性的凋亡途径。一般情况下,Bax与Bcl-2两者的比例是相对恒定的,当细胞接受到凋亡信号转导,2种蛋白含量发生变化。相关研究发现,当细胞内线粒体存在细胞生长因子,Bcl-2蛋白表达升高,使Bax/Bax同源二聚体解离,形成更加稳定的Bcl-2/Bax异二聚体,抑制细胞凋亡。如果抑制Bcl-2蛋白表达,则Bax蛋白表达相对升高,Bax/Bax同源二聚体增多,促进凋亡[8-10]。LCL161可能抑制Bcl-2蛋白表达,影响Bax 与Bcl-2两者比例,从而起到促进凋亡的作用。
Mcl-1是Bcl-2家族蛋白的主要前体成员,其主要通过其C-末端跨膜结构域定位于线粒体外膜[11]。研究表明MCL-1通过调节凋亡途径,对细胞的增殖,分化和肿瘤发生起着重要作用。通过隔离促凋亡多结构域蛋白BAX和BAK,MCL-1抑制线粒体膜的透化并最终阻止细胞凋亡。MCL-1受BH3-only蛋白家族(例如NOXA,BIM和PUMA)的负调控,其特异性结合由MCL-1的BH结构域形成的BH3结合沟,从BAX和/或BAK中置换MCL-1,从而促进细胞凋亡[12-13]。抗凋亡蛋白MCL-1的表达在各种人肿瘤中经常升高。因此,MCL-1可以是抗肿瘤治疗直接有效的靶点。引起MCL-1耗竭的药物已被广泛研究,并用于抗肿瘤治疗。目前常见的药物为各种CDK(Cyclin Dependent Kinase)抑制剂,如flavopiridol、roscov itine和SNS-032,可降低MCL-1水平并诱导多种细胞类型的细胞凋亡[14-16]。通过western-blot检测,可以发现LCL161能够使MDA-MB-231细胞的MCL-1表达下调,起到促凋亡的作用,其机制可能是通过抑制MCL-1对凋亡多结构域蛋白BAX和BAK的隔离。
IAPs是一种抗凋亡蛋白家族,其包含有多种凋亡抑制蛋白,如cIAP1、cIAP2、XIAP等。LCL161是SMAC类似物,进入线粒体后可与caspase竞争结合IAPs,去除IAPs对下游caspase家族的抑制效应,从而促进细胞凋亡[5,17-18]。人类IAPS包含1到3个杆状病毒IAP重复(baculoviral IAP repeat,BIR)域,其家族成员cIAP1、cIAP2、XIAP,可通过BIR结构域直接与caspases结合,并溶解酶蛋白来发挥抗凋亡作用,并抑制其活性[19-20]。通过western-blot实验,可以发现通过LCL161作用的细胞,其cIAP1蛋白表达呈逐渐减少趋势,而cIAP2、XIAP蛋白表达变化不明显。LCL161促进MDA-MB-231细胞凋亡的机制可能是降低cIAP1蛋白表达,去除IAPs对下游caspase家族的抑制效应,从而促进细胞凋亡。
综上所述,我们可以推测出LCL161对乳腺癌细胞株肿瘤形成的影响可能是由下调cIAP1、Bcl-2、Mcl-1的表达,而促进其凋亡所引起。而关于LCL161下调cIAP1、Bcl-2、Mcl-1表达的机制,目前尚未阐明,是下一步研究的方向。

