人ⅡA型磷脂酶A2 N端15肽及其衍生肽的杀菌活性▲
郭 娟 李永杰 梁宁生
(广西医科大学附属肿瘤医院药学部,南宁市 530021,电子邮箱:1599168279@qq.com)
细菌耐药问题日趋严重,不仅危害人类健康,还给社会带来沉重的经济负担。在欧盟国家,每年因耐药菌感染引起的死亡数超过25 000人,费用总计超过9亿欧元;在美国,每年因耐药菌感染引起的死亡数约有23 000人,医疗费用达260亿美元[1]。开发新型抗菌药物以有效对抗耐药菌是解决耐药菌感染的方法之一。抗菌肽最初是在生物体内发现的一类具有抗菌活性的小分子多肽,后来出现人工合成的抗菌肽,它们具有分子量小、抗菌谱广、抗菌活性高、不易产生耐药性、作用机理独特等优点[2],有望成为新型高效抗菌药物,从而解决耐药菌问题。目前,有几种人工合成的抗菌肽已进入临床试验阶段,用于局部和全身感染的治疗。Pexiganan是一种含有22个氨基酸的magainin-2类似物,是第一种用于糖尿病足溃疡局部治疗的抗菌肽[3]。
人ⅡA型磷脂酶A2(phospholipase A2,PLA2),也称为血小板型PLA2,是哺乳动物重要的抗菌蛋白之一,在宿主防御细菌感染方面发挥重要的作用[4]。本课题组在前期研究中发现ⅡA 型PLA2对革兰阳性菌和革兰阴性菌均有杀菌作用[5],并且根据其C-末端及N-末端分别衍生合成的多肽也都具有杀菌活性[6-7]。本研究根据ⅡA型PLA2的N末端15个氨基酸序列合成多肽,并以此多肽为模板,改变不同位置的氨基酸,最终合成6种衍生肽;比较模板肽ⅡA型PLA2N端15肽(PLA2-N15)及6种衍生肽的杀菌活性,进而分析多肽分子结构与杀菌活性间的关系。
1 材料与方法
1.1 材料
1.1.1 实验细菌标准株:革兰阴性菌大肠埃希菌ATCC 44113以及革兰阳性菌金黄色葡萄球菌ATCC 26003均由广西医科大学微生物学教研室提供,均购自中国食品药品检定研究院。
1.1.2 实验药品与试剂:模板肽PLA2-N15(批号:pep16080425)及其6种衍生肽PLA2-H6R(批号:pep16080426)、PLA2-H6R-T12R(批号:pep16080429)、PLA2-H6R-T12V(批号:pep16040509)、PLA2-N4R-H6R(批号:pep16080428)、PLA2-N4R-H6R-T13R(批号:pep16080430)、PLA2-N1A-H6R-T12L(批号:pep16080427)均由本课题组设计经上海波泰有限公司合成,纯度均为90%;1%小牛血清白蛋白(V/W)(批号:323N057)由北京索莱宝科技有限公司提供;RPMI-1640(批号:0025316)培养基由Biological Industries公司提供;无水氯化钙(批号:10043-52-4)由成都市科隆化工试剂厂提供;4-羟乙基哌嗪乙磺酸(纯度≥99%,批号:513C0412)由北京索莱宝科技有限公司提供;LB营养琼脂(批号:170206)由北京路桥技术有限责任公司提供;LB培养基粉(批号:A507007-0205)由生工生物工程股份有限公司(上海)提供。
1.1.3 实验仪器: (1)DRP-9272型恒温培养箱(上海森信仪器有限公司);(2)AnkeTGL-16C型离心机(上海安亭科技仪器厂);(3)Thermo MAXQ8000型恒温摇床(Thermo Scientific Electron公司);(4)UV756型分光光度计(上海菁华科技仪器有限公司);(5)DK-914型恒温水浴锅(上海森信仪器有限公司)。
1.2 实验方法
1.2.1 多肽的设计与合成:查询NCBI网站的基因库,获取人ⅡA型PLA2蛋白质N末端第1~15个氨基酸序列NLVNFHRMIKLTTGK (N为天冬酰胺,L为亮氨酸,V为缬氨酸,F为苯丙氨酸,H为组氨酸,R为精氨酸,M为甲硫氨酸,I为异亮氨酸,K为赖氨酸,T为苏氨酸,G为甘氨酸)。以上述氨基酸序列为模板合成PLA2-N15及其衍生肽。(1)PLA2-H6R,第6位的H替换为R;(2)PLA2-H6R-T12R,第6位的H替换为R、第12位的T替换为R;(3)PLA2-H6R-T12V,第6位的H替换为R、第12位的T替换为V;(4)PLA2-N4R-H6R,第4位的N替换为R、第6位的H替换为R; (5)PLA2-N4R-H6R-T13R,第4位的N替换为R、第6位的H替换为R、第13位的T替换为R;(6)PLA2-N1A-H6R-T12L,首位的N替换为A、第6位的H替换为R、第12位的T替换为L。见表1。
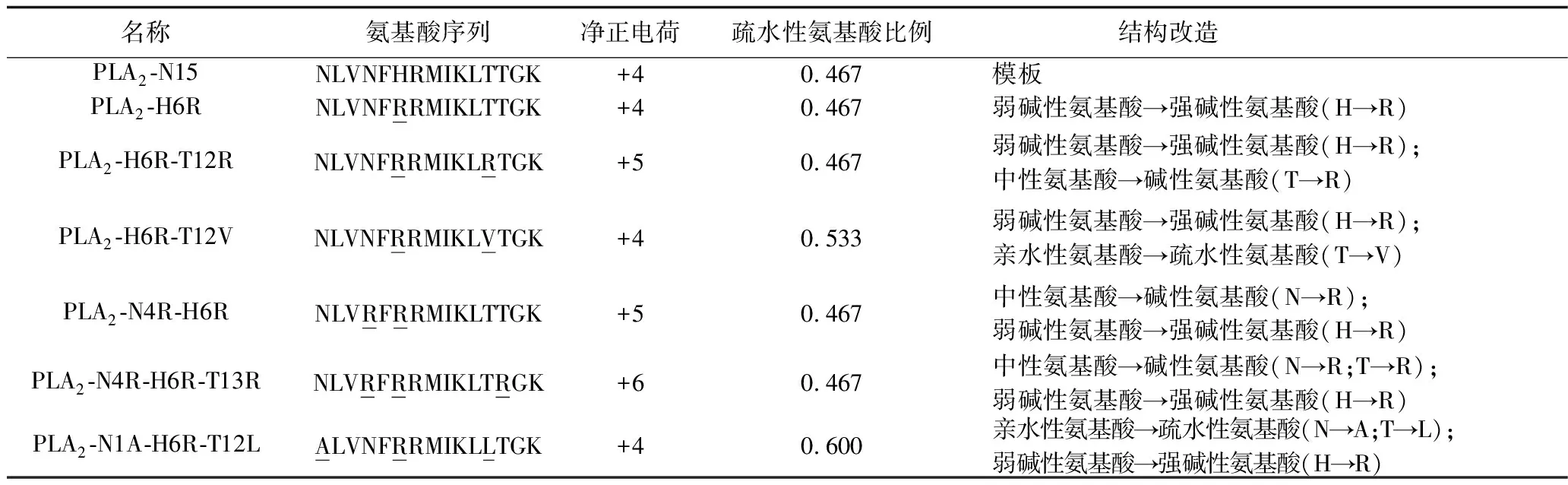
表1 PLA2-N15及其衍生肽的一级结构及结构改变特点
注:下划线标注者代表被替换的氨基酸。
1.2.2 多肽的配制与保存:将PLA2-N15及其6种衍生肽分别溶于400 μl灭菌的双蒸水中,配制成浓度为10 g/L的多肽母液,以20 μl/管分装于EP管中,-20℃冷冻保存,根据实验需要取用,避免反复冻融。
1.2.3 杀菌活性的测定:采用琼脂铺板计数法[8]测定多肽杀菌活性。(1)细菌培养及菌液制备。取过夜培养的细菌,按1 ∶50的比例加入3 ml新鲜的LB培养液中,置于37℃的恒温摇床孵育2.5 h,达对数生长期。室温下1 000 r/min离心45 s后收集细菌,用生理盐水洗涤细菌并再次离心,弃上清液,将所得细菌沉淀物重悬于500 μl生理盐水并混匀,于紫外分光光度计的540 nm波长处测定吸光度值,记录吸光度值达0.1时所需的细菌量(μl),计算细菌的稀释倍数,并将细菌稀释至每毫升1×107菌落形成单位(colony-forming unit,CFU)备用。(2)配制细菌孵育体系。取过滤后的RPMI-1640液900 μl,加入50 μl小牛血清白蛋白(1%)、20 μl 4-羟乙基哌嗪乙磺酸(10 mmol/L)、20 μl氯化钙(1 mmol/L),配制成pH≈7.40的反应体系。(3)实验分组。将每条衍生肽分为对照组和4个实验组(衍生肽终浓度分别为8、40、200、1 000 μg/ml),取80 μl反应体系,各实验组加10 μl菌液和10 μl相应终浓度的衍生肽,对照组加入10 μl菌液和等体积的生理盐水。混匀后置于37℃恒温水浴2 h。(4)计算杀菌率。2 h后从上述各反应体系中取出反应液40 μl,加入360 μl灭菌生理盐水中,连续10倍稀释,共稀释5次,取100 μl稀释液于无菌培养皿(直径约55 mm)中,加入灭菌的LB营养琼脂6 ml摇匀,待琼脂凝固后,放入37℃恒温箱中过夜培养18~24 h。计数琼脂板上的CFU,取CFU为30~300之间的琼脂板进行计数。计算衍生肽作用后的杀菌率(%),杀菌率=(对照组CFU-实验组CFU)/对照组CFU×100%。每组实验重复5次,取平均值。
1.3 统计学分析 采用SPSS 17.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结 果
2.1 不同多肽浓度PLA2-N15及其衍生肽对革兰阳性菌的杀菌率比较 多肽浓度为200 μg/ml和1 000 μg/ml时,6种衍生肽的杀菌率均高于PLA2-N15(均P<0.05);任一浓度下PLA2-H6R-T12V与PLA2-N1A-H6R-T12L的杀菌率均高于PLA2-N15及其他4种衍生肽(均P<0.05);多肽浓度为8 μg/ml、40 μg/ml时,PLA2-H6R-T12V的杀菌率均高于PLA2-N1A-H6R-T12L(均P<0.05)。见表2。
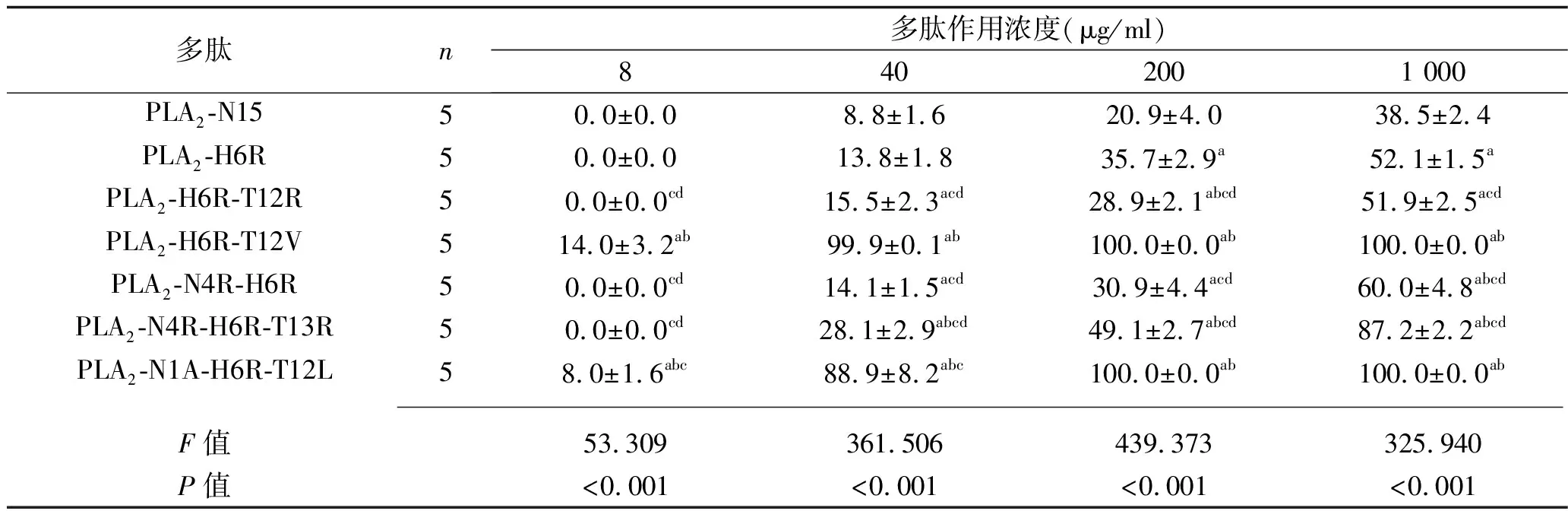
表2 不同多肽浓度PLA2-N15及其衍生肽对革兰阳性菌的杀菌率比较(x±s,%)
注:与PLA2-N15比较,aP<0.05;与PLA2-H6R比较,bP<0.05;与PLA2-H6R-T12V比较,cP<0.05;与PLA2-N1A-H6R-T12L比较,dP<0.05。
2.2 不同多肽浓度PLA2-N15及其衍生肽对革兰阴性菌的杀菌率比较 多肽浓度为200 μg/ml和1 000 μg/ml时,除PLA2-H6R外,其他5种衍生肽的杀菌率均高于PLA2-N15(均P<0.05);多肽浓度为200 μg/ml和1 000 μg/ml时,PLA2-H6R-T12V与PLA2-N1A-H6R-T12L的杀菌率均高于其他4种衍生肽(均P<0.05);多肽浓度为40 μg/ml时,PLA2-H6R-T12V的杀菌率低于PLA2-N1A-H6R-T12L(P<0.05)。见表3。
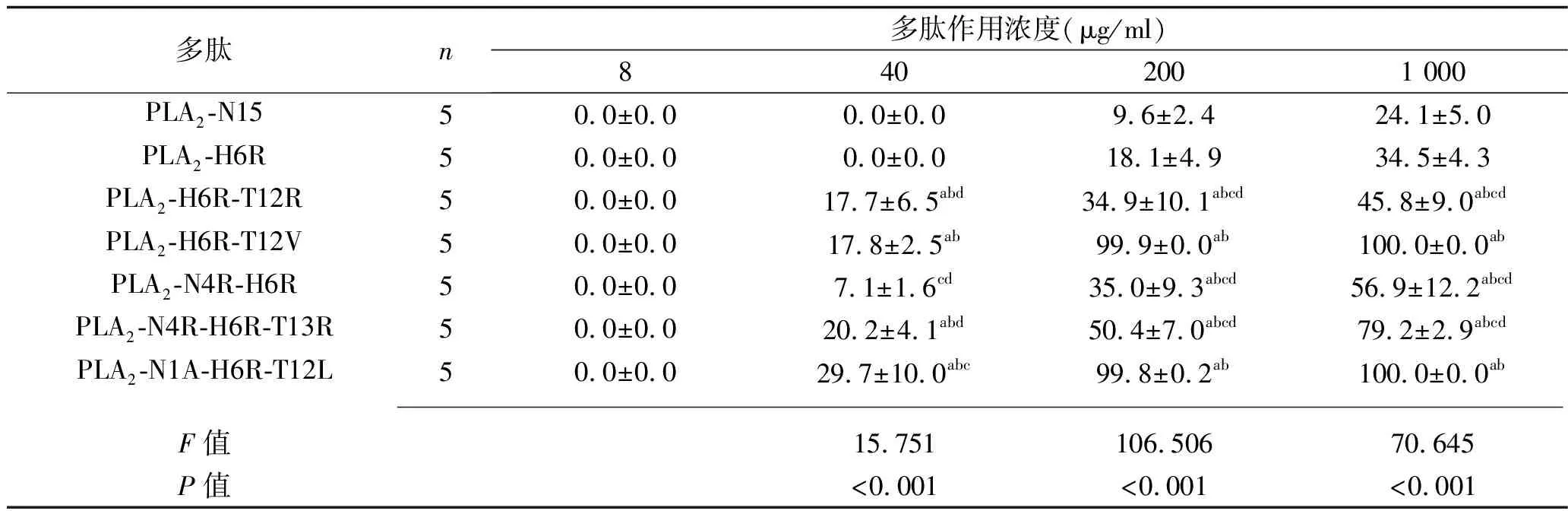
表3 不同多肽浓度PLA2-N15及其衍生肽对革兰阴性菌的杀菌率比较(x±s,%)
注:与PLA2-N15比较,aP<0.05;与PLA2-H6R比较,bP<0.05;与PLA2-H6R-T12V比较,cP<0.05;与PLA2-N1A-H6R-T12L比较,dP<0.05。
3 讨 论
3.1 PLA2-N15及其衍生肽的设计 利用美国NCBI网站的基因库,查询目前能够获取的所有哺乳类生物ⅡA型PLA2的N末端15个氨基酸残基序列,包括人、猩猩、猴、兔、牛、豚鼠、大鼠、小鼠共8种生物,其氨基酸残基序列如图1所示。对8种生物氨基酸序列的构成情况进行对比发现,不同物种第5、8、9、13、14、15位的氨基酸完全一致,其他位置上则存在差别。前期研究表明,多肽分子的酸碱性和疏水性对其杀菌活性有重要影响[9],但不同的肽分子其杀菌活性又有所不同。故我们在ⅡA型PLA2的N末端15个氨基酸残基序列多肽分子中对不同位置的酸碱性和疏水性氨基酸进行改造,并分析其杀菌活性。考虑到高度保守的氨基酸对分子结构可能起到关键作用,我们在设计衍生肽时不改变其高度保守的氨基酸;同时,不同物种ⅡA型PLA2的N末端氨基酸序列的第2位氨基酸种类虽不同,但性质相同,都是疏水性氨基酸,故也不作改变,最终选择第1、4、6、12、13位氨基酸进行改造。

图1 8种哺乳类生物ⅡA型PLA2N末端15个氨基酸残基构成情况
注:上排数字(1~15)代表多肽一级结构的氨基酸顺序;下排数字代表氨基酸取代次数(与人ⅡA型PLA2N末端15个氨基酸残基相同位置比较)。
3.2 PLA2-N15及其衍生肽的分子结构与杀菌活性的关系
3.2.1 多肽的杀菌作用与疏水性氨基酸的关系:任一浓度下,PLA2-H6R-T12V和PLA2-N1A-H6R-T12L对革兰阳性菌的杀菌率高于其他多肽,在200 μg/ml和1 000 μg/ml下对革兰阴性菌的杀菌率高于其他多肽(P<0.05)。提示7种多肽中杀菌作用最强的是多肽PLA2-H6R-T12V和PLA2-N1A-H6R-T12L。分析其结构发现,与PLA2-N15相比,多肽PLA2-H6R-T12V和PLA2-N1A-H6R-T12L都增加了疏水性氨基酸,疏水性氨基酸比例由0.467分别上升至0.533和0.600,提示适度增加疏水性氨基酸比例可明显增强杀菌活性。Yin等[10]的研究结果也显示,增加抗菌肽疏水性在一定程度上可改善杀菌活性[11]。同时,当多肽浓度小于200 μg/ml时,PLA2-N1A-H6R-T12L对革兰阳性菌的杀菌活性低于PLA2-H6R-T12V(P<0.05),可能与其将首位亲水性氨基酸N替换为疏水性氨基酸A有关,提示首位为亲水性氨基酸对于提高ⅡA型PLA2N端肽对革兰阳性菌的杀菌活性更为重要,这点不同于Ⅰ型PLA2[11]。对革兰阳性菌和革兰阴性菌的杀菌活性,多肽PLA2-N1A-H6R-T12L均明显强于PLA2-H6R-T12R,分析结构发现,前者同时增加碱性氨基酸和疏水性氨基酸比例,而后者仅增加碱性氨基酸,提示适当增加疏水性氨基酸比例能更有效地提高多肽的抗菌活性。与PLA2-N15相比,衍生肽PLA2-H6R-T12V和PLA2-N1A-H6R-T12L对革兰阳性菌和革兰阴性菌的杀菌活性均增强,这可能与它们的疏水性结构更易于与细菌表面结合有关。进一步分析其结构特点,将为今后抗菌肽新药的开发与应用提供新依据。
3.2.2 多肽杀菌作用与碱性氨基酸的关系:多数学者认为,抗菌肽是通过损伤细菌细胞膜来发挥杀菌作用的[12]。而抗菌肽发挥杀菌作用的重要结构基础是碱性氨基酸,可使抗菌肽分子带正电荷,并与带负电荷的细菌膜表面相结合,进而导致细菌裂解死亡而起到灭菌作用[13]。Malmsten等[14]研究发现,在一定范围内,增加抗菌肽分子正电荷数,其抗菌活性也随之增强。本研究结果显示,PLA2-N15及其6种衍生肽在一定浓度下对革兰阳性菌和革兰阴性菌均有杀菌作用,且多肽浓度为200 μg/ml和1 000 μg/ml时,6种衍生肽的杀菌作用均强于PLA2-N15。其中,与PLA2-N15相比,多肽PLA2-H6R将弱碱性氨基酸(H)替换为强碱性氨基酸(R),净正电荷未增加,其杀菌活性弱于PLA2-H6R-T12V和PLA2-N1A-H6R-T12L;多肽PLA2-N4R-H6R、PLA2-H6R-T12R和PLA2-N4R-H6R-T13R除了将弱碱性氨基酸(H)替换为强碱性氨基酸(R),还将中性氨基酸(N或T)替换为碱性氨基酸(R),净正电荷数由+4分别增加至+5、+5和+6,多肽浓度为200 μg/ml和1 000 μg/ml时,其对革兰阴性菌的杀菌活性较PLA2-N15、PLA2-H6R均增强,同时,PLA2-H4R-H6R(1 000 g/ml时)、PLA2-H6R-T12R(200 g/ml时)和PLA2-N4R-H6R-T13R(除8 g/ml外)对革兰阳性菌的杀菌活性均强于PLA2-H6R,且三种衍生肽对革兰阳性菌的杀菌作用均强于PLA2-N15(除8 g/ml外),提示增加净正电荷有助于增强其杀菌活性,这与我们前期的研究结果类似[15],但其杀菌效果仍弱于PLA2-H6R-T12V和PLA2-N1A-H6R-T12L,可能与后两种多肽结构中均包含有4个碱性氨基酸以及净正电荷数只增加到+4有关。这是因为模板15肽含有4个正电荷,已经属于碱性较强的分子,进一步增加净正电荷数,使抗菌肽与细菌膜结合牢固,反而影响其穿膜效率,最终导致抗菌肽杀菌活性降低[16]。
综上所述,人ⅡA型PLA2N端衍生肽的杀菌活性与其疏水性氨基酸比例及位置、氨基酸的酸碱性密切相关,适当的位置增加疏水性氨基酸或碱性氨基酸,在一定程度上可增强衍生肽的杀菌活性,且将衍生肽第12位氨基酸替换为疏水性氨基酸时杀菌活性最强,这或可为今后开发新的抗菌药物提供新思路。

