糜子PmASR2基因克隆与表达分析
沈力鸿,刘思辰,王海岗,陈 凌,王君杰,曹晓宁,乔治军
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院农作物品种资源研究所,农业部黄土高原作物基因资源与种质创制重点实验室,杂粮种质资源发掘与遗传改良山西省重点实验室,山西太原030031)
作物在自然生长过程中,会受到自然环境中各种生物胁迫和非生物胁迫(干旱、高温、低温、盐渍等)的影响[1]。随着全球气候的极端变化及土地沙漠化和盐渍化,作物生长环境被破坏,非生物胁迫已成为限制农业发展的主要因素[2]。据统计,干旱造成的农业损失超过其他非生物逆境造成的损失总和[3]。因此,提高作物的抗旱性对提高经济效益有决定性的作用。糜子(Panicum miliaceum L.)属禾本科黍属,又称黍、稷、糜,是干旱和半干旱主要作物[4]。糜子生育期短,具有耐旱、耐瘠薄、干旱后复水能力强等特性,在遭受严重干旱后遇水能够快速恢复生长[5]。同时糜子作为C4作物,在C3作物停止干物质积累的水分胁迫条件下,仍能积累干物质[6],是研究作物耐旱性改良的优异材料[7]。目前,对抗干旱胁迫的研究主要集中在改良栽培方法上[8]、植物抗旱生理方面[9]以及分子方面[10]。如今,从抗旱作物中筛选出抗旱基因是一项研究热点。
ASR全名ABA-stress-ripening,即ABA胁迫成熟响应蛋白,1993年首次在番茄中发现能被逆境胁迫诱导[11]。目前,ASR基因在谷子中已经发现7个[12],水稻中 6 个[13],玉米中 9 个[14]。RICARDI等[15]研究发现,在番茄中lsASR1过表达降低了烟草干旱胁迫期间水分损失率;TaASR1的过表达增加了烟草干旱胁迫的存活率[16]。在百合和香蕉中研究发现,ASR基因能赋予拟南芥耐旱性[17-18];ZmASR1能够提高作物的抗旱性,从而提高产量[19]。在盐生植物亚洲落叶松中,ASR1能提高转基因拟南芥对盐胁迫的耐性[20];OsASR1的过量表达通过增加水稻中光合作用提高了耐冷性[21];大豆ASR基因表达可以增强酵母和烟草细胞抗Cu2+的能力[22]。ASR基因已在多个物种被报道能提高作物抵御非生物胁迫的耐受性,但是在抗逆作物糜子中还未见报道。
本试验通过克隆糜子PmASR2基因及表达分析,旨在了解该基因赋予植物对非生物胁迫耐受性的生理和分子机制。
1 材料和方法
1.1 试验材料
供试材料为河曲红糜子,由山西省农业科学院品种资源研究所提供;所用的克隆载体为pGMSimple-TFast Vector(天根生化北京科技有限公司);所用的菌种DH5α购自天根生化北京科技有限公司。
1.2 试验方法
1.2.1 幼苗处理 糜子种子用75%的乙醇处理2 min,再用0.1%升汞浸泡5 min后,用无菌水冲洗5次以上,将处理好的种子放入含有充足水分的培养皿中,暗培养下使其发芽;发芽后将长势较好的幼芽放入花盆土培养,在10 000 lx光照16 h黑暗8 h条件下培养10 d后,进行胁迫处理。
1.2.1.1 干旱胁迫处理 将糜子幼苗放入10%的PEG6000 中处理,并以水处理为对照,在 0,1,3,6,9,12,24 h剪取糜子幼苗的根、茎、叶后迅速用液氮冷冻,并放入-80℃冰箱保存。
1.2.1.2 盐胁迫处理 将糜子幼苗放入250 mmol/L NaCl中处理,并以水处理为对照,在 0,1,3,6,9,12,24 h剪取糜子幼苗的根、茎、叶后迅速用液氮冷冻,并放入-80℃冰箱保存。
1.2.1.3 甘露醇糖处理 将糜子幼苗放入200mmol/L甘露醇中处理,并以水处理为对照,在 0,1,3,6,9,12,24 h剪取糜子幼苗的根、茎、叶后迅速用液氮冷冻,并放入-80℃冰箱保存,待后续试验。
1.2.1.4 激素处理 将糜子幼苗同时放入6种植物激素中进行处理(100 μmol/L的脱落酸(ABA),100 μmol/L的茉莉酸甲酯(MeJa),2 mmol/L的水杨酸(SA),50 μmol/L的生长素(IAA),10 mmol/L的过氧化氢(H2O2),10 mg/L的赤霉素(GA)),并以水处理为对照,在 0,1,3,6,9,12,24 h 剪取糜子幼苗的根、茎、叶后迅速用液氮冷冻,并放入-80℃冰箱保存。
1.2.2 植物总RNA提取 植物总RNA提取采用RNA提取试剂盒DP432(天根生化北京科技有限公司),提取后将RNA反转录为cDNA,采用FastKing一步法除去基因组cDNA;第1链合成预混试剂(KR118)购自天根生化北京科技有限公司,具体操作依照说明书进行。
1.2.3 基因克隆 从NCBI中查找出水稻、谷子、玉米、柳枝稷等作物ASR2家族基因,取其中遗传较为稳定的ASR2基因序列来克隆,然后选取与糜子同源关系最相近的柳枝稷ASR2基因EST序列为模板在NCBI里面的primer-blast设计引物,设计完成后用软件Primer 5.0检查该引物的特异性。扩增PmASR2基因共设计了2对引物,分别为1~432 bp长度的正向引物5-′GGCGAGGTCAACTACGAGA A′-3,反向引物 5-′CAGACAGCACCACACGGTTA′-3;117~541 bp长度的正向引物 5-′CTCCCCTGAC AAGTTCGCA′-3,反向引物 5-′TAGCGCACACGAG TTGAAAG′-3,扩增体系为 50 μL,以不同时间各个处理的糜子叶片cDNA等量混合样为模板,模板体积 5 μL(100 ng/μL)cDNA 质量浓度 100 ng/μL,正反引物各 4 μL(10 mmol/L),2×GC-Rich PCR Master Mix 25 μL(KT206购自天根生化北京科技有限公司),加入ddH2O补足50 μL。PCR反应程序为94℃5 min;接着 94 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,共34个循环;然后72℃延伸10 min。PCR结束后取3 μL 产物与 1 μL 6×DNA Loading Buffer混合,在含有1%的琼脂糖凝胶电泳进行扩增产物检测。检测大小片段准确后,回收并纯化目的条带,连接到克隆载体pGM-Simple-TFast Vector,热激转化感受态细胞DH5α,通过蓝白斑筛选,挑取白色菌落,经菌液PCR验证为阳性克隆子,后送上海美吉生工测序,测序结果经过拼接后在NCBI数据库中进行Blast N比对。
1.2.4 生物信息学分析 将所得的序列,利用DNAMAN软件进行拼接,利用NCBI数据库CD-search在线分析软件进行保守域预测。利用WoLF PSORT在线软件进行亚细胞定位分析,利用NCBI中BlastP进行蛋白质结构保守域分析,采用ExPASy(https://web.expasy.org/compute_pi/)软 件 计算该蛋白分子量及等电点,多重比较及系统进化树利用MEGA7.0软件进行分析。
1.2.5 基因表达分析 将所得糜子ASR2的EST序列设计引物,正向引物为5-′TTGCCTGAACCCTG AAGCAT′-3,反向引物为 5-′AACACCGGACCGAA TTCCTG′-3,各 4 μL(10 mmol/L),根据蒋晓梅等[23]报道的柳枝稷RT-PCR内参基因,筛选出在干旱、盐、糖胁迫稳定度较高的ACT2作为糜子内参,引物序列为正向引物5-′GCGAGCTTCCCTGTAGGTA G′-3,反向引物 5-′CGAACCCAGCCTTCACCATAC′-3,RT-PCR反应体系为20 μL,经调整合适的cDNA体积,不超过2μL,正向引物和反向引物均为0.6μL,2×SuperReal Color PreMix 10 μL,RNase-free ddH2O补足至20μL。反应程序为95℃预变性15min;95℃10 s,60℃30 s退火加延伸,40个循环。
2 结果与分析
2.1 糜子ASR2基因的克隆
以糜子的第1链cDNA为模板,同时设计了2对引物,并用其上下游引物进行PCR扩增,将PCR产物在1%琼脂糖凝胶电泳进行检测,结果显示,1,2号引物分别扩增得到432,424 bp长度片段(图 1)。
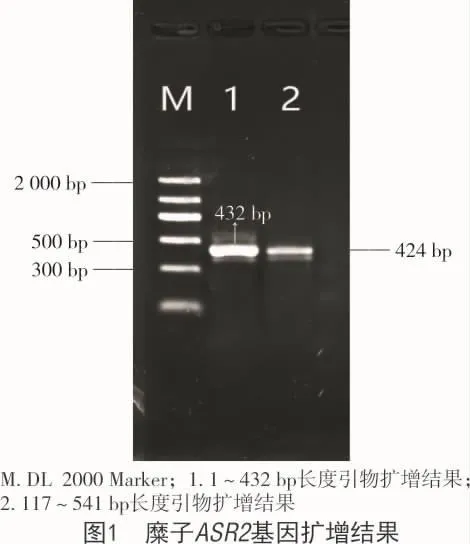
将目的片段进行纯化回收、连接转化、测序获得序列,所得的序列在DNAMAN软件进行拼接获得全长541 bp;将所得的序列在NCBI中rpsblast分析得出,这是一种由缺水胁迫引起的植物ABA/WDS诱导蛋白质(ASR),该序列包含完整的编码区域,命名为 PmASR2(Genebank 登录号:MH937580),该基因cDNA片段保守域长336 bp,共编码112个蛋白质(图2),且经过DNAMAN软件亲水性和疏水性预测,该蛋白为亲水蛋白(图3)。

2.2 生物信息学分析
利用WoLF PSORT在线软件进行基因亚细胞定位预测,结果显示,PmASR2基因定位在细胞核内;用在线网站ExPASy(https://web.expasy.org/compute_pi/)预测PmASR2所编码的氨基酸序列蛋白质分子量为13 454.92 ku,等电点为11.39,分子式为C581H912N198O172S1,其中,富含谷氨酸和组氨酸等氨基酸。将糜子ASR2氨基酸序列与其他已被发现的含有ASR基因的8种作物(柳枝稷PUZ47142.1、马铃薯 XP_006359804.1、番茄 XP_004237807.1、谷子XP_004952697.1、玉米 XP_008645776.1、高粱 XP_002447825.1、水稻BAD28235.1、短花药野生稻XP_006647355.1)进行多重比较(图4),可以发现,这几个作物的ASR氨基酸序列相似度较高,其中,糜子ASR2基因氨基酸序列与高粱XP_002447825.1最相近,与番茄XP_004237807.1差异最大。

使用NCBI-blast网站上9种植物的cDNA序列,并用MEGA 7.0构建系统发育树,结果显示,其cDNA序列相似度较高,在51.2%~86.4%(图5)。其中,糜子与柳枝稷一致性最高,为86.4%;与番茄一致性最低,为51.2%;与谷子和高粱一致性分别为85.5%和84.0%,而番茄和马铃薯ASR基因一致性为76.4%。

2.3 糜子ASR2的表达分析
2.3.1 在干旱、盐、糖胁迫下PmASR2基因荧光定量分析 由图6-A可知,糜子幼苗在PEG胁迫下PmASR2基因相对表达量在变化情况为根中>叶片>茎,茎中几乎没有变化。PmASR2基因在根和叶片中相对表达量在6 h达到峰值,根中是对照11.6倍,叶片中是对照的3.7倍。糜子幼苗在NaCl胁迫下PmASR2基因相对表达量在变化情况为根中>叶片>茎(图6-B),在茎中几乎没有变化,PmASR2基因根和叶片相对表达量在6 h达到峰值,根中是对照16.7倍,叶片中是对照3.6倍。糜子幼苗在甘露醇胁迫下PmASR2基因相对表达量在变化情况为根中>叶片>茎(图6-C),茎中ASR基因相对表达量几乎没有变化,PmASR2基因根中相对表达量(0~3 h)逐渐上升在(3~24 h)逐渐下降,且在3 h达到峰值是对照7.2倍,叶中相对表达量(0~6 h)逐渐上升在(6~24 h)逐渐下降,且在 6 h达到峰值是对照的5.1倍。这些结果表明PmASR2在非生物胁迫干旱、盐、糖环境下可能发挥着重要的作用,其中在干旱和盐环境中较为明显。

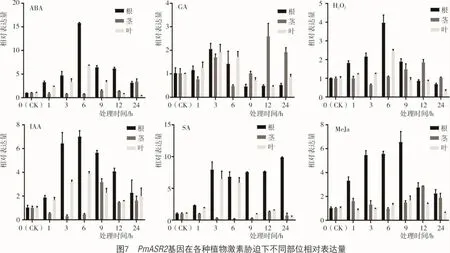
2.3.2 在植物激素胁迫下PmASR2基因荧光定量分析 从图7可以看出,糜子幼苗在ABA激素胁迫下PmASR2基因相对表达量在变化情况为根>叶片>茎,茎中ASR基因相对表达量几乎没有变化,PmASR2基因根中和叶片相对表达量均在6 h达到峰值,根中是对照的16.4倍,叶片中是对照的6.8倍;糜子幼苗在GA激素胁迫下PmASR2基因相对表达量均无明显变化;糜子幼苗在H2O2激素胁迫下,PmASR2基因相对表达量的变化情况为根>叶片>茎,茎中PmASR2基因相对表达量几乎没有变化,根和叶中PmASR2基因相对表达量均在6 h达到峰值,根是对照的3.9倍,叶片是对照的2.5倍;糜子幼苗在IAA激素胁迫下,PmASR2基因相对表达量的变化情况为根>叶片>茎,茎中的PmASR2基因相对表达量几乎没有变化,根中和叶片中PmASR2基因相对表达量均在6 h达到峰值,根是对照的7.0倍,叶片是对照的3.8倍。
糜子幼苗在SA激素胁迫下PmASR2基因相对表达量的变化情况为根>叶片>茎,茎中PmASR2基因相对表达量几乎没有变化,根中PmASR2基因相对表达量在3 h保持较高水平,直至24 h达到峰值,是对照的9.8倍;叶中PmASR2基因相对表达量在3 h达到峰值,是对照的6.5倍。糜子幼苗在MeJa激素胁迫下PmASR2基因相对表达量的变化情况为根>茎>叶,叶和茎中PmASR2基因相对表达量几乎没有变化,根中PmASR2基因相对表达量0~9 h逐渐上升,在9~24 h逐渐下降,且在9 h达到峰值,是对照的6.6倍。表明PmASR2基因受许多激素诱导,其中,受ABA,IAA,SA激素诱导较为明显。
3 讨论
ASR蛋白是植物中广泛存在的一类主要参与植物胁迫应答的蛋白,当植物遭受逆境(干旱[24]、盐[25-26]、糖[27]及一些植物激素)胁迫时,ASR基因会被诱导,从而减轻逆境对植物细胞引起的伤害。
本研究通过查找糜子近源物种柳枝稷ASR基因cDNA,进行基因克隆及生物信息学分析,我们克隆鉴定了PmASR2基因,其全长541 bp,保守域长336bp,共编码112个氨基酸,该基因包含ABA/WDS保守结构域,对其亲疏水性分析发现,PmASR2为亲水基因,原因可能是由于其蛋白组成富含谷氨酸和组氨酸等亲水性氨基酸,这与张会等[28]在厚藤ASR基因里发现的氨基酸组成相似,猜测糜子ASR基因可能与厚藤ASR基因一样可以响应ABA和非生物胁迫的诱导。通过进化树分析发现,糜子PmASR2基因在禾本科作物遗传过程中还非常保守,这与许灿等[29]在枇杷中的研究结果相似,说明当糜子受到干旱胁迫时能促进该蛋白合成,从而降低干旱对植物的损害。同时,本研究对糜子PmASR2基因在PEG,NaCl和甘露醇胁迫下的转录水平进行了分析,结果表明,该基因在茎和叶中表达量较高,而在根中表达量较低,这与桑树中ASR基因在叶、花、茎中表达量大于根中的研究结果一致[30],随着时间的延长在 PEG,NaCl,甘露醇处理PmASR2基因的表达均呈现先升高后降低的趋势。并且根中该基因相对表达量峰值始终高于叶片中,说明该基因在感受到逆境胁迫时优先在根中表达。FENG等[31]研究发现,谷子ASR家族在PEG,NaCl,甘露醇胁迫时基因相对表达量在根和叶中有明显的增加,在茎中却开始减少,SiASR3,SiASR4和SiASR6在根中优先表达,说明PmASR2蛋白具有组织特异性和功能特异性。
通过6种植物激素处理发现,随着时间增加,ABA,IAA,MeJa,H2O2处理中糜子 PmASR2 基因呈现先升高后降低的趋势,其中,ABA,IAA,H2O2胁迫6 h达到达峰值,而SA处理3 h就达到较高的转入水平,并一直保持到24 h,说明该基因受许多植物激素诱导。其中,SA,IAA,H2O2,MeJa能够轻微地诱导PmASR基因上调表达,ABA处理下相对表达量变化最为明显,杨晓月等[32]在二穗短柄草中也观察到相似的研究结果,说明渗透胁迫诱导PmASR2基因上调涉及到ABA信号,参与了糜子自身抗逆保护。
本研究通过对糜子PmASR2基因克隆及生物信息学分析、荧光定量表达分析,旨在为进一步研究PmASR2基因生物学功能、明确糜子PmASR2基因对逆境胁迫的调控机制等奠定基础。

