杂化轨道和大π键在高中化学教学和考试中的应用初探
重庆 王 明 胡家强
普通高中化学教科书选修3和选修5中都有关于有机物结构和性质的内容,在选修3中以甲烷、乙烯、乙炔为例分析σ键和π键,并以甲烷为例引入杂化轨道理论。在选修5中以科学视野的方式呈现杂化轨道理论分析理解甲烷、乙烯、乙炔分子的空间结构,并通过分析苯的空间结构引入了大π键。从高考命题方向的发展和演变来看,高中化学教学应重视学科内部融合,因此物质结构的相关理论与元素及化合物、有机物的结构及性质的融合考查是高考命题的重要方向之一,近年高考已初见端倪。笔者从高考试题中涉及较多的杂化轨道和大π键入手,初步阐述杂化轨道和大π键的知识建构及其在解题中的应用,为深入探讨开一扇窗,以期抛砖引玉。
一、基本知识构建
1.杂化轨道基本理论
价层电子对数=σ键电子对数+中心原子的孤电子对数。
σ键电子对数=与中心原子连接的原子数目。

通式:AYZ,A为中心原子,Z表示价层电子对数。
(1)凡符合VSEPR模型的AY4的分子或离子的中心原子A都采用sp3杂化。
凡符合VSEPR模型的AY3的分子或离子的中心原子A都采用sp2杂化。
凡符合VSEPR模型的AY2的分子或离子的中心原子A都采用sp杂化。
(2)VSEPR模型与中心原子的杂化轨道类型关系如表1所示:

表1
(3)C、N原子杂化类型的判断技巧
C或N杂化轨道类型的判断是高考的常见考点,在此类化合物中中心原子不止一个,按正常的价层电子对互斥理论(VSEPR理论)计算中心原子的价层电子对数比较繁琐,此时灵活运用必修2中的结构式相关知识能起到奇效。C、N的成键特点相似,可以把N上的一对孤电子对看成一对共用电子对。现简单归纳如表2所示(链状结构):
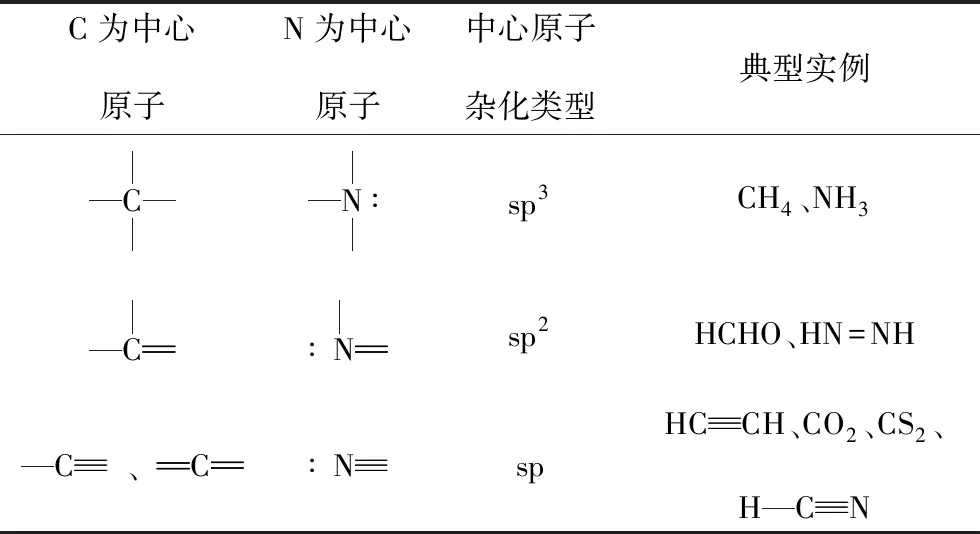
表2
另外,C族、N族、O族、卤素原子与其他原子全部成单键时,中心原子均为sp3杂化。
2.大π键理论
分子中数个相邻原子上都有平行的p轨道(每个p轨道可以容纳2个电子、1个电子或为无电子的空轨道),这时即会产生多轨道多电子的大π键。高中常见物质中有如下几类可考虑大π键对性质的影响。

(2)双键或苯环直接与O、N、X(卤素)等有孤对电子的原子连接。
(3)多个双键处于共轭体系(双键中间隔一个单键的体系)。
二、高中教学中的应用
在高中化学教学中,适时利用教材相关物质为载体,使杂化轨道和大π键理论不断得以应用、巩固和强化,有利于学生理解某些物质的特殊结构和性质。
3.石墨:层状结构的每一层内部,每个C以sp2杂化轨道形成σ键骨架结构,每个C原子均余下一个未参与杂化的p轨道,所有的p轨道相互重叠,形成范围很广的大π键。
4.C60:每个C原子以sp2杂化轨道形成笼状足球形的结构,每个C原子均剩下一个未参与杂化的p轨道,肩并肩重叠在一起形成球状的大π键。


图1
三、经典试题研究
[例1]有如下几种化合物分子:CH3OH、N2H4、HCOOH、COCl2、N2F2。试回答下列问题。
(1)以上分子中C原子和N原子为sp3杂化的有,C和N原子为sp2杂化的有。
(2)写出N2F2的电子式,并结合烯烃的顺反异构写出N2F2的所有可能结构式。
[解析](1)根据前面分析C、N全成单键连接即为sp3杂化,成一个双键为sp2杂化。故CH3OH、N2H4中的C、N为sp3杂化;HCOOH、COCl2和N2F2(F—N=N—F)中为sp2杂化。


(2)[2016·全国卷Ⅲ·37节选]AsCl3分子的立体构型为,其中As的杂化轨道类型为。
(3)[2017·全国卷Ⅲ·35节选]硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在。

(2)As为氮族元素,全部成单键故为sp3杂化;分子中有一对孤电子对,故真实构型为三角锥形。



[例4](1)[2017·全国卷Ⅱ·35节选]经X射线衍射测得化合物R的晶体结构,其局部结构如图2所示:
①下列选项中从结构角度分析,R中两种阳离子的相同之处为,不同之处为。

图2
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
(2)[2018·全国卷Ⅱ·35节选]气态三氧化硫以单分子形式存在,其分子的立体构型为形,其中共价键的类型有种;固体三氧化硫中存在如图3所示的三聚分子,该分子中S原子的杂化轨道类型为________。

图3



