硝酸的性质在中学化学试题中“隐”与“露”
海南 夏继文 李 莉
硝酸作为中学化学中最常见的三大强酸之一,它具有与盐酸和稀硫酸相似的化学性质,但又因为浓、稀硝酸具有较强的氧化性而使它显示出很多特殊的性质。而中学化学试题中往往将这一特殊性以显或隐的形式体现在试题中,是学生丢分的重灾区。
一、“露”即直接考查硝酸的性质
硝酸作为一种常见的酸,物理性质具有挥发性,化学性质具有酸性、不稳定性和强氧化性。不稳定性体现在见光会分解,强氧化性体现在和金属反应时不生成氢气,也能与不活泼的金属或非金属单质反应,还会与一些具有还原性的物质发生氧化还原反应。
1.挥发性之“露”
【例1】将下列固体物质溶于水,再将其溶液加热、蒸发结晶、灼烧,得到化学组成与原固体物质相同的是
( )
①胆矾 ②氯化铁 ③硫酸铝 ④硝酸铜
A.③ B. ①④
C. ②③④ D.全部
【解析】胆矾溶于水将其溶剂蒸干、灼烧最后得到无水硫酸铜,氯化铁、硝酸铜溶液蒸发时会发生水解反应产生挥发性的盐酸和硝酸,使水解反应完全进行,生成对应的氢氧化物,灼烧后生成对应的氧化物,硫酸铝溶液水解生成的硫酸是不挥发性的酸,最后蒸干得到硫酸铝本身,故答案 A正确。
2.不稳定性之“露”
【例2】将少量浓硝酸置于试管中,采用强光照射或者稍加热,立即观察到溶液上方有红棕色气体(NO2)产生。据此现象可推知浓硝酸具有________(填一种化学性质),写出该化学性质的化学方程式:_______,通过上述实验可知,实验室应如何保存浓硝酸?_______。
【解析】这个实验说明浓硝酸在加热或光照时会发生分解,即硝酸具有不稳定性,分解产生的NO2气体又溶解在浓硝酸中,因此长期放置的浓硝酸显黄色,所以实验室在保存浓硝酸时必须将浓硝酸放置于避光的阴凉处,同时又因为其有较强的氧化性,所以盛硝酸溶液的试剂瓶必须是玻璃塞。
3.氧化性之“露”
【例3】下列离子方程式正确的是
( )




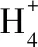
【例4】(2015·海南卷·7)下列叙述正确的是
( )
A.稀盐酸可除去烧瓶内残留的MnO2
B.可用磨口玻璃瓶保存NaOH溶液
C.稀硝酸可除去试管内壁的银镜
D.煮沸自来水可除去其中的Ca(HCO3)2
【解析】除去试管内壁的MnO2只能用热的浓盐酸,故A错;磨口玻璃瓶会与NaOH溶液反应生成Na2SiO3,使瓶口与瓶塞粘在一起,故B错;银与稀硝酸反应生成硝酸银,故C正确;Ca(HCO3)2加热会分解成碳酸钙而沉淀,故D正确。故答案选CD。
二、“隐”即题干中没有出现硝酸这种物质
1.硝酸可以与不活泼金属反应,与活泼金属反应时也不产生氢气之“隐”
【例5】稀硫酸中插一块铜片,铜片没有被腐蚀,再加入下列哪一种物质可使铜片迅速被腐蚀
( )
A.稀盐酸
B.KNO3晶体
C.KCl晶体
D.Na2SO4晶体

【例6】100 mL 6 mol/L的硫酸与足量锌粉反应,一定温度下,为了减慢这个反应的速率又不影响产生氢气的总量,可向反应物中加入适量
( )
A.碳酸钠溶液
B.水
C.硫酸钾溶液
D.硝酸钠溶液

2.浓硝酸与金属铁、铝在常温时发生钝化反应之“隐”
【例7】原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是
( )

A.①②中Mg作负极,③④中Fe作负极





【例8】在酸性溶液中能大量共存的离子组是
( )


C.K+、Na+、I-、Fe3+



( )
A.向硝酸亚铁溶液中滴入适量盐酸,溶液绿色加深
B.蒸干硝酸亚铁溶液并灼烧,可以得到FeO
C.保存硝酸亚铁溶液时应加入少量铁粉
D.配制Fe(NO3)2溶液时,为防止其水解,应加入少量稀硝酸

另外,硝酸作为含氧酸,它还易与有机物中的醇类反应生成对应酯,常见的有乙醇硝酸酯和甘油硝酸酯等。


