靶向四次跨膜L6家族成员1通路抑制三阴性乳腺癌干细胞自我更新的研究
张伟杰,薛 磊,马志俊,李冬荟,王留兴
(郑州大学第一附属医院肿瘤科,河南 郑州450052)
近年来乳腺癌的发病率在世界各国均处于上升趋势,预计2020年美国女性乳腺癌患者将有276 480例,占女性新发恶性肿瘤的30%,居女性恶性肿瘤发病率首位,死亡42 170例(12%),居女性恶性肿瘤死亡率第2位[1]。2019年国家癌症中心最新数据显示我国2015年乳腺癌居女性恶性肿瘤发病率第1位(占比17.10%),死亡率居第5位(占比8.16%)[2]。三阴性乳腺癌例数约占乳腺癌总例数的10%~20%,三阴性乳腺癌多呈浸润性生长,恶性程度偏高,易复发和多器官转移,预后较其他分子分型差,三阴性乳腺癌除了化疗外无有效治疗手段,目前国内外对三阴性乳腺癌的治疗手段无突破性研究进展。肿瘤组织中其实只有很小一部分细胞具有引起肿瘤发生、维持肿瘤生长、保持肿瘤异质性的能力,被称为肿瘤干细胞,其与肿瘤起源、复发与转移、耐药密切相关,乳腺癌亦是如此[3]。
为了寻找乳腺癌干细胞潜在的治疗靶点,前期研究中我们利用流式细胞仪分选出CD44+CD24-/low乳腺癌干细胞,基因芯片和测序分析乳腺癌干细胞和普通乳腺癌细胞两者差异表达的基因,结果发现与普通乳腺癌细胞相比,四次跨膜L6家族成员1(transmembrane 4 L6 family member 1,TM4SF1)在乳腺癌干细胞中显著高表达。本课题组前期研究[4]同时发现TM4SF1在乳腺癌组织中比癌旁组织及正常乳腺组织明显高表达,并且分化程度越低、分期越晚,TM4SF1表达水平越高;其中三阴性乳腺癌组织TM4SF1蛋白阳性表达率最高。这些结果都提示TM4SF1参与了三阴性乳腺癌的发生发展和侵袭转移。
本研究旨在探讨TM4SF1在三阴性乳腺癌干细胞中的作用以及通过靶向TM4SF1抑制其自我更新的可能性,分析该通路作为三阴性乳腺癌干细胞新的治疗靶点的可行性,为下一步研究提供新的理论和思路,对三阴性乳腺癌具有潜在的治疗价值。
1 材料与方法
1.1 实验细胞人三阴性乳腺癌MDA-MB-231细胞系购自中国医学科学院肿瘤医院,保存于我院肿瘤中心实验室。
1.2 主要试剂cDNA反转录试剂盒,日本TaKaRa公司;One Step PrimeScriptTMRT-PCR Kit,日本TaKaRa公司;Taqman®Micro RNA 反转录试剂盒,美国Life Technologies公司;Taq Man®Univsersal PCR Master Mix Ⅱ,美国Life Technologies公司;SYBRPremix Ex Taq Ⅱ,日本TaKaRa公司;BCA法蛋白定量试剂盒,北京普利莱基因科技有限公司;TM4SF1抗体(兔),美国Abcam公司;β-actin抗体(鼠),美国Sigma公司;鼠二抗,北京中杉金桥生物技术有限公司;兔二抗,北京中杉金桥生物技术有限公司;Western blotting试剂盒,北京普利莱北京普利莱基因科技有限公司;CCK-8试剂盒,日本Tongren公司DNA纯化试剂盒,日本TaKaRa公司;质粒提取试剂盒,日本TaKaRa公司;Phusion超保真DNA聚合酶试剂盒,美国NEB公司;3TM4SF1质粒(CH891913),美国Vigene公司。
1.3 主要仪器普通和倒置显微镜,日本Olympus公司;ABI7500 PCR仪,美国Applied Biosystems公司;Light Cycler480 PCR仪,瑞士METTLER TOLEDO公司;DYY-Ⅲ6B稳压稳流电泳仪,北京六一仪器厂;GDS-8000凝胶图像分析系统,美国UVP公司;微型垂直电泳及电转系统,美国BIO-RAD公司;流式细胞仪,美国BD公司。
1.4 主要引物TM4SF1引物:前,5’-CAGCCCTTGGCTTAGCAGA-3’;后: 5’-CCACAATGCTTGGGTTCA-3’。GAPDH引物: 前, 5’-GAGTCAACGG ATTTGGTCGT-3’;后:5’-GACAAGCTTCCCGTTCTCAG-3’。3种siRNA序列:TM4SF1-homo-497 5’-GCGAUGCUUUCUUCUGUAUTT-3’(DsiRNA-1);TM4SF1-homo-733 5’-GGCUCUUGGUGGAAUUGAATT-3’(DsiRNA-2);TM4SF1-homo-813 5’-GCUCUCACCAACAGCAAUATT-3’(DsiRNA-3)。
1.5 实验动物20只3周龄、体质量约15 g的SPF级BALB/C雌性裸鼠,购自北京维通利华公司,饲养于中国医学科学院动物研究所,所用实验器具材料均消毒灭菌后使用,进入实验室时需穿无菌服和戴口罩。
1.6 siRNA转染使用Lipofectamine2000在三阴性乳腺癌MDA-MB-231细胞系中转染siRNA。具体步骤:1)由上海吉玛制药技术有限公司设计合成的2.5 nmol双链siRNA1、siRNA2和siRNA3中分别加入125 μL DEPC水,配制20 μmol·L-1的母液,置于4 ℃保存备用;2)转染相关耗材经DEPC水处理去除RNA酶,部分使用无RNA酶相关耗材;3)转染前1 d将消化后的乳腺癌MDA-MB-231细胞接种到六孔板,过夜使细胞融合度达到50%~60%后用于转染实验;4)取5 μL Lipofectamine2000加入250 μL RPMI-1640培养基中充分混匀(a液),同时,将3种siRNA分别加入另外250 μL RPMI-1640培养基中充分混匀,室温静置5 min(b液)。a液和b液温和混匀后,室温静置15~20 min;5)细胞先用磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗2遍,与1 mL不含血清、抗生素的RPMI-1640培养基混匀后加入培养皿中;6)转染6 h后,改为正常培养基继续培养48 h完成转染;7)Western blot法验证转染效果。
1.7 Western blot法检测蛋白表达具体步骤:细胞总蛋白的提取;BCA法测定实验各组细胞的蛋白量;SDS-聚丙烯酰胺凝胶电泳和转膜;检测目的蛋白。
1.8 流式细胞仪分选细胞1)将处于对数生长期的三阴性乳腺癌MDA-MB-231细胞消化、计数、离心;2)用含质量分数2%胎牛血清的RPMI-1640培养基重悬细胞,使细胞浓度达到1×106个/mL,取1 mL,加入2 μL利血平,于培养箱中孵育;3)30 min后,分别向加和不加利血平的每mL细胞悬液中加入Hoechst33342 2 μL,再孵育90 min;4)收集并用预冷PBS冲洗细胞2次,少量预冷PBS再次重悬细胞沉淀;5)分选细胞。
1.9 CCK-8法测定细胞生长曲线1)将处于对数生长期的转染后pENTER、pENTER-TM4SF1、NC-siRNA DsiRNA-1、DsiRNA-2、DsiRNA-3和同样作为对照的乳腺癌MDA-MB-231细胞消化计数后,每孔500个细胞接种到96孔板中过夜;2)细胞生长的第1、3、5、7天,每孔加入10 μL CCK8,然后检测450 nm处光密度(OD)值;3)绘制细胞生长曲线。
1.10 平板克隆形成实验1)消化处于对数生长期的细胞,计数板计数细胞,每组各取500个接种于3个直径3.5 cm的培养皿中;2)培养2周,可见明显细胞集落时终止培养;3)弃去培养基,PBS洗2次,加入甲醇固定10 min后弃去甲醇,质量分数0.1%结晶紫染色20 min;4)清水冲洗培养皿,去除非细胞集落上的结晶紫;5)显微镜下记数大于50个细胞的集落数。
1.11 动物实验1)20只3周龄、体质量约15 g的SPF级BALB/C雌性裸鼠于实验前1 d称重,然后按体质量分组,每组5只;2)处于对数生长期细胞经消化、离心、PBS清洗重悬,调整细胞浓度为5×106个/mL。小注射器抽吸0.1 mL接种于裸鼠双侧腋部皮下;3)5周后测量瘤体长短径,处死裸鼠,将肿瘤完整剥离,拍照,称重。

2 结果
2.1 三阴性乳腺癌MDA-MB-231细胞系的乳腺癌干细胞和普通乳腺癌细胞中TM4SF1 mRNA和蛋白水平比较在三阴性乳腺癌MDA-MB-231细胞系中,TM4SF1 mRNA在乳腺癌干细胞中的相对表达量是普通乳腺癌细胞的3倍(P<0.05)。在三阴性乳腺癌MDA-MB-231细胞系中,TM4SF1蛋白在乳腺癌干细胞中表达较高,在普通乳腺癌细胞中表达较低,两者比较差异有统计学意义(P<0.05),这与我们前期芯片和PCR的结果均一致。这提示TM4SF1可能在乳腺癌干细胞中发挥作用。见图1。
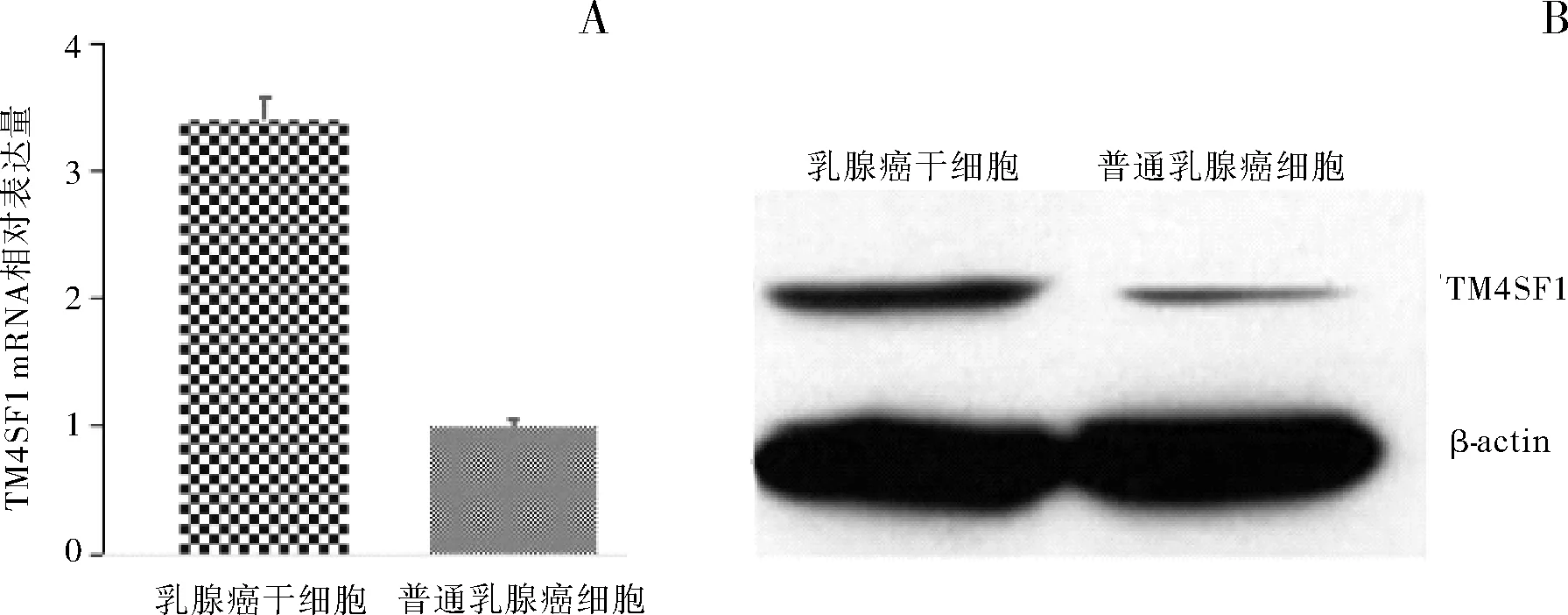
图1 三阴性乳腺癌MDA-MB-231细胞系的乳腺癌干细胞和普通乳腺癌细胞中TM4SF1 mRNA(A)和蛋白(B)表达
2.2 各组三阴性乳腺癌MDA-MB-231细胞系中TM4SF1蛋白表达比较Western blot检测发现,与空白对照组和NC-siRNA组比较,DsiRNA-1组、DsiRNA-2组、DsiRNA-3组的TM4SF1蛋白表达降低,以DsiRNA-1组降低最为明显(P均<0.05)。见图2。
2.3 各组三阴性乳腺癌MDA-MB-231细胞系中乳腺癌干细胞比例比较空白对照组、NC-siRNA组、DsiRNA-1组、DsiRNA-2组、DsiRNA-3组乳腺癌干细胞比例分别为0.96%、0.95%、0.2%、0.23%、0.25%。与空白对照组和NC-siRNA组比较,DsiRNA-1组、DsiRNA-2组、DsiRNA-3组的乳腺癌干细胞比例降低,以DsiRNA-1组降低最为明显(P均<0.05)。
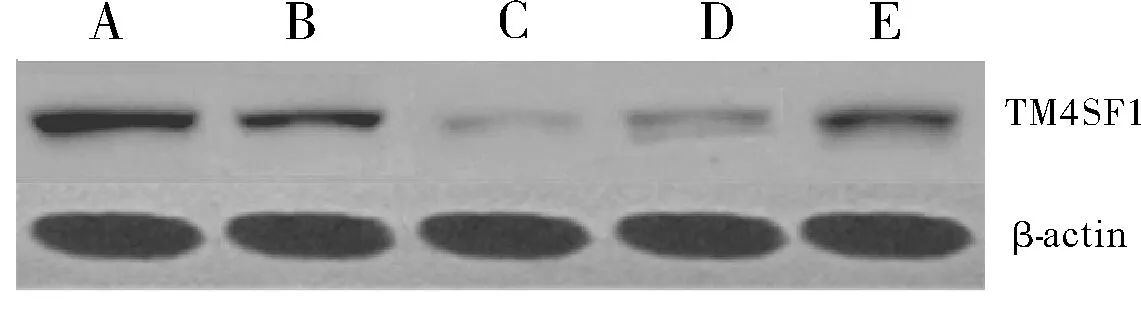
图2 各组三阴性乳腺癌MDA-MB-231细胞系中TM4SF1蛋白表达比较
A:空白对照组;B:NC-siRNA组;C:DsiRNA-1组;D:DsiRNA-2组;E:DsiRNA-3组
2.4 各组三阴性乳腺癌MDA-MB-231细胞系的细胞增殖速度比较各组三阴性乳腺癌MDA-MB-231细胞系的细胞增殖增殖速度相近(P均>0.05)。这提示TM4SF1可能是作用于乳腺癌干细胞。见图3。
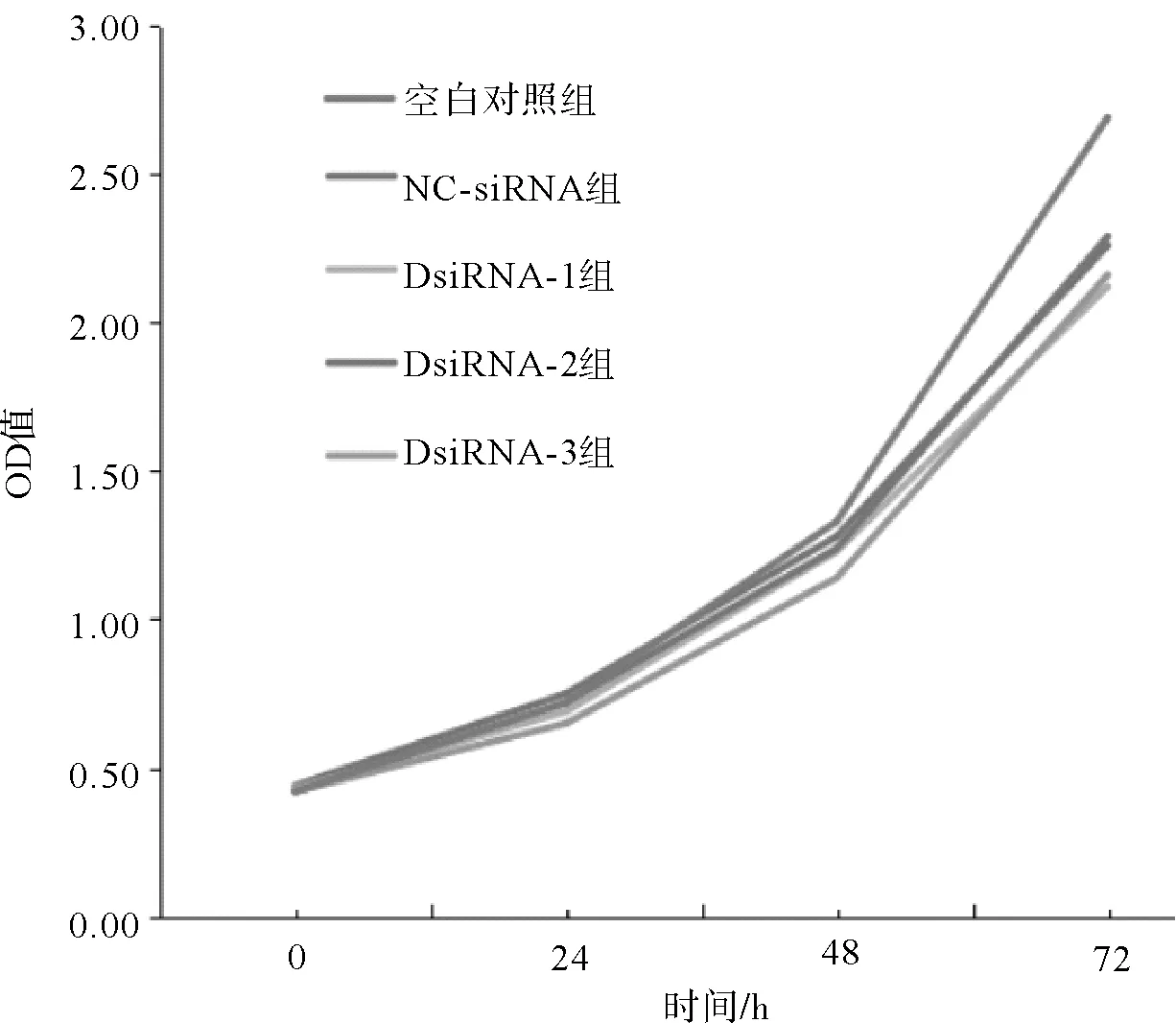
图3 各组三阴性乳腺癌MDA-MB-231细胞系的细胞增殖速度比较
2.5 各组三阴性乳腺癌干细胞的平板克隆形成能力比较从上述各组细胞分选出乳腺癌干细胞进行平板克隆形成实验,其中亲本MDA-MB-231细胞形成的克隆数明显多于沉默TM4SF1表达的DsiRNA-1组、DsiRNA-2组、DsiRNA-3组所形成的克隆数(P均<0.05)。这提示TM4SF1能够增强三阴性乳腺癌干细胞的克隆形成能力,即对三阴性乳腺癌MDA-MB-231细胞系的单个乳腺癌干细胞的增殖具有促进作用。见图4。
2.6 各组裸鼠瘤体体积比较裸鼠成瘤实验结果显示,接种5周后三阴性乳腺癌MDA-MB-231细胞系组瘤体体积为(3.20±0.08)mm3,明显大于三阴性乳腺癌MDA-MB-231细胞系DsiRNA-1组的(0.81±0.07)mm3,差异有统计学意义(P<0.05)。

图4 各组三阴性乳腺癌干细胞的平板克隆形成能力比较
A:空白对照组;B: NC-siRNA组; C: DsiRNA-1组; D: DsiRNA-2组; E: DsiRNA-3组
3 讨论
TM4SF1基因位于人3q21-3q25,编码一种低相对分子质量糖蛋白[5]。TM4SF1在许多上皮来源的恶性肿瘤中被发现,包括肺癌、乳腺癌、结直肠癌、胰腺癌、前列腺癌、膀胱癌等[6-11]。有报道认为,TM4SF1参与血管内皮细胞伪足形成,进而促进血管的生成[12]。TM4SF1可能参与调控肿瘤细胞生长、活化和浸润转移等生物学过程[13]。研究[6]证实,抗TM4SF1单克隆抗体处理肺癌细胞后,其侵袭能力显著降低。前列腺癌细胞的TM4SF1基因敲除后,细胞的迁移能力明显降低[10]。TM4SF1可能还参与肿瘤细胞的上皮间质转化这一生物学过程[14]。TM4SF1可能对多种恶性肿瘤的发生发展等生物学过程有影响,但其具体作用机制尚不明确。
间充质干细胞中TM4SF1高表达,但其他血液细胞、组织细胞和成纤维细胞中未见其表达,这提示TM4SF1可以作为干细胞表面标志物[15]。有研究[16]证实,TM4SF1可能参与肿瘤的多器官转移再激活,但对细胞增殖无明显影响。
本研究首先通过分析不同乳腺癌细胞中TM4SF1蛋白表达发现,其在乳腺癌干细胞中高表达。为了进一步研究TM4SF1基因在乳腺癌干细胞中的具体作用,本研究设计了针对TM4SF1基因3个不同靶点的3条siRNA干扰序列用于沉默TM4SF1基因的表达,转染后三者均能有效沉默TM4SF1基因表达,导致乳腺癌干细胞比例降低,但细胞增殖速度无明显差异;形成的克隆数明显降低。体外实验结果表明,接种5周后三阴性乳腺癌MDA-MB-231细胞系组瘤体体积明显大于三阴性乳腺癌MDA-MB-231细胞系DsiRNA-1组,提示乳腺癌干细胞能增强裸鼠致瘤能力,这也是关于细胞自我更新能力变化的最好证明。
综上所述,通过靶向TM4SF1通路能够抑制三阴性乳腺癌干细胞自我更新,该通路有可能作为乳腺癌干细胞新的治疗靶点,对三阴性乳腺癌具有潜在的治疗价值。但是TM4SF1影响干细胞的具体作用机制还有待进一步研究。

