昆虫学案例在遗传学教学中的应用
吴凯,罗朝晖
昆虫学案例在遗传学教学中的应用
吴凯,罗朝晖
上饶师范学院生命科学学院,上饶 334001
遗传学是相关专业本科生的核心课程之一。国内大部分高校在遗传学教学中使用普通遗传学教材,但不同专业背景的学生使用普通遗传学教材会产生较大的教学质量差异,特别是蚕学、蜂学、植物保护、动物科学等专业的本科生。虽然普通遗传学教材中有一些昆虫学案例,但没有随着昆虫学发展进行更新,且不能满足昆虫相关专业学生的专业素质培养需求。因此,本文对可应用于遗传学课程的昆虫学案例进行梳理,引入遗传学教学,更替部分普通遗传学教材中的非经典案例,并补充一些普通遗传学教材中使用较少的昆虫发育遗传学、核外遗传学和进化遗传学等案例。建立适用于昆虫学相关专业的遗传学理论体系与实验教学设计,使遗传学教学突出昆虫学相关专业的特色,以期对相关专业的学生学习和教师教学有所帮助。
昆虫学案例;遗传学;教学
遗传学是研究遗传和变异规律的科学,是生物学、医学和农学等专业本科生的必修课程。学好遗传学对本科生建立完整的生物学知识框架和理解生命的本质有很大帮助。掌握遗传学知识对遗传病、动植物育种、基因工程、个体发育、免疫、种质资源保护等的研究和生产也有重要意义。案例教学法可以加强学生对理论知识的理解和应用,并提高学生分析、推理、概括和辩论等能力[1],得到广泛应用。已有文献报道案例教学在林学专业和医学专业等遗传学课上获得很大成功[2,3]。
昆虫是地球上最多的动物,已命名的种类有100多万种,占动物界已知种类的2/3[4]。虽然已出版的关于昆虫遗传学书籍为昆虫相关专业的遗传学教学做出了巨大贡献[5~7],但内容各有偏重,不适宜现在的本科实际教学。而普通遗传学教材中昆虫学案例较少,对蚕学、蜂学、植物保护等专业的学生而言,难以体现专业相关性,且缺乏近年来的最新研究进展。本文通过对可用于遗传学教学的昆虫案例和研究进展进行梳理,并引入遗传学教学,以期建立具有昆虫相关专业特色的遗传学教学体系,为提升遗传学教学效果提供参考。
1 理论教学体系
关于理论教学,现有遗传学教学体系一般以两条主线讲授:以经典遗传学、细胞遗传学、分子遗传学、核外遗传学、发育遗传学和进化遗传学等的授课主线[8];以遗传信息为中心的主线,即遗传信息的遗传、储存、读取、复制、变异与进化的主线[9]。这两种讲授方法在教学中均有一定的优势。对此,本文按第一条主线将昆虫学案例融入遗传学的授课体系中,形成了具有昆虫相关专业特色的遗传学理论教学框架(54学时) (表1)。
1.1 绪论
除了对遗传学的基本定义、概念和研究内容讲授以外,遗传学的发展历程也会介绍。同时,为了体现昆虫学相关专业的特点,在普通遗传学的基础之上增加昆虫遗传学的实践意义与应用现状等内容。如在蚕桑生产中,一般雄性家蚕对疾病的抵抗力更高,且吃的食物少,产丝质量高。目前国内用转基因技术对家蚕进行遗传操作,建立了雌性家蚕特异性致死的系统[21],对蚕丝产业的发展具有重大的促进作用;通过转基因技术可以用内源、外源抗病毒基因,病毒RNAi基因,病毒免疫抑制基因等遗传元件改造家蚕,增强抗病毒能力[22];入侵害虫每年都给我国造成严重的经济损失,利用遗传调控技术可对入侵害虫进行防治[23];用家蚕作为生物反应器表达蛛丝蛋白等研究[10]。
1.2 经典遗传学
经典遗传学内容主要指1940年以前的工作,是学习遗传学的基础,本科生在中学学过这个模块,很容易导入遗传学课程的学习。除了孟德尔的豌豆实验,果蝇翅的性状杂交实验也可阐述分离定律和自由组合定律[8]。在经典遗传学中,基因间的显隐性关系、环境与表型等,也应补充昆虫学案例,如残翅果蝇()的幼虫在高温下饲养,羽化后其翅的大小接近野生型。而对复等位现象、镶嵌遗传的教学可使用异色瓢虫翅色多型案例。由于连锁与交换定律由摩尔根及其同事利用果蝇作为模型研究提出,这在普通遗传学教材中普遍存在,在昆虫相关专业授课中应重点介绍,特别是基因定位中的两点测交或三点测交。
在设计染色体及染色体组教学内容时,可以直接以昆虫为例。昆虫染色体有其自身特点,有些昆虫的性染色体组成为XY/XX,鳞翅目昆虫为ZW/ ZZ。但在一部分昆虫(如蝗虫)中,雄性个体只有一条X染色体,没有Y染色体,所以其性染色体组成为XO型。与此类似,鳞翅目昆虫中有一些雌性个体没有W染色体,为ZO型。此外,对于膜翅目的蜜蜂、蚂蚁等昆虫,性别与染色体组的倍数有关,而营养状况决定职能。如蜜蜂()的工蜂和蜂王为二倍体(2n=32),但工蜂吃的蜂王浆量少质差,雄蜂为单倍体(n=16)。为了激发学生学习兴趣,可将染色体研究和发现过程插入进来。如昆虫染色体的数目不一,杰克跳蚁()只有一对染色体,其孤雌生殖产生的雄蚁只有1条染色体[24],而一种灰蝶科的蝴蝶()的染色体2n=448-452[25],但这种蝴蝶最初被认为是多倍体生物。
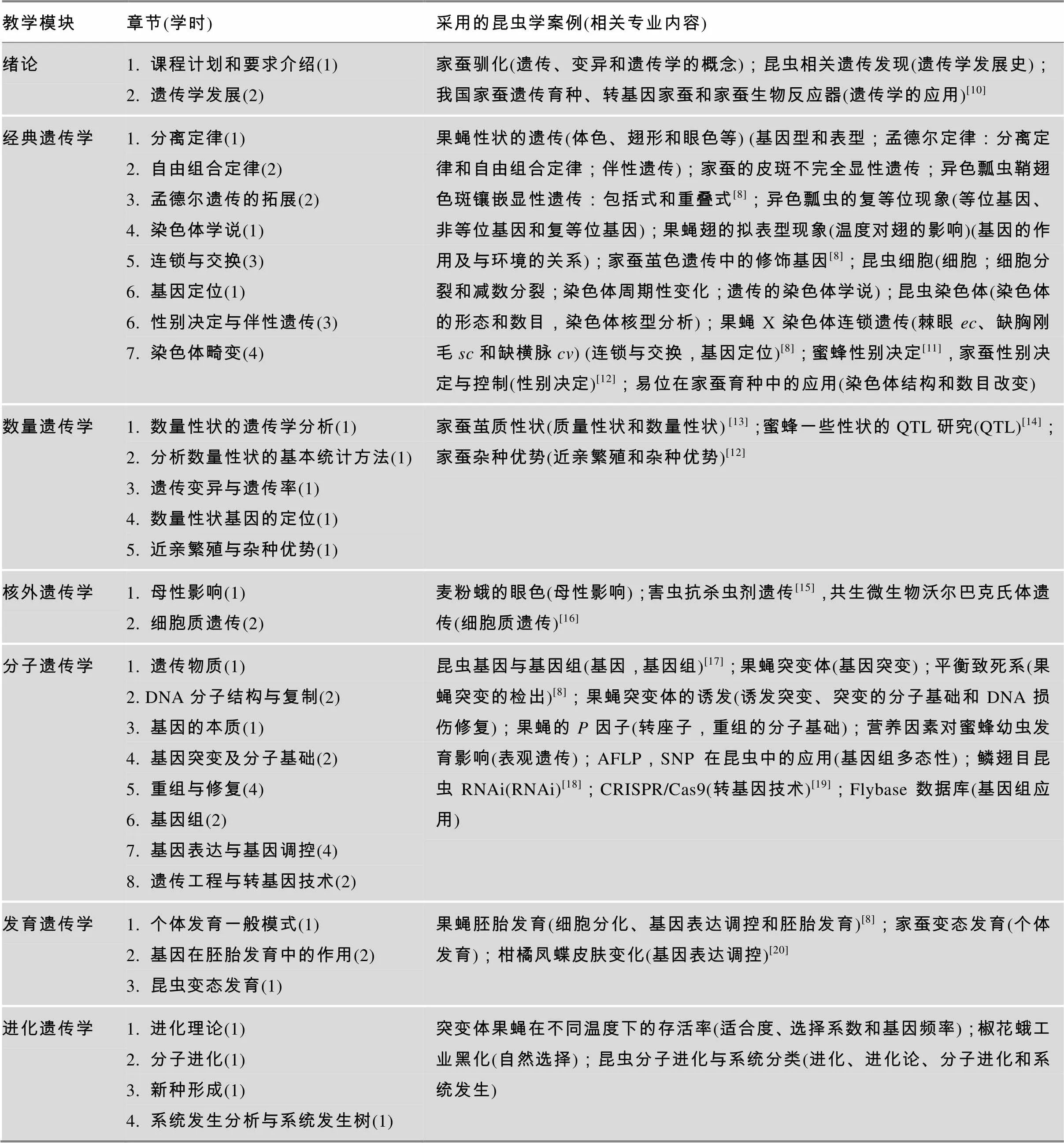
表1 适用于昆虫学相关专业的本科遗传学理论教学案例
未标出昆虫学案例的采用普通遗传学教材中的案例讲授。
伴性遗传和性别决定有一定联系常在一起讲授。性别决定机制是当今昆虫研究热点领域之一,每年有大量论文发表[26,27]。此部分内容的教学案例以果蝇()和家蚕的性别调控机制为主。在普通遗传学教材中,果蝇性别决定一般均有介绍,即果蝇的性别与早期胚胎的性指数(X染色体数目与常染色体组数A的比例)有关,若X∶A=0.5,会关闭性别决定相关基因的表达,发育为雄性;若X∶A=1,基因表达的蛋白Sxl参与另一性别相关基因基因转录产物的加工,得到有功能的tra蛋白,tra蛋白与tra2蛋白可以促使雌性特异的dsx蛋白产生,dsx蛋白可抑制雄性性别发育,因此果蝇胚胎发育为雌性。Y染色体与性别没关,只决定雄蝇的可育性,其机制不在此赘述。在家蚕中,W染色体对雌性家蚕性别形成非常重要,但并没有编码蛋白的基因被分离出来,相反,却有大量的转座元件,且雌性家蚕W染色体性别决定区可以产生大量piRNAs[28]。W染色体产生的雌性特异Fem piRNA,是家蚕最初级的性别决定因子[29]。研究表明,在雌性家蚕胚胎中抑制Fem piRNA介导的信号通路会导致产生特异性的doublesex选择性剪接使家蚕向雄性发育[29]。随后的实验证明家蚕组蛋白甲基转移酶BmAsh2在piRNA介导性别决定过程中起到关键作用[30],而雄性家蚕的性别决定和P元件体抑制剂(BmPSI)有关[31]。

1.3 数量遗传学
数量遗传学是遗传学重要内容之一。与孟德尔和摩尔根的质量性状遗传理论不同,数量遗传学是研究数量性状变异规律的学科。很多数量性状都是经济性状:产蜜量,奶牛泌乳量,作物产量等,特点是呈连续变化,没有明显界限,但其表型变异分为遗传变异和环境变异两部分。事实上,数量遗传在昆虫中的应用很早。20世纪90年代,莫建初与唐振华就注意到数量遗传学在害虫种群抗性进化研究中的作用,并提出害虫抗性遗传力被高估或低估的因素[32]。2003年司马杨虎对家蚕茧质性状的数量性状位点(QTL)进行定位分析,发现控制全茧量性状有14个QTL,并分布在14个连锁群上[13]。蜜蜂的取食行为、自卫行为、体长和逆转学习等相关性状均已进行QTL研究[33],对社会性昆虫蜜蜂的数量遗传学研究对生物学发展具有重大意义。自然选择使个体对自然的适应性提高,但数量遗传学的研究对人工选择优良的经济性状及育种有重要意义。这对提高蚕学和蜂学专业的学生学习兴趣很有帮助。
1.4 核外遗传学
核外遗传学是研究细胞核以外遗传规律的学科,其教学案例除了叶绿体花斑叶的核外遗传案例,动物中的核外遗传案例似乎很少,但笔者整理发现,昆虫相关的核外遗传案例却不少。
例如:一种叶螨()抗杀虫剂联苯双酯的遗传是完全母性遗传[15],甲壳纲动物的外寄生虫鲑鱼虱()对溴氰菊酯的抗性也是通过母性遗传,并降低细胞凋亡[34]。在赤拟谷盗()中,细菌可以从母体的肠道转移到卵,用来预先增强后代的免疫[35],这在大蜡螟()中也有类似现象[36]。在节肢动物体内普遍存在有一种沃尔巴克氏体()的共生微生物,它传递给子代的方式便是通过宿主卵细胞质,也是一个可应用于教学的典型案例。沃尔巴克氏体在昆虫体内具有参与调控宿主生殖活动的功能[37]。有研究发现,黄粉蝶()如果感染Fem沃尔巴克氏体,产生的后代全部为雌性,若给Fem感染的雌性蝴蝶饲喂抗生素,会产生雄性后代。这与感染Fem沃尔巴克氏体会引起Z0雌性化、W染色体缺失和破坏Z染色体遗传有关[16]。另外有研究表明内共生体沃尔巴克氏体属可以将自身基因组片段转移到宿主X染色体[38],虽然转入的基因通常没有活性,但可增加宿主的遗传多样性。
1.5 分子遗传学
现代分子生物学技术使遗传学发展突飞猛进,不注重分子遗传学知识的讲授,将不能适应学科发展。但据观察,虽然有些技术已经使用多年,而绝大部分本科生却知之甚少,因此这个模块也是案例梳理和讲授的重点。在教学过程中,一要结合昆虫学案例讲授基本概念、定律、原理、机制,二要对现有的基因技术应用讲授,提高学生学以致用的思维。本模块采用DNA—RNA—蛋白质的路线进行,中间穿插基因组和基因突变、表观遗传和转基因技术等内容。下面仅介绍昆虫基因组和表观遗传两部分案例。
对于昆虫的基因组研究,添加国内学者做出的贡献,如家蚕()、褐飞虱(、柑橘凤蝶()、小菜蛾()、烟粉虱()、飞蝗()和榕小蜂()等多种昆虫的基因组图谱为我国昆虫学家研究发表[39]。讲授过程中,也可将昆虫基因组大小与植物和动物基因组大小比较,使学生加深对昆虫的认识,培养专业素养。此外,基因组、转录组测序及数据分析已广泛应用到生物学基础研究,增加GenBank和FlyBase等数据库的介绍与使用。
表观遗传学研究的是不涉及DNA序列改变的基因表达和调控的可遗传修饰,包括DNA甲基化、组蛋白修饰、RNA介导的基因沉默等。本处案例以蜜蜂级型分化现象为例,讲解蜜蜂的营养因素怎样通过影响幼虫体内大量基因和蛋白的差异表达导致发育为蜂王和工蜂。研究表明,增加幼虫对蜂王浆的采食量,幼虫的基因甲基化水平会显著降低,而幼虫发育为蜂王的比例会提高[11]。另外,microRNA和组蛋白乙酰化也可调节基因表达,与级型分化有一定关系[40]。
1.6 发育遗传学
哺乳动物受精卵发育成个体以后基本上是由小变大的过程,而昆虫发育为变态发育。完全变态的昆虫会经历卵、幼虫、蛹和成虫等发育阶段,在蛹期会发生剧烈变化,如从毛毛虫到蝴蝶的变化。从遗传学的角度来看,个体发育涉及到核基因组、细胞器基因组和母体基因产物的作用。因此,在设计本模块时,将细胞分化、胚胎发育和个体发育整理规划,具有连贯性。
昆虫的发育受到激素调节,保幼激素和蜕皮激素在昆虫发育中起到关键作用。对于昆虫的发育遗传以果蝇胚胎发育的遗传控制研究的最为成熟,在多数教材中均有涉及。在对果蝇胚胎发育中的母体效应基因,裂隙基因,成对规则基因以及体节极性基因的基础上,增加讲授一些新的研究,如对果蝇30个不同发育时期进行RNA-Seq、tiling microarrays和cDNA序列分析,发现基因转录在整个发育过程中是动态变化的[41];其它鳞翅目昆虫的变态发育,特别是家蚕的研究,也是很好的案例。例如FOXO转录因子对家蚕生长发育的调控主要通过调节保幼激素的降解实现[42]。柑橘凤蝶幼虫皮肤发育也值得关注,其1~4龄幼虫皮肤为鸟粪状,5龄幼虫皮肤为绿色。为何4龄以前的蜕皮皮肤模式相差不大,而4~5龄的蜕皮皮肤差异巨大?通过microarray数据分析发现,在不同时期的幼虫有大量基因的转录水平发生变化,并且E75基因可能和幼虫皮肤变化有很大关系[20]。
将现有文献整理成教学案例,可以开扩学生视野,使其了解最新研究进展,同时也促进教师教学相长。
1.7 进化遗传学
进化遗传学部分有一个经典的昆虫案例,即自然选择的例子“工业黑化”。欧洲的产业革命使一些地区逐渐工业化,这使许多鳞翅目昆虫的黑色型个体频率逐渐上升。在曼彻斯特,最初黑色型椒花蛾频率很低,但从工业化以后,黑色型稳定上升,达95%以上。但从近年来的昆虫进化与遗传学研究发展来看,昆虫相关专业的遗传学教学内容应该补充一些新知识。
昆虫系统发育学是研究昆虫类群亲缘关系、进化地位、分子演化和起源的学科,是昆虫学研究的一个重要领域。将昆虫系统发育的案例应用到遗传学教学中来,会使本科生对昆虫系统发育研究方向有进一步了解,对以后读研深造或从事相关科研工作均有帮助。例如:飞蝗虽然只有一个种,但有10个亚种。这些亚种因不同地域特点存在不同形态特征。传统的形态学测量方法区分飞蝗亚种具有很多缺点,如卵的滞育率,抗寒性是连续的,而且外部形态特征易受环境影响发生变化,而分子标记法如RAPD、微卫星和mtDNA等方法为分类和进化提供了有效手段,进而提示飞蝗不同地理种群的遗传多样性[43]。通过遗传多样性比较分析和近缘属的分布研究表明飞蝗起源于非洲,与人类走出非洲理论吻合[43]。此外,烟盲蝽及其近缘种的种群遗传学研究均可用于遗传学教学。利用线粒体基因进行系统发育学的研究,可以用来鉴定昆虫的系统进化关系。在害虫防治方面,天敌昆虫种群遗传学的应用可以为引进天敌昆虫进行生物防治提供理论基础[44]。
2 遗传学实验教学设计
实验教学有助于学生掌握基础知识,发现问题,总结归纳,带动后续课程的学习。因此,实验教学体系的设计既要有基本的验证性实验,也要兼顾综合性和探究性实验对学生科研素质的培养。为此,在昆虫相关专业遗传学实验中可以添加经典的昆虫染色体的观察实验[45,46],双翅目昆虫幼虫的唾腺细胞、肠细胞、气管细胞中存在多线染色体,这也是昆虫中很好的案例,供学生了解染色体和实验观察。除此之外,最好将现代生物学实验方法融入到遗传学实验中。
根据昆虫相关专业的特点和学生培养目标的要求,可以设置以下实验(表2)。
验证性实验3个:(1)昆虫幼虫、成虫性别鉴定:包括果蝇饲料配置,果蝇生活史观察,果蝇雌雄鉴别;(2)果蝇唾腺染色体的观察;(3)环境与表型的关系—温度对果蝇卷翅程度的影响。
综合性实验2个:(1)果蝇杂交实验(单因子,双因子,伴性遗传)。单因子杂交,双因子杂交,伴性遗传的实验含有统计学分析,要求学生使用卡方检验判断F2的比例等。(2)果蝇Gal4—UAS系统检测基因在特定部位表达。Gal4—UAS系统是果蝇中常用的研究基因表达和功能的方法[49,50]。以果蝇作为模式生物进行科学研究必需具备果蝇遗传杂交实验技能,特别是平衡子和Gal4—UAS系统的应用,其重要性不言而喻。因此,在实验中安排“果蝇Gal4—UAS系统检测基因在特定部位表达”的实验。由于GFP蛋白的绿色荧光信号便于观察,所以使用UAS- GFP果蝇品系。
探究性实验2个:(1)野外昆虫采集及基于细胞色素氧化酶亚基I (COI)基因测序鉴定;(2)昆虫基因PCR扩增。在遗传学实验中常规分子生物学实验技术训练较少的问题得到普遍关注[51]。目前已有高校将经典实验与新技术融合的理念引入遗传学实验教学改革中[52,53]。但实验教学改革也应和学校硬件、软件条件相适应,例如复旦大学、上海交通大学在本科生的实验中引入CRISPR/Cas9系统定点敲除的实验[53],在一般大学很难完成。因此较为前沿的技术CRISPR/Cas9技术原理可在理论课上详细讲解。DNA条码(DNA barcoding)是一种很好的物种鉴定分子工具,因结果非常可靠,已广泛应用于昆虫分类研究中。目前国外已有教师将襀翅目()的石蝇(stoneflies)DNA条码分析应用于遗传学实验教学中,取得了很好的教学效果[47]。对此,在昆虫相关专业的遗传学实验中,增加这一探究性实验,由学生自己去采集昆虫,通过形态描述分类,结合遗传学基因的扩增、测序和分析的实验,提高专业能力和科研素质。

表2 适用于昆虫相关本科专业遗传学实验设计
综合本实验设计,既含有验证性的昆虫性别、染色体观察等验证性实验,也含有果蝇饲养,生活史观察,环境与表型关系,杂交等综合性实验,也兼顾了分子遗传学方法和技能的培养,能够有效满足培养高素质昆虫相关专业学生的需求。
3 结语
遗传工具创新和应用使遗传学急速发展,新的知识产生使分子遗传学内容越来越多,复杂的分子机制和遗传学新内容的整合对本科生学好遗传学是一个巨大的挑战。对于昆虫相关专业的本科生来说,如何学习和掌握昆虫遗传学知识,了解当前昆虫研究动态、方向,对高校培养高素质、专业能力强的昆虫优秀人才有着极其重要的意义。本文对昆虫学领域中的遗传学案例进行了梳理,建立了具有昆虫相关专业特色的昆虫遗传学理论教学体系和实验教学设计,能够跟上学科发展的步伐,也使学生对所学专业有更深入的认识。
在遗传学教学过程中,并不提倡全部使用昆虫学案例而舍弃应用普通遗传学教材中的经典案例。而且,有些知识点在昆虫中缺少合适的案例,如在动物界自然产生的多倍体是非常罕见的,虽然曾在鱼类、鸟类、两栖类等动物中有多倍性个体报道,但都不能形成类群[54]。在昆虫中,单倍体、二倍体比较常见,多倍体昆虫也有报道,但自然界中异源多倍体的昆虫学案例鲜有报道。因此使用异源八倍体小黑麦的例子进行讲授就非常重要。所以,昆虫学案例在遗传学教学中的应用只是替代了一些普通遗传学教材中的案例,增加了一些其中没有的案例,来促进教学。
[1] Wang QM, Zhao G. An overview on case method researches at home and abroad., 2009, 31(3): 7–11.王青梅, 赵革. 国内外案例教学法研究综述. 宁波大学学报(教育科学版), 2009, 31(3): 7–11.
[2] Wang QM, Cui JG, Yu CZ, Zhang Z, Wu YL, Zhang LJ, Lin M. Application of case teaching in genetics courses to students majoring in forestry., 2017, 39(10): 939–946.王钦美, 崔建国, 于长志, 张智, 吴月亮, 张丽杰, 林梅. 案例教学在林学专业遗传学教学中的应用. 遗传, 2017, 39(10): 939–946.
[3] He ZM, Bie LS, Li W. Application of medical cases in general genetics teaching in universities.,2018, 40(1): 75–85.贺竹梅, 别林赛, 李蔚. 医学病例在高校普通遗传学教学中的运用. 遗传, 2018, 40(1): 75–85.
[4] Kang L. Miraculous insects., 2016, 4: 1.康乐. 神奇的昆虫. 大自然, 2016, (4): 1.
[5] Zhang QW. Insect genetics. Beijing:Science Press, 2000.张青文. 昆虫遗传学. 北京:科学出版社, 2000.
[6] Marian R. Goldsmith and Frantisek Marec. Molecular biology and genetics of the Lepidoptera. Chongqing: Southwest China Normal University Press, 2011.玛丽安·戈德史密斯, 弗兰蒂塞克·马莱克. 鳞翅目昆虫的分子生物学和遗传学. 重庆:西南师范大学出版社, 2011.
[7] Peng JX, Yang H, Hong HZ. Insect molecular genetics. Wuhan:Central China Normal University Press, 2006.彭建新, 杨红, 洪华珠. 昆虫分子遗传学. 武汉:华中师范大学出版社, 2006.
[8] Liu ZD, Qiao SY, Wu YH, Zhao SY. Genetics. 3rd ed. Beijing:Higher Education Press, 2013.刘祖洞, 乔守怡, 吴燕华, 赵寿元. 遗传学(第三版). 北京:高等教育出版社, 2013.
[9] Xing WJ, Morigen, Damirin A, Su HM. Restructuring teaching contents of genetics by focusing on the genetic information and its connection with other courses., 2011, 33(6): 661–664.邢万金, 莫日根, 阿拉坦高勒, 苏慧敏. 以遗传信息为主线的遗传学教学架构及与其他课程的衔接. 遗传, 2011, 33(6): 661–664.
[10] Xu J, Dong Q, Yu Y, Niu B, Ji D, Li M, Huang Y, Chen X, Tan A. Mass spider silk production through targeted gene replacement in., 2018, 115(35): 8757–8762.
[11] He ZM. Modern genetics analysis: from gene to phenotype. 3rd ed. Beijing:Higher Education Press, 2017. 贺竹梅. 现代遗传学教程:从基因到表型的剖析(第3版). 北京:高等教育出版社, 2017.
[12] Lv HS. Principles of sex control in the silkworm. Shanghai:Shanghai Scientific and Technical Publishers, 2010.吕鸿声. 家蚕性别控制原理. 上海:上海科学技术出版社, 2010.
[13] Sima YH. Study on construction of molecular linkage map and location of QTLs controlling cocoon traits in silkworm[D]. Southwest Agricultural University, 2003.司马杨虎. 家蚕分子图谱的构建及茧质性状的QTL定位研究[学位论文]. 西南农业大学, 2003.
[14] Shi W, Ding GL, Zhang XL, Lv LP. The developing history of honeybee genetices., 2006, 57(6): 21–22.石巍, 丁桂玲, 张秀琳, 吕丽萍. 蜜蜂遗传学发展简史. 中国蜂业, 2006, 57(6): 21–22.
[15] Van Leeuwen T, Tirry L, Nauen R. Complete maternal inheritance of bifenazate resistance in Tetranychus urticae Koch (Acari: Tetranychidae) and its implications in mode of action considerations., 2006, 36(11): 869–877.
[16] Kageyama D, Ohno M, Sasaki T, Yoshido A, Konagaya T, Jouraku A, Kuwazaki S, Kanamori H, Katayose Y, Narita S, Miyata M, Riegler M, Sahara K. Feminizing Wolbachia endosymbiont disrupts maternal sex chromosome inheritance in a butterfly species., 2017, 1(5): 232–244.
[17] Xia Q, Zhou Z, Lu C, Cheng D, Dai F, Li B, Zhao P, Zha X, Cheng T, Chai C, Pan G, Xu J, Liu C, Lin Y, Qian J, Hou Y, Wu Z, Li G, Pan M, Li C, Shen Y, Lan X, Yuan L, Li T, Xu H, Yang G, Wan Y, Zhu Y, Yu M, Shen W, Wu D, Xiang Z, Yu J, Wang J, Li R, Shi J, Li H, Li G, Su J, Wang X, Li G, Zhang Z, Wu Q, Li J, Zhang Q, Wei N, Xu J, Sun H, Dong L, Liu D, Zhao S, Zhao X, Meng Q, Lan F, Huang X, Li Y, Fang L, Li C, Li D, Sun Y, Zhang Z, Yang Z, Huang Y, Xi Y, Qi Q, He D, Huang H, Zhang X, Wang Z, Li W, Cao Y, Yu Y, Yu H, Li J, Ye J, Chen H, Zhou Y, Liu B, Wang J, Ye J, Ji H, Li S, Ni P, Zhang J, Zhang Y, Zheng H, Mao B, Wang W, Ye C, Li S, Wang J, Wong GK, Yang H. A draft sequence for the genome of the domesticated silkworm ()., 2004, 306(5703): 1937–1940.
[18] Li Z, Zeng B, Ling L, Xu J, You L, Aslam AF, Tan A, Huang Y. Enhancement of larval RNAi efficiency by over-expressing Argonaute2 in.,2015, 11(2): 176–185.
[19] Wei W, Xin H, Roy B, Dai J, Miao Y, Gao G. Heritable genome editing with CRISPR/Cas9 in the silkworm, Bombyx mori.,2014, 9(7): e101210.
[20] Futahashi R, Shirataki H, Narita T, Mita K, Fujiwara H. Comprehensive microarray-based analysis for stage-specificlarval camouflage pattern-associated genes in the swallowtail butterfly, Papilio xuthus., 2012, 10: 46.
[21] Tan A, Fu G, Jin L, Guo Q, Li Z, Niu B, Meng Z, Morrison NI, Alphey L, Huang Y. Transgene-based, female-specific lethality system for genetic sexing of the silkworm,., 2013, 110(17): 6766–6770.
[22] Jiang L, Xia Q. The progress and future of enhancing antiviral capacity by transgenic technology in the silkworm., 2014, 48: 1–7.
[23] Li ZQ, Chen K, Yang FY, Huang YP. Application of genetic regulation technique for invasive pest management., 2017, 32(8): 836–844.李芝倩, 陈凯, 杨芳颖, 黄勇平. 适用于入侵害虫治理的遗传调控技术. 中国科学院院刊,2017, 32(8): 836– 844.
[24] Crosland MW, Crozier RH. Myrmecia pilosula, an Ant with only one pair of chromosomes., 1986, 231(4743): 1278.
[25] Lukhtanov VA. The blue butterfly Polyommatus (Plebicula) atlanticus (Lepidoptera, Lycaenidae) holds the record of the highest number of chromosomes in the non-polyploid eukaryotic organisms., 2015, 9(4): 683– 690.
[26] Kan L, Grozhik AV, Vedanayagam J, Patil DP, Pang N, Lim KS, Huang YC, Joseph B, Lin CJ, Despic V, Guo J, Yan D, Kondo S, Deng WM, Dedon PC, Jaffrey SR, Lai EC. The m6A pathway facilitates sex determination in Drosophila., 2017, 8: 15737.
[27] Guo J, Tang HW, Li J, Perrimon N, Yan D. Xio is a component of the Drosophila sex determination pathway and RNA N6-methyladenosine methyltransferase complex.,2018, 115(14): 3674–3679.
[28] Kawaoka S, Kadota K, Arai Y, Suzuki Y, Fujii T, Abe H, Yasukochi Y, Mita K, Sugano S, Shimizu K, Tomari Y, Shimada. The silkworm W chromosome is a source of female-enriched piRNAs.,2011, 17(12): 2144–2151.
[29] Kiuchi T, Koga H, Kawamoto M, Shoji K, Sakai H, Arai Y, Ishihara G, Kawaoka S, Sugano S, Shimada T, Suzuki Y, Suzuki MG, Katsuma S. A single female-specific piRNA is the primary determiner of sex in the silkworm., 2014, 509(7502): 633–636.
[30] Li Z, You L, Yan D, James AA, Huang Y, Tan A. Bombyx mori histone methyltransferase BmAsh2 is essential for silkworm piRNA-mediated sex determination., 2018, 14(2): e1007245.
[31] Xu J, Chen S, Zeng B, James AA, Tan A, Huang Y. Bombyx mori P-element somatic inhibitor (BmPSI) is a key auxiliary factor for silkworm male sex determination., 2017, 13(1): e1006576.
[32] Mo JC, Tang ZH. Application of quantitative genetics in evolutionary study of pest population resistance., 1997, 34(3): 183–186.莫建初, 唐振华. 数量遗传学在害虫种群抗性进化研究中的应用. 昆虫知识, 1997, 34(3): 183–186.
[33] Luo AR, Zhang YZ, Ding L, Zhu CD. Research advances on QTL of honey bees in the post-genomic era., 2007, 50(9): 950–956.罗阿蓉, 张彦周, 丁亮, 朱朝东. 后基因组时代的蜜蜂QTL研究. 昆虫学报, 2007, 50(9): 950–956.
[34] Bakke MJ, Agusti C, Bruusgaard JC, Sundaram AYM, Horsberg TE. Deltamethrin resistance in the salmon louse, lepeophtheirus salmonis (Krøyer): maternal inheritance and reduced apoptosis., 2018, 8(1): 8450.
[35] Knorr E, Schmidtberg H, Arslan D, Bingsohn L, Vilcinskas A. Translocation of bacteria from the gut to the eggs triggers maternal transgenerational immune priming in tribolium castaneum., 2015, 11(12): 20150885.
[36] Freitak D, Schmidtberg H, Dickel F, Lochnit G, Vogel H, Vilcinskas A. The maternal transfer of bacteria can mediate trans-generational immune priming in insects., 2014, 5(4): 547–554.
[37] Dong P, Wang JJ. Reproductive manipulation of Wolbachia to its hosts., 2006, 43(3): 288–294.董鹏, 王进军. 沃尔巴克氏体Wolbachia对宿主的生殖调控作用及其研究进展. 昆虫知识, 2006, 43(3): 288– 294.
[38] Kondo N, Nikoh N, Ijichi N, Shimada M, Fukatsu T. Genome fragment of Wolbachia endosymbiont transferred to X chromosome of host insect., 2002, 99(22): 14280–14285.
[39] Hou L, Zhan S, Zhou X, Li F, Wang XH. Advances in research on insect genomics in China., 2017, 54(5): 693–704.侯丽, 詹帅, 周欣, 李飞, 王宪辉. 中国昆虫基因组学的研究进展. 应用昆虫学报, 2017, 54(5): 693–704.
[40] Shi YY, Wang ZL, Zeng ZJ. Advances in research on epigenetics and caste differentiation in the honey bee., 2014, 51(6): 1406–1412.石元元, 王子龙, 曾志将. 表观遗传学与蜜蜂级型分化的研究进展. 应用昆虫学报, 2014, 51(6): 1406–1412.
[41] Graveley BR, Brooks AN, Carlson JW, Duff MO, Landolin JM, Yang L, Artieri CG, van Baren MJ, Boley N, Booth BW, Brown JB, Cherbas L, Davis CA, Dobin A, Li R, Lin W, Malone JH, Mattiuzzo NR, Miller D, Sturgill D, Tuch BB, Zaleski C, Zhang D, Blanchette M, Dudoit S, Eads B, Green RE, Hammonds A, Jiang L, Kapranov P, Langton L, Perrimon N, Sandler JE, Wan KH, Willingham A, Zhang Y, Zou Y, Andrews J, Bickel PJ, Brenner SE, Brent MR, Cherbas P, Gingeras TR, Hoskins RA, Kaufman TC, Oliver B, Celniker SE. The developmental transcriptome of Drosophila melanogaster., 2011, 471(7339): 473–479.
[42] Zeng B, Huang Y, Xu J, Shiotsuki T, Bai H, Palli SR, Huang Y, Tan A. The FOXO transcription factor controls insect growth and development by regulating juvenile hormone degradation in the silkworm,., 2017, 292(28): 11659–11669.
[43] Ma C, Kang L. Population genetics and the subspecific taxonomy of the migratory locust., 2013, 50(1): 1–8.马川, 康乐. 飞蝗的种群遗传学与亚种地位. 应用昆虫学报, 2013, 50(1): 1–8.
[44] Li HS, Pang H. Population genetics of predatory ladybirds and its applications in biological control., 2016, 38(2): 221–227.李浩森, 庞虹. 天敌瓢虫种群遗传学及其在生物防治中的应用. 环境昆虫学报, 2016, 38(2): 221–227.
[45] Tao HM, Cai ZH, He ZB, Cao K, Wu XF. Observation of chromosome meiosis of locusta migratoria manilensis., 2010, 27(2): 20–22.陶红梅, 蔡志华, 何正波, 曹锴, 吴学芳. 东亚飞蝗染色体的减数分裂观察. 重庆师范大学学报(自然科学版), 2010, 27(2): 20–22.
[46] Fu JY, Zhang QW, Cai QN, Xu J, Ma XM, Zhang LS. Observations on mitotic and meiotic chromosomes of the beet armyworm, spodoptera exigua hübner (Lepidoptera: Noctuidae)., 2005, 48(1): 135–138.
[47] Elwess NL, Latourelle SM, Myers L. DNA barcoding of stoneflies (Plecoptera) in a general genetics course., 2018, 52(4): 406–414.
[48] Li RN, Wang Q, Li XH, Deng XM, Wu CX. Example of molecular genetic experimental design in teaching of Animal Genetics Experiment., 2017, 34(7): 207–210.李荣妮, 王勤, 李新海, 邓学梅, 吴常信. “动物遗传学实验”教学中分子遗传实验设计举例. 实验技术与管理, 2017, 34(7): 207–210.
[49] Duffy JB. GAL4 system in Drosophila: a fly geneticist's Swiss army knife., 2002, 34(1–2): 1–15.
[50] Li KX, Ma EB, Zhang JZ, Zhao YD, Zhang XB. Combination of Gal80tsand Gal4 flexibly manipulates the expression levels of UAS transgenes in drosophila., 2016, 59(5): 481–488.李开霞, 马恩波, 张建珍, 赵一丹, 张徐波. Gal80ts与Gal4组合灵敏控制果蝇中UAS转基因的表达水平. 昆虫学报, 2016, 59(5): 481–488.
[51] Deng YW, Li JH. Teaching reform of genetics experiment course based on improving college students' innovative ability., 2018, (7): 247–248.邓岳文, 李俊辉. 基于提高大学生创新能力的遗传学实验课教学改革. 课程教育研究, 2018, (7): 247–248.
[52] Pi Y, Su MJ, Wei LQ, Lu DR, Qiao SY. An exploration of teaching in the genetic experiments——developing a type with classic experiments and new technology fused (1)., 2017, 7(3): 53–57.皮妍, 苏明杰, 韦理强, 卢大儒, 乔守怡. 遗传学实验的教学改革——经典实验与新技术相融合(一). 高校生物学教学研究(电子版), 2017, 7(3): 53–57.
[53] Guo B, Mo AW, Cai L, Qiao SY, Pi Y. An exploration of teaching in the genetic experiments——developing a type with classic experiments and new technology fused (2)., 2018, 8(1): 56–60.郭滨, 莫翱溦, 蔡亮, 乔守怡, 皮妍. 遗传学实验的教学改革——经典实验与新技术的融合(二). 高校生物学教学研究(电子版), 2018, 8(1): 56–60.
[54] Li BC. Animal genetics. Beijing: China Agricultural University Press, 2008.李碧春. 动物遗传学. 北京: 中国农业大学出版社, 2008.
Application of entomological cases in genetics teaching
Kai Wu, Zhaohui Luo
Genetics is one of the core courses for undergraduates majoring in related disciplines. Most universities use general genetics textbooks in teaching, which will lead to different teaching qualities for students in different majors, especially in sericulture, apiculture, plant protection, and animal science. This is especially true for students majoring in insects. Although there are some entomology cases in general textbooks, they have not been updated with developments in entomology and cannot meet the needs of comprehensive quality training. Therefore, we review entomology cases that can be used in genetics courses, introduce genetics teaching points, offers replacements for some non-classical cases in general genetics textbooks, and supplement several cases of insect developmental genetics, extranuclear genetics, and evolutionary genetics, which are seldom described in general genetics textbooks. We also establish a genetics theoretical system and experimental teaching design for entomology-related majors to highlight the characteristics of entomology- related majors in genetics teaching, aiming to help students and teachers in related majors.
entomological cases; genetics; teaching
2018-10-12;
2019-02-02
江西省教育厅科技项目一般项目(编号:GJJ170925)和江西省高等学校教学改革研究一般项目(编号:JXJG-13-16-2)资助[Supported by Science and Technology Research Project of Education Department of Jiangxi Province (No.GJJ170925)] and Teaching Reform Project of Education Department of Jiangxi Province (No. JXJG-13-16-2)]
吴凯,博士,讲师,研究方向:昆虫遗传育种。E-mail: wukaixz@163.com
罗朝晖,硕士,副教授,研究方向:生物学方面教学与科研研究。E-mail: 376816471@qq.com
10.16288/j.yczz.18-286
2019/2/3 7:15:17
URI: http://kns.cnki.net/kcms/detail/11.1913.R.20190202.2207.001.html
(责任编委: 张飞雄)

