MEK抑制剂PD0325901显著提高猪胎儿成纤维细胞ssODN介导的HDR效率
欧浩,李国玲,王豪强,黄广燕,蔡更元,2,李紫聪,吴珍芳,2,张献伟,2
MEK抑制剂PD0325901显著提高猪胎儿成纤维细胞ssODN介导的HDR效率
欧浩1,李国玲1,王豪强1,黄广燕1,蔡更元1,2,李紫聪1,吴珍芳1,2,张献伟1,2
1. 华南农业大学动物科学学院,国家生猪种业工程技术研究中心,广州 510642 2. 温氏食品集团股份有限公司,新兴 527400
基因组DNA发生双链断裂(double strand break, DSB)后主要通过同源定向修复(homologous-directed repair, HDR)和非同源末端连接(nonhomologous end joining, NHEJ)两种途径进行修复,其中单链寡聚核苷酸(single-stranded oligodeoxyribonucleotide, ssODN)介导的同源定向修复是动物基因组常用的基因组定点修饰技术,具有较大的科研和应用价值。为提高猪基因组ssODN介导HDR效率,本研究以猪胎儿成纤维细胞(porcine fetal fibroblasts, PFFs)为研究对象,利用丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase, MEK)抑制剂PD0325901培养细胞,研究其对HDR效率的影响及作用分子机理。结果显示,PD0325901能显著提高PFFs的G2期和S期细胞群百分比,减少G1期细胞群比率,促进HDR修复因子的表达。在最适浓度250 nmol/L时,PD0325901使ssODN介导的GFP报告载体的修复效率提高了58.8%;同时使PFFs基因组位点和定点修饰效率分别提高了48.16%和17.64%。本研究表明,MEK抑制剂PD0325901能显著提高猪基因组ssODN介导的同源定向修复效率,为高效制备定点基因修饰动物模型提供了新思路。
MEK抑制剂;同源定向修复(HDR);PD0325901;基因编辑
传统转基因技术是将目的基因随机整合到基因组中并使之表达,无法控制转基因的整合位点,且伴随着效率低、表达稳定性差等问题,为转基因动物品系和育种品系的建立带来诸多不便。随着锌指核酸内切酶(zinc-finger endonuclease, ZFN)[1]、类转录激活因子效应物核酸酶(transcription activator-like effector nuclease, TALEN)[2]、规律成簇的间隔短回文重复(clustered regularly interspaced short palindromic repeats, CRISPR)[3],以及结构引导的核酸酶(structure- guided nuclease, SGN)[4]等新型基因编辑技术的出现,使动物基因组DNA突变的效率和准确性大大提高,推动了基因定向修饰动物的研究[5]。新型基因编辑技术可在基因组内高效产生双链断裂(double strand break, DSB),激活细胞中两种DNA修复路径——同源重组定向修复(homologous-directed repair, HDR)和非同源末端连接(nonhomologous end joining, NHEJ)。NHEJ无需同源修复模板,由NHEJ修复因子将DNA双链断裂的两端强行拼接起来,容易造成基因片段的缺失、突变或外源基因的插入等,是基因敲除的有效途径;HDR路径需要同源DNA模板,修复过程产生错误的概率较低,是定向突变和定点敲入(knock-in, KI)最为依赖的修复路径[6]。尽管运用新型基因编辑工具能够使细胞DNA发生DSB的效率和准确性极大的提高,但双链DNA模板修复效率相对较低,只有0.5%~20%左右,利用HDR进行高效的定点敲入具有较大的难度[3,7]。相比双链DNA模板,单链寡聚核苷酸(single-stranded oligodeoxyribonucleotide, ssODN)作为同源修复模板具有更高的定向修复效率[8~10]。目前,ssODN介导的DNA修复的具体通路仍然不是很清楚,但该途径也需要在DSB的断裂末端进行DNA末端剪切(DNA resection),因此与其他HDR通路具有相同的起始途径[11]。一般认为ssODN介导的同源定向修复途径也属于HDR的一种,有研究表明通过小分子化合物调控HDR通路,可以促进ssODN介导的定向修复效率。Maruyama等[12]使用小分子化合物Scr7(DNA连接酶Ⅳ抑制剂)将ssODN介导的定点整合效率提高了19倍;将Scr7直接注射至小鼠受精卵,使定点整合效率提高2倍。Ma等[13]使用VE-822 (Rad3相关激酶抑制剂)和AZD-7762 (检查点激酶CHEK1的特异性抑制剂)将ssODN介导的定点整合效率提高3倍。虽然这些小分子化合物可显著提高HDR效率[14],但都主要集中在对人和小鼠的研究,对猪的研究鲜有报道[15,16]。由于大部分小分子化合物对细胞和胚胎存在一定的毒害作用,剂量过大会损伤细胞或基因编辑胚[17],因此小分子化合物的使用剂量和新化合物的开发还需要继续优化。
RAS-RAF-MEK-ERK信号通路是调节细胞增殖、分化、代谢、凋亡和细胞周期等众多细胞生理过程的主干信号通路,丝裂原活化的细胞外信号调节激酶(mitogen-activated extracellular signal-regulated kinase, MEK)是该信号通路的重要组成部分[18]。PD0325901是一种选择性的非ATP竞争性MEK抑制剂,其与MEK结合会使MEK与ATP结合位点的构象发生变化,从而抑制MEK的激活[19,20]。Lin等[21]研究显示,使用PD0325901和CHIR99021 (GSK3β抑制剂)能消除ESC (embryonic stem cell)细胞系之间同源重组效率的差异,表明MEK信号通路可能参与细胞DNA的同源重组修复,但该信号通路是否参与体细胞同源重组目前还没有研究报道。
猪的生理学、解剖学和遗传学特征与人类非常相似,是研究人类疾病的重要动物模型。杜氏肌营养不良症(Duchenne muscular dystrophy, DMD)是一种X连锁隐性遗传病,由基因突变导致的人类肌肉萎缩无力,丧失独立行走能力为特点的疾病,提高猪该位点的定点编辑效率对制备人类DMD疾病猪模型具有重要意义[22]。此外,基因位点是猪基因组上最常用的安全港位点,外源性的基因定点插入该位点能高效稳定表达,同时不会影响其他内源基因的表达,因此常用该位点来构建基因编辑猪模型[23]。本研究以猪胎儿成纤维细胞(porcine fetal fibroblasts, PFFs)为研究对象,以和位点为靶点,利用MEK抑制剂PD0325901提高PFFs细胞中ssODN介导定向修复效率,为高效制备基因定向编辑猪模型提供重要参考信息。
1 材料与方法
1.1 材料
报告载体ssODN-mediated HDR reporter由本实验室前期构建[24]。该报告载体中(enhanced green fluorescent protein)序列中间插入一个终止密码子和一个HⅠ限制性内切酶位点,HⅠ用于线性化报告载体;该报告载体能与基因相应的同源模板重组,使表达绿色荧光信号,而没有发生同源定向修复的则被提前终止翻译。Cas9/sgRNA共表达质粒pX330 (Plasmid #42230)购自美国Addgene公司;PFFs细胞由温氏食品集团股份有限公司提供;MEK抑制剂PD0325901购自美国Selleck公司;引物和ssODN由深圳华大基因科技有限公司合成。
1.2 Cas9/sgRNA共表达质粒的构建
在CCtop CRISPR/Cas9网站(https://crispr.cos. uni-heidelberg.de/index.html)设计和基因的sgRNA[25,26],序列见表1。sgRNA引物混匀后置于95℃水中自然冷却至室温,使其形成双链DNA,克隆到pX330-U6-hSpCas9质粒的Ⅰ位点上。
1.3 PD0325901配制及细胞培养
取适量PD0325901溶解于DMSO溶剂,添加至完全培养基(DMEM细胞培养基+10%胎牛血清)分别配置成25 nmol/L、50 nmol/L、100 nmol/L和250 nmol/L的溶液备用,复苏后的PFF细胞培养至汇合度90% (10 cm板),进行后续实验。

表1 sgRNA序列信息
1.4 MTT法检测细胞活性
复苏后的PFF细胞培养至汇合度90% (10 cm板),用0.25%胰酶消化,调整细胞密度为103~105个/孔至96孔板,加入100 µL/孔不同浓度梯度的培养基溶液,每个梯度设置8个重复,培养48 h。加20 μL/孔MTT溶液(5 mg/mL,即0.5%MTT),培养4 h后去掉孔内培养液,加150 μL/孔二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的吸光值,对结果进行统计分析。
1.5 流式细胞术检测细胞周期
复苏后的PFF细胞培养至汇合度90% (10 cm板),用0.25%胰酶消化,铺至6孔板,加入2 mL/孔不同浓度梯度的培养基溶液,每个梯度设置3个重复,继续培养48 h。消化细胞至1.5 mL离心管并去掉培养基,每管加500 μL预冷的70%乙醇(−20℃),重悬,置于4℃固定过夜。隔天每管加500 μL碘化丙啶(propidium iodide, PI)染色液,充分振荡,4℃避光孵育30 min,使用流式细胞仪进行检测,利用软件Modifit 5.0进行统计分析。
1.6 HDR和NHEJ相关基因表达水平的检测
复苏后的PFF细胞培养至汇合度90% (10 cm板),用0.25%胰酶消化,铺至6孔板,加入2 mL/孔不同浓度梯度的培养基溶液,每个梯度设置3个重复,继续培养48 h。使用RNA抽提试剂盒抽提总RNA,反转录后对cDNA进行实时荧光定量PCR检测,分析NHEJ相关基因和HDR相关基因的表达水平。qRT-PCR反应条件:95℃预变性5 min;95℃变性15 s,60℃复性15 s,72℃延伸15 s,40个循环;溶解曲线95℃ 30 s;60℃ 30 s;95℃ 30 s。qRT-PCR引物见表2。
1.7 ssODN介导的HDR效率检测
复苏后的PFF细胞培养至汇合度90% (10 cm板),用0.25%胰酶消化。参考美国Thermo fisher公司的Lipofectamine® LTX & Plus Reagent protocol说明书,共转染8 μg/孔线性化的ssODN-mediate HDR reporter (HⅠ酶切)和1 μg/孔ssODN (序列见表3),每个处理设置3个重复。铺至6孔板培养24 h,加入2 mL/孔不同浓度梯度的培养基溶液,继续培养48 h,使用流式细胞术检测细胞荧光数的百分比。
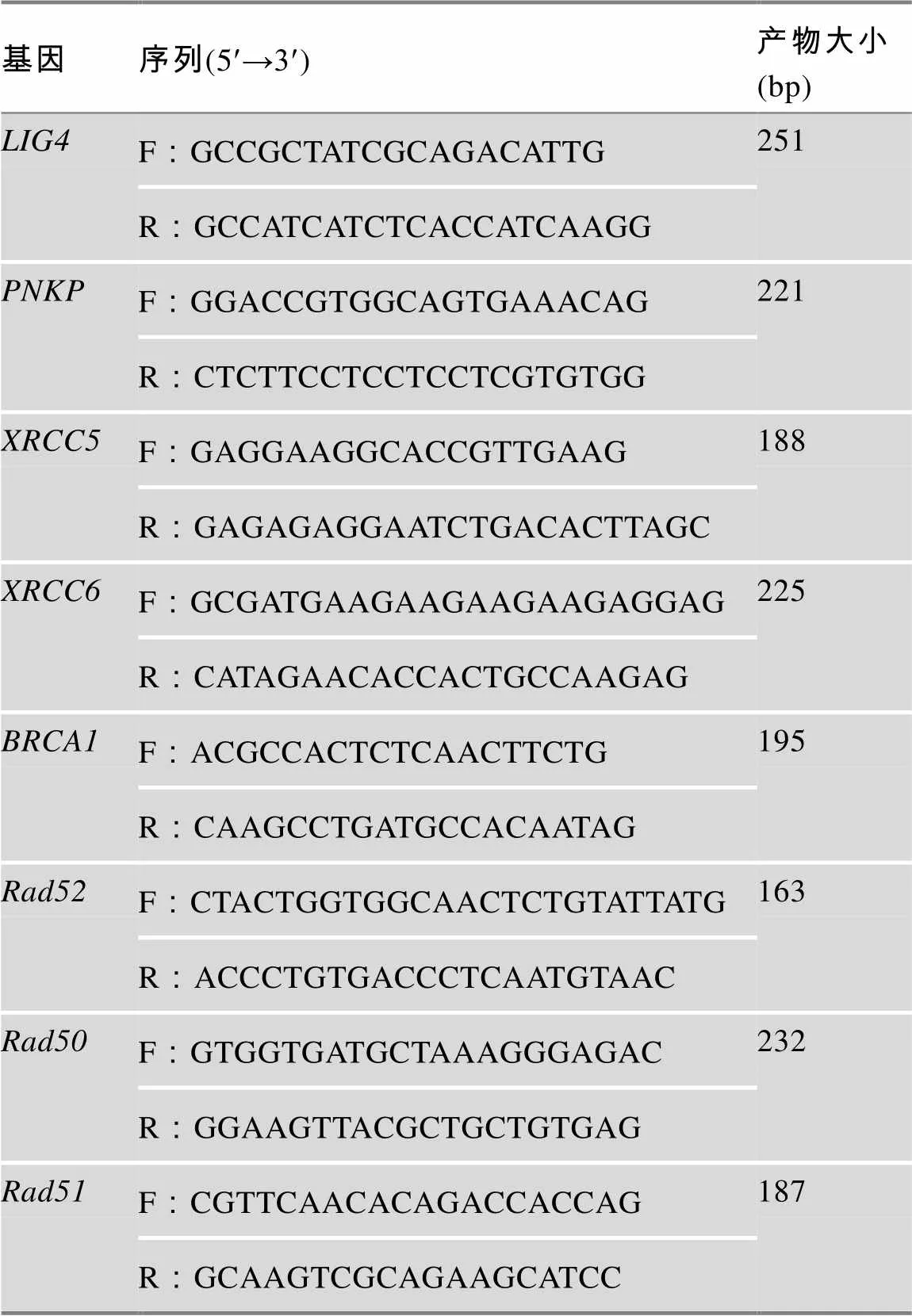
表2 qRT-PCR引物序列信息
复苏后的PFF细胞培养至汇合度90% (10 cm板),用0.25%胰酶消化,分别共转染8 μg/孔pX330--Cas9质粒和1 μg/孔ssODN、8 μg/孔pX330--Cas9质粒和1 μg/孔ssODN(序列见表3),每个处理设置3个重复。铺至6孔板培养24 h,加入2 mL/孔不同浓度梯度的培养基溶液,继续培养48 h。抽提细胞总DNA,PCR扩增目的基因序列(引物序列见表 4)。回收纯化后分别使用T7 EndoⅠ和dⅢ酶切,进行琼脂糖凝胶电泳分离,灰度扫描电泳条带,根据公式:同源定向修复效率=dⅢ条带灰度值/T7 EndoⅠ条带灰度值,计算同源定向修复效率。同时按照中美泰和生物技术有限公司clone smarter TA克隆试剂盒(产品编号C5853)说明书,对纯化的DNA进行TA克隆测序,计算同源定向修复效率。

表3 ssODN序列信息

表4 PCR引物序列
1.8 数据分析
采用 SPSS21 软件进行独立样品-test分析,分析每个处理组与对照组的差异,数据以 Mean ± SEM表示。*<0.05表示差异显著,**<0.01表示差异极显著。
2 结果与分析
2.1 PD0325901对PFFs细胞活性和细胞周期分布的影响
PFF细胞经25 nmol/L、50 nmol/L、100 nmol/L和250 nmol/L浓度的PD0325901处理,使用MTT方法检测细胞增殖活性。结果显示,25 nmol/L、50 nmol/L、100 nmol/L浓度下细胞活性比对照组分别提高了17.2%、5%、10.12%,经250 nmol/L PD0325901处理后,细胞活性比对照组下降了6.35%。低浓度(25 nmol/L)对细胞活性有促进作用,而高浓度(250 nmol/L)对细胞活性具有一定的抑制作用,但差异不显著(>0.05),表明这4个浓度梯度的PD0325901对细胞活性没有影响(图1A)。流式细胞术检测细胞结果显示,随着PD0325901浓度增加,处于G2期和S期的PFFs细胞群显著增加(<0.05),处于G1期细胞群显著减少(<0.05) (图1B),细胞表现一定程度的同步化。
2.2 PD0325901对DNA修复因子表达水平的影响
PFFs细胞经不同浓度的PD0325901处理后,进行qRT-PCR检测。结果显示,NHEJ相关修复基因(和)和HDR相关修复基因(、、和)表达量随PD0325901添加剂量的升高呈现不规律变化(图2)。在NHEJ通路中,25 nmol/L和250 nmol/L PD0325901对和表达具有上调作用;但对于基因表达,仅250 nmol/L剂量对其具有上调作用。在HDR通路中,不同浓度PD0325901对和表达都有上调作用,在250 nmol/L剂量下,和基因表达量提高近3倍(0.05),但二者表达量与PD0325901添加量不存在剂量依赖效应;然而对于和基因,100 nmol/L PD0325901对二者的表达呈现下调作用(<0.05),而经其他剂量处理后,和基因的表达量均表现不同程度的上调作用。
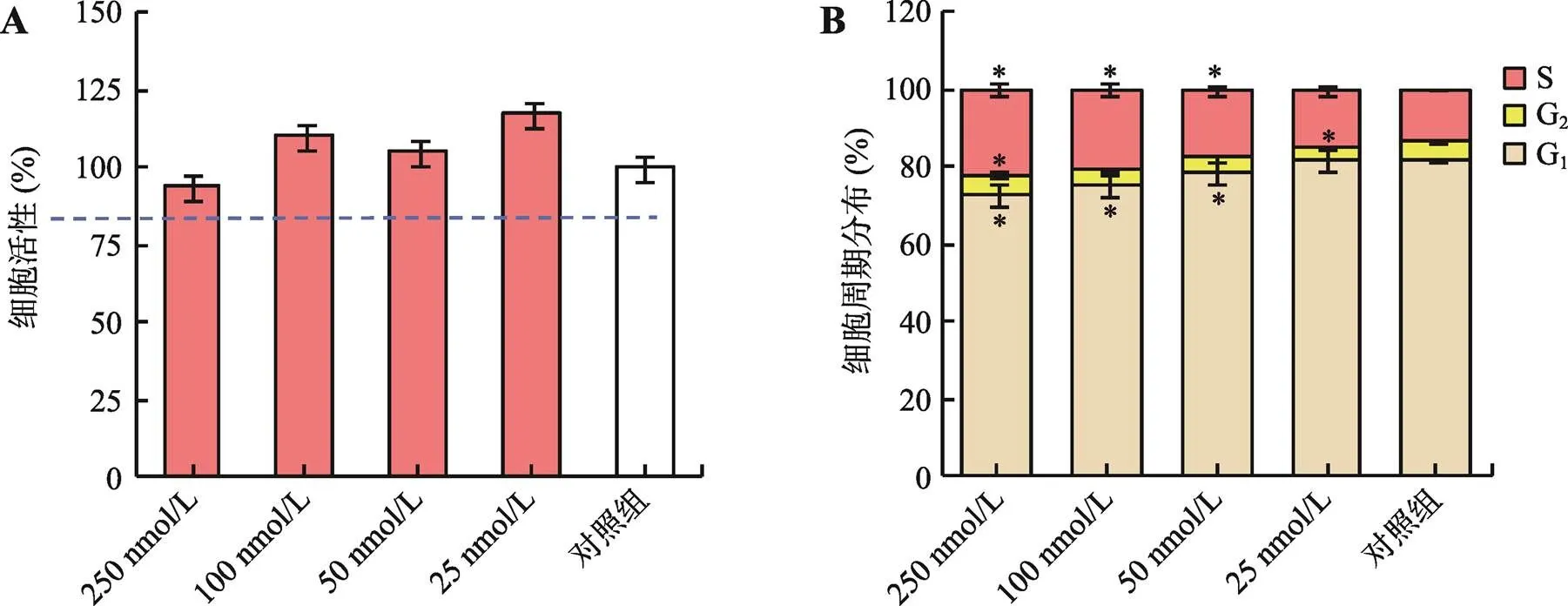
图1 PD0325901对细胞活性和细胞周期的影响
A:不同浓度的PD0325901对细胞活性的影响;B:不同浓度的PD0325901对细胞周期的影响。*<0.05,表示差异显著。
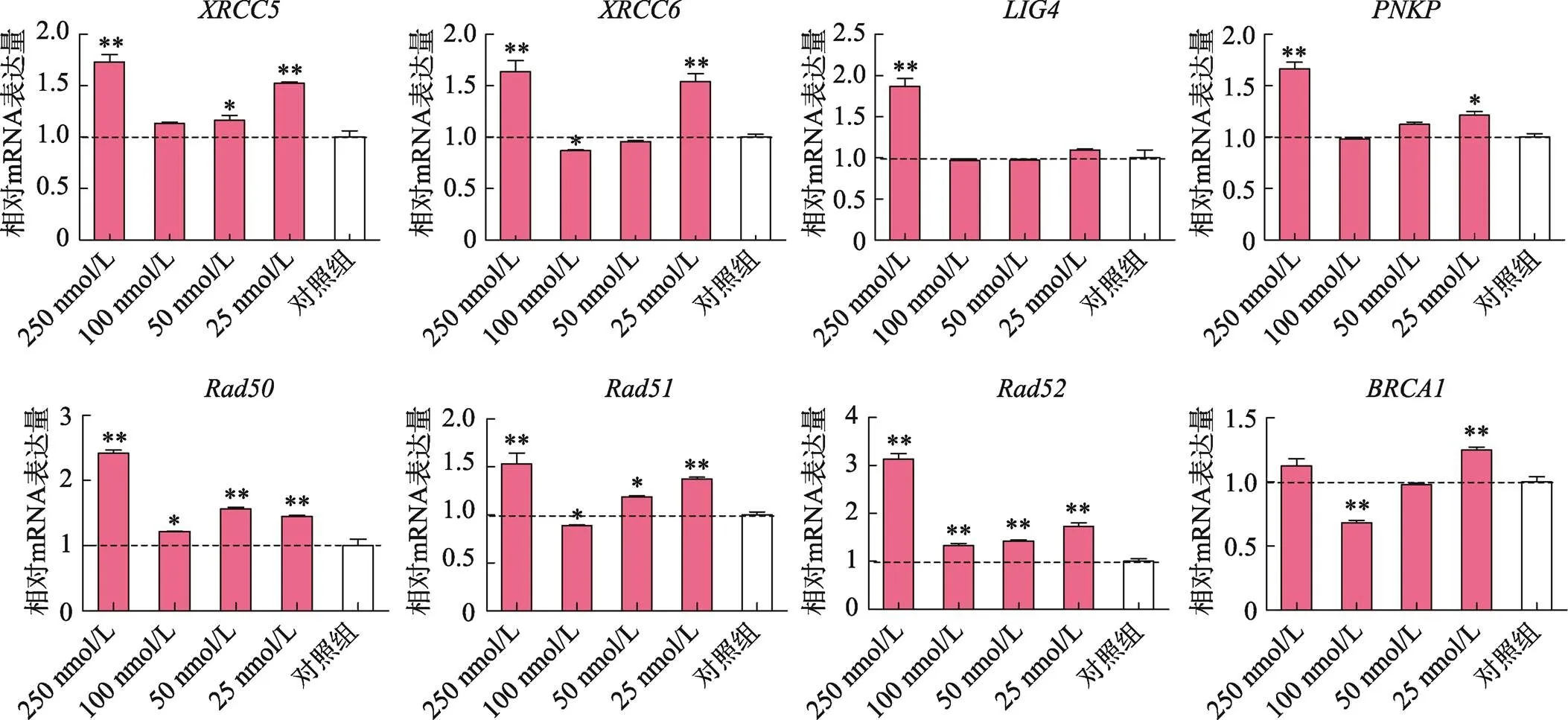
图2 PD0325901对DNA修复因子表达水平的影响
和为NHEJ相关修复基因;和为HDR相关修复基因。
*<0.05,表示差异显著,**<0.01表示差异极显著。
2.3 PD0325901对ssODN介导的HDR效率的影响
ssODN介导的HDR报告载体和相应ssODN共转染至PFF细胞,流式细胞术结果显示,25 nmol/L、50 nmol/L、100 nmol/L和250 nmol/L浓度PD0325901均能提高HDR效率,提高了32.3%~58.8% (0.05) (图3,A~C)。X330--Cas9质粒和相应的ssODN共转染至PFF细胞后,用dⅢ酶切方法评估基因位点编辑效率。结果显示,25 nmol/L、50 nmol/L、100 nmol/L和250 nmol/L浓度PD0325901均能提高HDR效率,达2.6%~37.1% (图3,E和F),并表现明显的剂量依赖效应。共转染pX330--Cas9质粒和相应的ssODN,用dⅢ酶切方法评估基因编辑效率。结果显示,25 nmol/L、50 nmol/L和250 nmol/L PD0325901促进位点HDR效率,分别提高了4.8%、0.8%和9.6% (图3,H和I),但100 nmol/L剂量时,位点HDR效率略微下降。进一步利用TA克隆和测序验证,结果显示,在250 nmol/L PD0325901剂量下和基因位点的HDR效率分别提高了48.16%和17.64% (表5;图3,J和K),与dⅢ酶切结果基本一致。
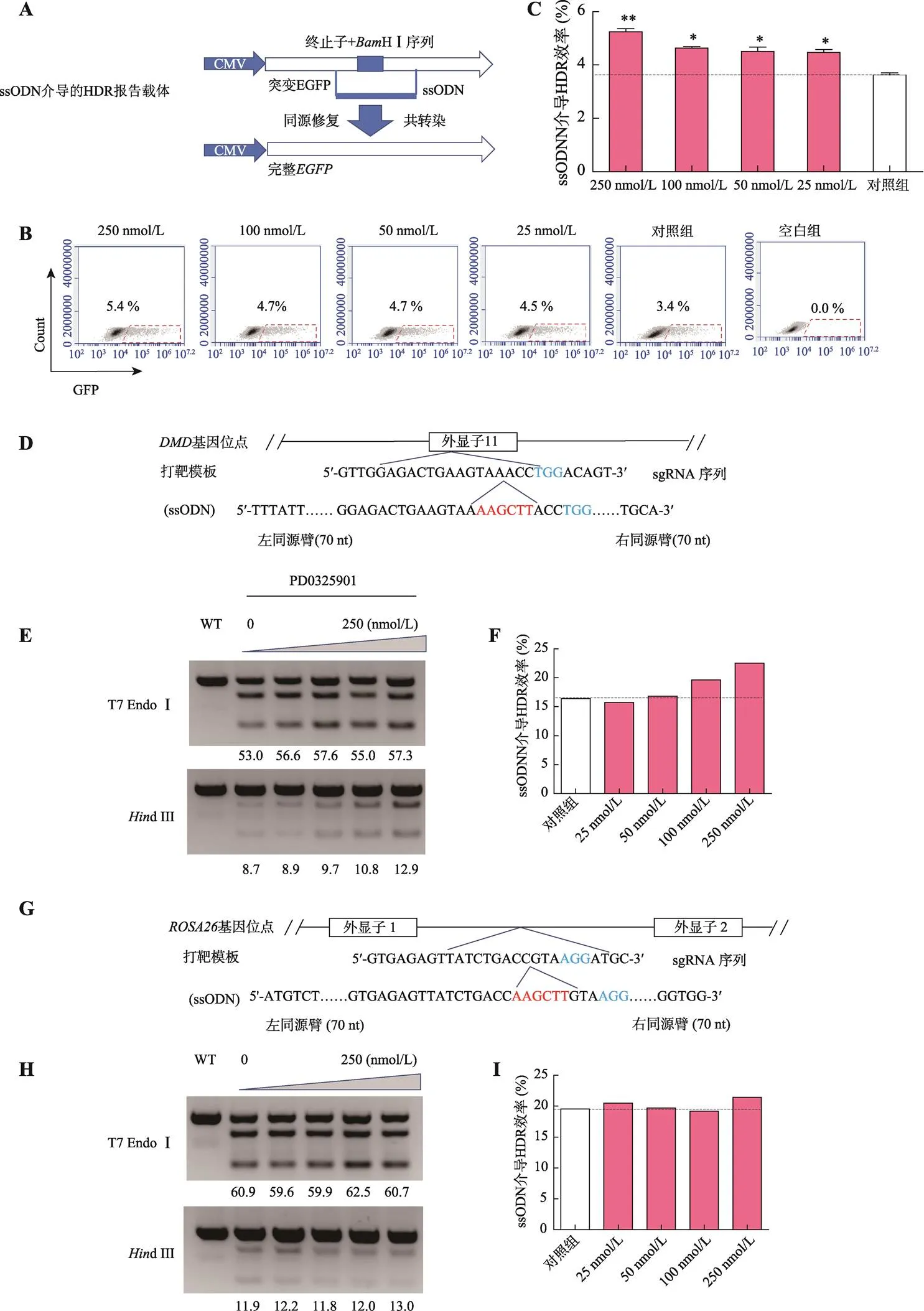
A:ssODN介导的HDR报告载体修复模式图;B:报告载体HDR修复效率的流式细胞术检测结果(用EGFP荧光细胞百分比表示HDR效率);C:PD032590处理组间ssODN介导报告载体HDR修复的效率比较(=3)。*<0.05,表示差异显著,**<0.01表示差异极显著;D和G:ssODN介导dⅢ识别序列定点整合至猪基因组模式图。D图为基因位点,G图为基因位点;E和H:核酸内切酶酶切法检测位点(图E)和位点(图H)编辑效率电泳结果。T7 EndoⅠ为T7核酸内切酶Ⅰ酶切电泳图,图上的数字表示灰度扫描数值,代表目标位点发生DSB的效率;dⅢ为dⅢ限制性核酸内切酶酶切电泳图,图上数字表示灰度扫描数值,代表目标位点dⅢ定点整合效率;F和I:分别为图E和图H灰度扫描值的柱状图展示结果(HDR效率=dⅢ灰度扫描值/T7 EndoⅠ灰度扫描值,=3);J和K:分别为定点整合dⅢ识别序列至(图J)和(图K)基因位点的测序峰图。
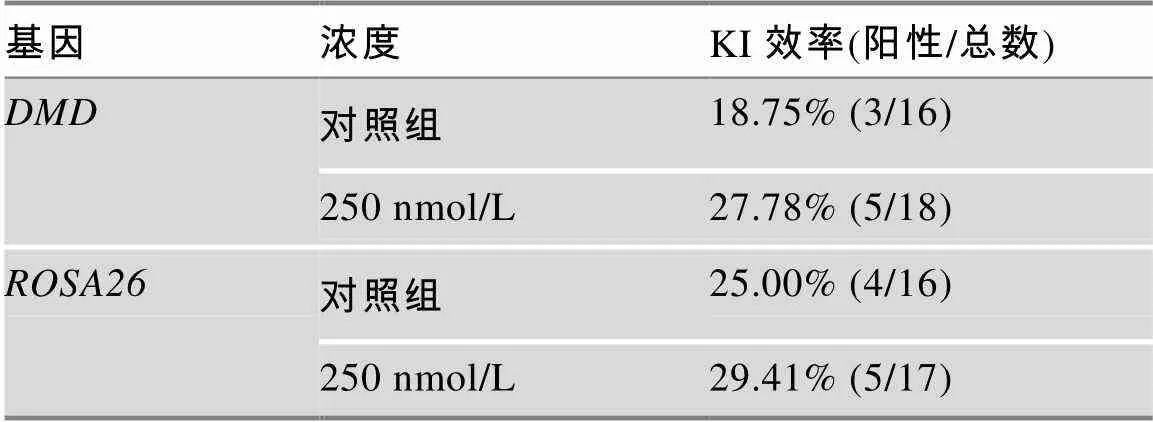
表5 TA克隆数据统计
3 讨论
细胞所在的分裂期会显著影响DNA修复双链断裂途径的选择,在修复过程中,NHEJ可以发生在细胞分裂的任一时期,而HDR主要发生在S和G2期,李国玲等[17]通过同步化细胞周期至S和G2期,成功提高了基因组定点修饰的效率。Yang等[27]在人多能干细胞中添加ABT-751化合物,使细胞停滞在G2期,将2~5 kb片段整合至人基因组5个不同区域的效率提高了3~6倍;Lin等[28]添加aphidicolin和nocodazole,使人胚胎干细胞、成纤维细胞和293T细胞停滞在G2期,显著提高ssODN介导的定向修复效率。本研究结果显示,随着PD0325901浓度增加,处于G2期和S期的PFFs细胞群显著增加,处于G1期细胞群显著减少,细胞表现一定程度的同步化,与前人的报道结果不一致[29~31]。Wang等[30]研究表明,RAS-RAF-MEK-ERK信号转导通路通过激活MEK-ERK,促进细胞周期素D1 (cyclin D1)的表达及其与细胞周期依赖性激酶4 (cyclin-dependent kinase 4, Cdk4)的结合来调控细胞周期,促进细胞进入S期。Ayunadirah等[31]研究发现添加PD0325901显著降低了MDA-MB-231乳腺癌细胞的增殖,同时发现细胞周期停滞在G1期。本研究用MEK抑制剂PD0325901处理PFFs后,检测到S期细胞数量反而显著增加,推测可能是由于MEK通路受到抑制后影响其他平行信号通路调控细胞周期,或细胞种类差异导致结果不一致,但具体机理尚不明确。已有的研究表明,添加小分子化合物PD0325901使细胞同步至S期和G2期,其可能有利于提高定点整合效率[17,32~34]。本研究结果也显示,250 nmol/L浓度PD0325901能显著提高报告载体、和位点上ssODN介导的同源修复效率,表明将细胞周期同步化在S和G2期可以提高细胞定向修复效率。
NHEJ和HDR通路的激活需要许多关键因子的参与,它们能调节修复途径的选择,并在修复过程中发挥不可替代的重要作用[17,35,36]。本研究结果显示,不同浓度的PD0325901抑制剂均能提高报告载体、和位点上ssODN介导的同源修复效率,并表现明显剂量依赖性。本研究结果推测,PD0325901上调和的表达可能是提高同源重组效率的关键,但PD0325901添加剂量与上述因子表达并没有剂量依赖性关系,因而,二者间的相关性但仍需进一步研究。另外,PD0325901对NHEJ关键因子的表达也有不同程度的上调作用,尤其是25 nmol/L和250 nmol/L浓度影响较大,呈“U型效应”。在前人研究中也发现类似的现象,如Li等[17]在猪胎儿成纤维细胞中分别添加L755507、Resveratrol和Scr7 3种小分子抑制剂,NHEJ和HDR关键因子的表达水平出现了类似的“U型效应”。Kachhap等[37]在DU-145和LNCaP细胞中添加不同浓度梯度的丙戊酸(valproic acid, VPA),基因的表达水平也同样出现类似的“U型效应”。产生“U型效应”的原因可能是小分子浓度过高时,出现负反馈调节,其具体调控机理还有待进一步研究。同时,本研究利用PD0325901提高ssODN介导的同源修复效率,证实了MEK抑制剂PD0325901对猪体细胞HDR效率具有促进作用,与前人报道PD0325901可提高ESC定点整合效率结果一致[15]。本研究通过向猪成纤维细胞培养基中添加MEK抑制剂使EGFP报告载体的同源修复效率显著提高了58.8%,使和26位点的同源重组效率分别提高了48.16%和17.64%,并表现较低的细胞毒性,这对提高PFFs细胞定向编辑效率及基因定向编辑猪的研究具有重要价值和意义。
[1] Kim YG, Cha J, Chandrasegaran S. Hybrid restriction enzymes: zinc finger fusions toI cleavage domain., 1996, 93(3): 1156–1160.
[2] Boch J, Scholze H, Schornack S, Landgraf A, Hahn S, Kay S, Lahaye T, Nickstadt A, Bonas U. Breaking the code of DNA binding specificity of TAL-typeⅢeffectors., 2009, 326(5959): 1509–1512.
[3] Hsu PD, Lander ES, Zhang F. Development and applications of CRISPR-Cas9 for genome engineering., 2014, 157(6): 1262–1278.
[4] Xu S, Cao S, Zou B, Yue Y, Gu C, Chen X, Wang P, Dong X, Xiang Z, Li K, Zhu M, Zhao Q, Zhou G. An alternative novel tool for DNA editing without target sequence limitation: the structure-guided nuclease., 2016, 17(1): 186.
[5] Huang YQ, Li GL, Yang HQ, Wu ZF. Progress and application of genome-edited pigs in biomedical research., 2018, 40(8): 632–646.黄耀强, 李国玲, 杨化强, 吴珍芳. 基因编辑猪在生物医学研究中的应用. 遗传, 2018, 40(8): 632–646.
[6] Difilippantonio MJ, Zhu J, Chen HT, Meffre E, Nussenzweig MC, Max EE, Ried T, Nussenzweig A. DNA repair protein Ku80 suppresses chromosomal aberrations and malignant transformation., 2000, 404(6777): 510–514.
[7] Capecchi MR. Altering the genome by homologous recombination., 1989, 244(4910): 1288–1292.
[8] Chen F, Pruett-Miller SM, Huang Y, Gjoka M, Duda K, Taunton J, Collingwood TN, Frodin M, Davis G. High- frequency genome editing using ssDNA oligonucleotides with zinc-finger nucleases., 2011, 8(9): 753–755.
[9] Shen B, Zhang X, Du Y, Wang J, Gong J, Zhang X, Tate PH, Li H, Huang X, Zhang W. Efficient knockin mouse generation by ssDNA oligonucleotides and zinc-finger nuclease assisted homologous recombination in zygotes., 2013, 8(10): e77696.
[10] Hu Z, Shi Z, Guo X, Jiang B, Wang G, Luo D, Chen Y, Zhu YS. Ligase IV inhibitor SCR7 enhances gene editing directed by CRISPR-Cas9 and ssODN in human cancer cells., 2018, 8(1): 12.
[11] Richardson CD, Kazane KR, Feng SJ, Zelin E, Bray NL, Schäfer AJ, Floor SN, Corn JE. CRISPR–Cas9 genome editing in human cells occurs via the Fanconi anemia pathway., 2018, 50(8): 1132–1139.
[12] Maruyama T, Dougan SK, Truttmann MC, Bilate AM, Ingram JR, Ploegh HL. Increasing the efficiency of precise genome editing with CRISPR-Cas9 by inhibition of nonhomologous end joining., 2015, 33(5): 538–542.
[13] Ma X, Chen X, Jin Y, Ge W, Wang W, Kong L, Ji J, Guo X, Huang J, Feng XH, Fu J, Zhu S. Small molecules promote CRISPR-Cpf1-mediated genome editing in human pluripotent stem cells., 2018, 9(1): 1303.
[14] Chu VT, Weber T, Wefers B, Wurst W, Sander S, Rajewsky K, Kühn R. Increasing the efficiency of homology- directed repair for CRISPR-Cas9-induced precise gene editing in mammalian cells., 2015, 33(5): 543–548.
[15] Li G, Zhang X, Zhong C, Mo J, Quan R, Yang J, Liu D, Li Z, Yang H, Wu Z. Small molecules enhance CRISPR/ Cas9-mediated homology-directed genome editing in primary cells., 2017, 7(1): 8943.
[16] Gerlach M, Kraft T, Brenner B, Petersen B, Niemann H, Montag J. Efficient Knock-in of a point mutation in porcine fibroblasts using the CRISPR/Cas9-GMNN fusion gene., 2018, 9(6): 296.
[17] Li GL, Zhong CL, Mo JX, Quan R, Wu ZF, Li ZC, Yang HQ, Zhang XW. Advances in site-specific integration of transgene in animal genome., 2017, 39(2): 98–109.李国玲, 钟翠丽, 莫健新, 全绒, 吴珍芳, 李紫聪, 杨化强, 张献伟. 动物基因组定点整合转基因技术研究进展. 遗传, 2017, 39(2): 98–109.
[18] Hao P Q, An S, Yang Y, Liu Y, Guo XX, Xu TR. The progress on MEK kinases and their inhibitors., 2015, 37(10): 1425–1431.郝佩琪, 安输, 杨洋, 刘莹, 郭晓汐, 徐天瑞. MEK激酶及其抑制剂的研究进展. 中国细胞生物学学报, 2015, 37(10): 1425–1431.
[19] Neuzillet C, Tijeras-Raballand A, de Mestier L, Cros J, Faivre S, Raymond E. MEK in cancer and cancer therapy., 2014, 141(2): 160–171.
[20] Zhao Y, Adjei AA. The clinical development of MEK inhibitors., 2014, 11(7): 385–400.
[21] Lin Z, Zhang Y, Gao T, Wang L, Zhang Q, Zhou J, Zhao J. Homologous recombination efficiency enhanced by inhibition of MEK and GSK3β., 2014, 52(11): 889–896.
[22] Roberts RG. Dystrophin, its gene, and the dystrophinopathies., 1995, 33: 177–231.
[23] Li X, Yang Y, Bu L, Guo X, Tang C, Song J, Fan N, Zhao B, Ouyang Z, Liu Z, Zhao Y, Yi X, Quan L, Liu S, Yang Z, Ouyang H, Chen YE, Wang Z, Lai L. Rosa26-targeted swine models for stable gene over-expression and Cre-mediated lineage tracing., 2014, 24(4): 501–504.
[24] Li G, Liu D, Zhang X, Quan R, Zhong C, Mo J, Huang Y, Wang H, Ruan X, Xu Z, Zheng E, Gu T, Hong L, Li Z, Wu Z, Yang H. Suppressing Ku70/Ku80 expression elevates homology-directed repair efficiency in primary fibroblasts., 2018, 99: 154–160.
[25] Stemmer M, Thumberger T, Del Sol Keyer M, Wittbrodt J, Mateo JL. CCTop: an intuitive, flexible and reliable CRISPR/Cas9 target prediction tool., 2015, 10(4): e0124633.
[26] Labuhn M, Adams FF, Ng M, Knoess S, Schambach A, Charpentier EM, Schwarzer A, Mateo JL, Klusmann JH, Heckl D. Refined sgRNA efficacy prediction improves large- and small-scale CRISPR–Cas9 applications., 2018, 46(3): 1375–1385.
[27] Yang D, Scavuzzo MA, Chmielowiec J, Sharp R, Bajic A, Borowiak M. Enrichment of G2/M cell cycle phase in human pluripotent stem cells enhances HDR-mediated gene repair with customizable endonucleases., 2016, 6: 21264.
[28] Lin S, Staahl BT, Alla RK, Doudna JA. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery., 2014, 3: e04766.
[29] Weber JD, Raben DM, Phillips PJ, Baldassare JJ. Sustained activation of extracellular-signal-regulated kinase 1 (ERK1) is required for the continued expression of cyclin D1 in G1 phase., 1997, 326(Pt 1): 61–68.
[30] Wang S, Wang S, Zhu XG, Zhang JQ, Qiao XM, Ye YJ, Liang B, Ma XT, Cui ZR. Significance of MEK-ERK cascade in the development of human breast carcinoma., 2002, 40(3): 171–174.王殊, 王杉, 祝学光, 张嘉庆, 乔新民, 叶颖江, 梁斌, 马向涛, 崔志荣. 细胞外信号调节激酶及其上游激酶在人乳腺癌发生发展中的意义. 中华外科杂志, 2002, 40(3): 171–174.
[31] Ayub A, Yip WK, Seow HF. Dual treatments targeting IGF-1R, PI3K, mTORC or MEK synergize to inhibit cell growth, induce apoptosis, and arrest cell cycle at G1 phase in MDA-MB-231 cell line., 2015, 75: 40–50.
[32] Chiruvella KK, Liang Z, Wilson TE. Repair of double- strand breaks by end joining., 2013, 5(5): a012757.
[33] Karanam K, Kafri R, Loewer A, Lahav G. Quantitative live cell imaging reveals a gradual shift between DNA repair mechanisms and a maximal use of HR in mid S phase., 2012, 47(2): 320–329.
[34] Branzei D, Foiani M. Regulation of DNA repair throughout the cell cycle., 2008, 9(4): 297–308.
[35] Ceccaldi R, Rondinelli B, D'Andrea AD. Repair pathway choices and consequences at the Double-Strand break., 2015, 26(1): 52–64.
[36] Li X, Heyer WD. Homologous recombination in DNA repair and DNA damage tolerance., 2008, 18(1): 99–113.
[37] Kachhap SK, Rosmus N, Collis SJ, Kortenhorst MS, Wissing MD, Hedayati M, Shabbeer S, Mendonca J, Deangelis J, Marchionni L, Lin J, Höti N, Nortier JW, DeWeese TL, Hammers H, Carducci MA. Downregulation of homologous recombination DNA repair genes by HDAC inhibition in prostate cancer is mediated through the E2F1 transcription factor., 2010, 5(6): e11208.
MEK inhibitor PD0325901 significantly boosts ssODN-mediated HDR efficiency in porcine fetal fibroblasts
Hao Ou1, Guoling Li1, Haoqiang Wang1, Guangyan Huang1, Gengyuan Cai1,2, Zicong Li1, Zhenfang Wu1,2, Xianwei Zhang1,2
There are two major pathways, homology-directed repair (HDR) and nonhomologous end joining (NHEJ), involved in double-strand break (DSB) repair.Single-stranded oligodeoxyribonucleotide (ssODN)-mediated homologous recombination repair is commonly used for animal site-directed genome editing, with great scientific and practical value. To improve ssODN-mediated HDR efficiency in the pig genome, we investigated the effect and molecular mechanism of mitogen-activated extracellular signal-regulated kinase (MEK) inhibitor PD0325901 on the HDR efficiency in porcine fetal fibroblasts (PFFs). The results showed that PD0325901 obviously increased the percentage of G2and S phase cell populations and reduced the cell population ratio in the G1phase of PFFs, and promoted the expression of HDR repair factor. At the optimal concentration of 250 nmol/L, PD0325901 increased the repair efficiency of ssODN-mediated GFP reporter vector by 58.8% and the directed editing efficiency of PFFandlocus by 48.16% and 17.64%, respectively. The results show that MEK inhibitor PD0325901 significantly promotes the efficiency of ssODN-mediated homologous-directed repair in the porcine genome, thus offering a new idea to generate genetically modified pigs more effectively.
MEK inhibitor; homologous-directed repair (HDR); PD0325901; gene editing
2018-10-29;
2019-03-02
国家自然科学基金项目(编号:31772555)和国家转基因重大专项(编号:2016ZX08006002)资助[Supported by the National Natural Science Foundation of China (No.31772555) and the National Transgenic Major Projects (No.2016ZX08006002)]
欧浩,硕士,专业方向:动物遗传育种。E-mail: 719367112@qq.com李国玲,博士,研究方向:基因编辑与遗传育种。E-mail: 792268184@qq.com欧浩和李国玲并列第一作者。
张献伟,博士,硕士生导师,研究方向:动物遗传育种。E-mail: zxianw@163.com
10.16288/j.yczz.18-294
2019/3/26 9:24:44
URI: http://kns.cnki.net/kcms/detail/11.1913.R.20190326.0924.003.html
(责任编委: 任军)

