新型牙本质粘接剂抗菌性能的初步研究
, ,,
充填体边缘的菌斑产酸引起继发龋,是充填材料脱落的主要原因[1]。复合树脂具有优良的美学效果,简便的临床操作过程,近年来广泛应用于修复牙体缺损[2]。研究表明,复合树脂材料表面较其他修复材料更容易堆积菌斑[3]。复合树脂通过牙本质粘接剂粘接到牙体组织,理想的牙本质粘接剂能够在复合树脂的边缘起到抗菌作用,防止继发龋的发生[4]。近年来,季铵盐类单体被添加到牙本质粘接剂中,使粘接剂具有较强的抗菌性能[5]。
唾液蛋白吸附于牙齿或者充填体表面形成获得性膜,是形成菌斑的先决条件[6]。因此,如果牙本质粘接剂具有抗蛋白附着功能,则可以有效地限制菌斑的形成,降低继发龋的发生。甲基丙烯酰氧乙基磷酸胆碱(2-methacryloyloxyethyl phosphorylcholine,MPC)是一类常见的具有抗蛋白附着和细菌粘附功能的生物复合物,已经被广泛应用于临床[7-9]。有研究将MPC和一种新型季铵盐抗菌单体甲基丙烯酸十六烷基二甲铵(dimethylaminohexadecyl methacrylate,DMAHDM)添加到牙本质粘接剂中使其具有很强的抗蛋白附着和抗菌功能[10]。
研发具有再矿化功能的牙本质粘接剂是对抗继发龋发生的另一个有效途径,无定形磷酸钙纳米颗粒(nanoparticles of amorphous calcium phosphate,NACP)是通过雾化干燥技术合成的,NACP释放的钙、磷离子与传统的磷酸钙复合体相似,但具有更优的机械强度[11-12]。本研究将MPC、DMAHDM和NACP添加到牙本质粘接剂中,从而研发出一种具有抗蛋白附着、抗菌和再矿化作用的多功能牙本质粘接剂,并对其牙本质粘接强度、抗蛋白附着和抗菌性能进行评价。
1 材料和方法
1.1 含有MPC、DMAHDM和NACP的粘接系统的制备 商品名为SBMP(Scotchbond Multi-Purpose)牙本质粘接剂(美国3M公司)作为载体粘接系统,来测试添加MPC、DMAHDM和NACP的效果。根据前期研究结果,MPC(美国Sigma-Aldrich公司)粉末以质量分数为7.5%的比例添加到SBMP底胶和粘结剂中[10]。
使用改良门舒特金法制备DMAHDM,由叔胺基与有机卤化物发生反应[13]。根据前期研究结果,DMAHDM以质量分数为5%的比例添加到SBMP底胶和粘结剂中[10]。
使用雾化干燥技术合成NACP。将碳酸钙(美国Fisher公司)和无水磷酸氢钙(美国Baker Chemical公司)溶解到乙酸中,以获得终浓度分别为8 mmol/L和5.333 mmol/L的钙离子和磷离子,Ca/P摩尔比为1.5,与无定型磷酸钙(amorphous calcium phosphate,ACP)中一样。将此溶液喷入到加热的喷雾干燥装置中,通过静电沉淀器收集干燥的ACP纳米颗粒(美国Air Quality公司),获得平均粒径为116 nm的粉末状NACP[11]。NACP添加到底胶中会降低粘接强度,因此NACP以质量分数为20%的比例添加到SBMP粘结剂中[12]。未添加MPC、DMAHDM和NACP的SBMP作为对照组。
1.2 牙本质剪切粘接强度的测试 经患者知情同意,签署知情同意书。人无龋第三磨牙用金刚钻锯(美国Isomet公司)垂直地削掉牙冠釉质,露出牙本质表面。用粒度320目的金刚砂纸沿与牙长轴垂直的方向磨掉所有牙冠釉质[13]。牙本质表面用含37%磷酸的凝胶酸蚀15 s,用蒸馏水冲洗15 s,用刷头将底胶涂在牙本质表面上,并擦拭15 s,再用刷头将粘接剂涂在底胶表面上,并擦拭15 s,用流动空气吹干2~3 s,然后光固化10 s。将直径为4 mm,厚度为1.5 mm的不锈钢环压在粘接剂处理过的牙本质表面,环的中央孔中填入复合树脂(美国Caulk/Dentsply公司),光固化60 s[14]。试件在37 ℃蒸馏水中储存24 h,用万能材料试验机测试牙本质剪切粘接强度SD[12],刀头刃端与电脑控制的万能材料测试机(美国MTS公司)相连,并保持与复合树脂-牙本质粘接界面平行,以0.5 mm/min的速度加力直到粘接面断裂。SD的计算公式为:SD=4P/(πd2),其中P为断裂时的载荷,d是复合树脂的直径(即中央孔直径)。每组10个试件。
1.3 抗蛋白附着性能的测试 对于抗蛋白和抗菌性能的测试,试件的制备应用96孔板的封盖,先将10 μL的底胶涂抹于底部,吹干后将20 μL的粘接剂涂抹在底胶上,用赛璐珞条形成光滑表面,光固化30 s,最终形成直径8 mm、厚度0.5 mm的圆片形试件[10,13]。将试件浸入蒸馏水,搅拌1 h,以除去任何未固化的单体。所有试件干燥并用环氧乙烷消毒(型号Anprolene AN 74i,美国Andersen Products公司)。
双辛丁酸法测试试件表面蛋白的附着量。每个试件在磷酸盐缓冲液(phosphate buffered saline,PBS)中浸泡2 h,然后再将试件浸泡在浓度为4.5 g/L的牛血清蛋白溶液中(美国Sigma-Aldrich公司),在37 ℃条件下浸泡2 h。将试件在PBS中漂洗5 min,然后将试件放入含有1%十二烷基硫酸钠的PBS溶液中,超声振荡20 min[9-10]。应用蛋白质分析试剂盒(美国Fisher Scientific公司)测试PBS溶液中的蛋白质浓度,从而计算附着在试件表面的蛋白质的量。每组10个试件。
1.4 人唾液的收集 经患者知情同意,签署知情同意书。人唾液被证明是体外培养菌斑生物膜的理想来源,它能保持体内牙菌斑的复杂性和异质性[15]。选择10名拥有天然牙列,无活动性龋病或牙周病的健康成年人作为唾液的捐赠者。捐赠人在过去的3个月内没有使用过抗生素,捐赠唾液前24 h不刷牙,并在捐赠唾液前至少2 h禁饮食。捐赠者在咀嚼封口膜的过程中收集分泌的刺激性唾液,并置于冰上。从每位捐赠者的唾液样本中取出等量的唾液混合,混合的唾液在无菌甘油中稀释至终浓度为70%,储存于-80 ℃冰箱[16],用于体外培养人全菌菌斑生物膜。
1.5 菌斑生物膜的形成和活/死细菌染色 将上述混合唾液以1∶50的比例稀释于McBain培养基中作为人全菌生物膜的接种液。McBain培养基中含有粘蛋白,2.5 g/L;细菌蛋白胨,2.0 g/L;胰蛋白胨,2.0 g/L;酵母提取物,1.0 g/L;氯化钠,0.35 g/L;氯化钾,0.2 g/L;氯化钙,0.2 g/L;盐酸半胱氨酸,0.1 g/L;血红素,0.001 g/L;维生素K1,0.000 2 g/L,材料均购自美国Sigma-Aldrich公司,pH值调整为7[17]。将接种液在37 ℃下,含5%CO2的培养箱中培养24 h。24孔培养板每个孔放入一个试件,各孔中加入1.5 mL接种液,在37 ℃含5%CO2的培养箱中培养8 h。然后将试件转移至新的24孔板中,用新鲜McBain培养基继续培养。16 h后,将试件转移至新的24孔板中用新鲜McBain培养基继续培养24 h,最终在试件表面形成人全菌生物膜[10,12-13]。
将培养2 d的试件在PBS中轻柔漂洗3次,用活/死细菌生存力试剂盒(美国Molecular Probes公司)进行染色[10,12]。Syto 9将活细菌染色,产生绿色荧光;细胞膜受损的细菌会被碘化丙啶染色,产生红色荧光;接近或重叠的死/活细菌会显示出橙黄色。使用荧光显微镜(型号TE2000-S,日本Nikon公司)观察染色的生物膜。每组6个试件,每个试件随机选取3幅图,每组试件一共18幅图。
1.6 生物膜代谢活力的检测 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, MTT]法是一种比色分析法,测量黄色的四唑MTT被酶催化还原为紫色的甲臜。将培养2 d的试件转移到新的24孔板里,然后将1 mL的MTT染料加入到每个孔中,并在37 ℃下,5%CO2的培养箱中培养1 h。然后将试件转移到新的24孔板中,加入1 mL二甲亚砜中,并在室温下避光温和搅拌,培养20 min。混合均匀后,从每个孔中吸取200 μL的二甲亚砜溶液转移到96孔板中,用酶标仪(型号SpectraMax M5,美国Molecular Devices公司)在540 nm处测量吸光度。吸光度越高,表明甲臜浓度越高,意味着试件表面的生物膜代谢活性越高[10,12]。
1.7 生物膜乳酸产量的测定 将培养2 d的试件在半胱氨酸蛋白胨水中漂洗,以去除疏松的细菌。然后将试件转移到新的24孔板,每孔内加入含0.2%蔗糖的缓冲蛋白胨水溶液。将其在37 ℃下,5%CO2的培养箱中培养3 h,使生物膜产乳酸。然后收集缓冲蛋白胨水溶液,用酶标仪在340 nm处测量吸光度,做乳酸产量分析[10,12]。每组10个试件。
2 结果
2.1 2组间的牙本质剪切粘接强度和蛋白附着量 实验组和对照组间的牙本质剪切粘接强度比较差异无统计学意义(P=0.426)。实验组的蛋白附着量显著低于对照组(P=0.000),大约是对照组的5%,表明实验组具有较强的抗蛋白附着功能。表1。
2.2 2组试件表面菌斑的代谢活性和乳酸产量 实验组试件表面菌斑的代谢活性和乳酸产量显著低于对照组(P=0.000),大约是对照组的5%,表明实验组具有较强的抗菌性能。表2。

表1 粘接强度和蛋白附着量(n=10)
注:与对照组比较,*P<0.05

表2 菌斑代谢活性和乳酸产量(n=10)
注:与对照组比较,*P<0.05
2.3 2组试件表面细菌粘附的定性比较 对照组试件表面覆盖大量的活细菌,呈绿色荧光。实验组试件表面的细菌粘附量明显少于对照组,且主要为死细菌,呈红/橙色荧光。图1。
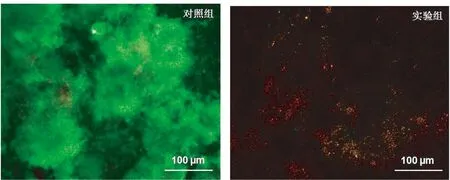
图1 菌斑生物膜活/死细菌染色图(n=6)
3 讨论
本研究将MPC、DMAHDM和NACP添加到牙本质粘接剂中,并对其粘接强度,抗蛋白附着和抗菌效果进行了研究。结果表明,与商品化的粘接剂相比,实验组在不影响牙本质粘接强度的前提下,具有明显地抗蛋白附着和抗菌功能,因此含有MPC、DMAHDM、NACP的粘接系统能够在牙体-修复体边缘,有效减少蛋白质的附着和细菌的粘附,从而抑制菌斑形成。
MPC具有较强的抗蛋白附着和抗细菌粘附的功能,其原因是由于MPC具有很强的亲水性,在含水的MPC聚合物中有大量的游离水,而无结合水。结合水会导致蛋白质的附着,而游离水可以有效地抵抗蛋白质的附着[7-8]。本研究结果显示,含有MPC的牙本质粘接剂具有较强的抗蛋白附着的功能,其蛋白质附着量约为对照组的5%。蛋白质是细菌粘附的媒介,因此降低蛋白质附着量,可以有效地减少菌斑的形成。
季铵盐类的单体具有较强的抗菌性[4-5]。通过和细胞膜结合,季铵盐可导致细菌破裂,进而引起细胞质的泄露。当带负电荷的细菌细胞接触带正电荷的季胺N+离子时,电荷平衡受到干扰,细菌可以在其自身的渗透压作用下破裂[18]。长的阳离子聚合物可以像针刺破气球一样,穿透细菌细胞破坏细胞膜[19]。因此,碳链长度需要足够长,以穿透细胞膜。有研究比较了不同碳链长度对季铵盐单体抗菌性能的影响,结果表明碳链长度为16个碳的DMAHDM具有最强的抗菌性能[13]。此外,季铵盐的抗菌机制为接触性抗菌[4-5,18],有研究报道含有季铵盐单体的抗菌复合树脂表面覆盖唾液蛋白后,使得季铵盐单体无法接触细菌,从而降低材料的抗菌性能[18,20]。本研究将MPC和DMAHDM同时添加到牙本质粘接剂中,由于MPC有效地减少了蛋白质的附着,因此增加了DMAHDM抗菌性能。本研究结果显示,实验组表面的细菌粘附量明显少于对照组,且主要为死细菌。实验组菌斑的代谢活性和乳酸产量大约是对照组的5%,表明实验组具有极强的抗菌性。
磷酸钙复合树脂及牙本质粘接剂,其本身不具有强的抗菌性能,但可以释放超饱和态的钙、磷离子使牙体硬组织的病损区域发生再矿化。传统的磷酸钙复合树脂中的磷酸钙填料粒径约在1~55 μm。本研究通过雾化干燥技术合成的NACP的粒径大小仅有100 nm左右。NACP释放的钙、磷离子与传统的磷酸钙复合体相似,但其机械强度是传统磷酸钙复合树脂的近2倍。NACP复合树脂有一定的“智能性”,它在酸性环境里会大量释放出钙、磷离子,也就是在最需要钙、磷离子以对抗细菌产酸和防止龋坏发展的最佳时机。研究表明,含20%NACP的复合树脂能够中和酸,并将环境pH值从致龋的4提高到安全的6.5[11]。因此,本研究中同时添加MPC、DMAHDM和NACP到牙本质粘接剂中,以期能够起到抗蛋白附着、抗菌、中和酸和促进再矿化的作用。这种添加多重有效成分(MPC是抗蛋白附着成分,DMAHDM是抗菌成分,NACP是再矿化成分)的方法在牙本质粘接剂中具有广泛的应用前景。

