木质素降解菌的分离筛选及菌丝成球条件优化
冯茜 国巍 燕红
摘要:为分离筛选出能高效降解木质素的丝状真菌,构建生物固定化载体,从造纸厂采集的污泥中分离筛选出一株高产木质素降解酶的真菌G 13,其产锰过氧化物酶、漆酶和木质素过氧化物酶的活力分别为8 27、0 95和13 55.U/L。通过对菌丝成球影响因素的研究,得到最佳成球条件:18.g/L的蔗糖和2 5.g/L酒石酸铵分别为最佳碳源和氮源,培养基的pH值为5,将5.mL菌悬液接种于100.mL成球液体培养基(250.mL锥形瓶)中,160.r/min,30℃培养72.h,得到的菌丝球球径最大,约为3 4.mm,且表面光滑,弹性好,内部中空,是一种优良的生物固定化载体,能够满足实践应用的需求。
关键词:
木质素;烟曲霉菌;菌丝球;条件优化;生物载体
DOI:10.15938/j.jhust.2019.01.023
中图分类号: Q939 9
文献标志码: A
文章编号: 1007-2683(2019)01-0138-07
Isolation and Screening of the Lignin degrading Fungusand
Optimization of the Mycelium Pellet Cultivation Conditions
FENG Qian 1, 2 ,GUO Wei 1,2 ,YAN Hong 1,2
(1 School of Chemical and Environmental Engineering, Harbin University of Science and Technology, Harbin 150040, China;
2 Key Laboratory of Green Chemical Technology of College of Heilongjiang Province, Harbin 150040, China)
Abstract:In order to isolate andscreen microorganisms that could degrade ligninefficiently, and then constructbiological immobilization carrier, there was 1 strain of high effcient lignin degrading fungi, named G 13, isolated from the sludge samples collected by the paper mill, which the highest lingin enzyme activity of manganese peroxidase(MnP), laccase(Lac) and lignin peroxidase(LiP) were 8 27, 0 95 and 13 55.U/L, respectively Through the study of factors that can affect the pelletization, the best conditions are as follows: sucrose concentration of 18.g/L and ammonium tartrate concentration of 2 5.g/L were worked as the best carbon source and nitrogen source, respectively; the most appropriate medium pH was 5; 5.mL of spore suspension was inoculated on 100.mL of liquid medium forpelletization (in 250.mL Erlenmeyer flask);the optimum temperature was 30℃; and the most suitable shaker speed was 160.r/min Cultured under the most suitable growing conditions for 72.h, the mycelium pellet formed by Aspergillus fumigatus G 13 reached its maximum diameter of 3 4.mm with smooth surface, excellent flexibility and hollow structure, which can be used as biological immobilization carrier as wellas meets the needs of practical application such as industrial wastewater treatment
Keywords:
lignin; Aspergillus fumigatus; mycelia pellets;condition optimization; biological carrier
0引言
制漿造纸工业每年要从植物中分离出大约14亿t纤维素,同时产生含有 5.000 万t左右木质素的污水[1]。木质素(Lignin)是高等植物大量含有的有机高分子化合物,其结构复杂,降解困难,95%的木质素仍以造纸废水的形式直接排入江河或浓缩后烧掉,这不仅浪费了木质素这一重要的可再生资源,还对环境造成了严重污染[2-8]。因此,高效利用可再生资源木质素,并解决制造纸废液引发的环境污染问题受到科学研究工作者的极大关注[9-12]。在造纸工业污水处理系统中,应用微生物降解木质素的关键问题是防止工程菌的流失。菌丝球(pellet)是真菌在液体培养过程中,由菌丝缠绕而形成的一种中空的微生物颗粒,它生存能力较强,具有生物活性良好、沉降速度快、易于固液分离,可实现重复利用等特点[13-15]。且形丝球的微生物还成菌能正常生长,具有产酶、代谢等功能,可保留包括生物吸附和生物降解等在内的生物活性[1]。基于此真菌菌丝球在去除难降解物质、进行染料脱色、吸附重金属离子等方面表现出了很广泛的应用价值[16-19],利用菌丝球作为自固定化细胞体系[20],为这一难题的解决提供了新的思路和方法。
1材料与方法
1 1材料
1 1 1样本来源
研究所用的污泥样本共10份,于2014年10月采自黑龙江省方正县高楞造纸厂。
1 1 2培养基
1)PDA培养基:去皮马铃薯200.g,葡萄糖20.g/L,KH 2 PO 4 3.g/L,MgSO4·7H 2 O 1 5.g/L,琼脂20.g/L,微量VB 1 ,加蒸馏水配成 1.000 mL,pH值自然,120℃灭菌20.min。
2)GU PDA平板培养基:于PDA培养基加入0 1%的愈创木酚。
3)液体产酶培养基:NH 4 Cl 1.g/L,KH 2 PO 4 1.g/L,MgSO 4 ·7H 2 O 0 5.g/L,蔗糖10.g/L,加蒸馏水配成 1.000 mL,pH值自然,120℃灭菌20.min。
4)菌丝球成球培养基:葡萄糖10.g/L,NH 4 Cl 2.g/L, KH 2 PO 4 2.g/L,MgSO 4 ·7H 2 O 2.g/L,加蒸馏水配成 1.000 mL,pH值自然,120℃灭菌20.min。
1 1 3试验器材
TYXQ LS 75S型立式压力蒸汽灭菌器(上海博讯实业有限公司)、SW CJ 1FD洁净台(上海博讯实业有限公司)、GZX 9070MBE型电热恒温鼓风干燥箱(上海博讯实业有限公司)、XSP 2CA光学显微镜(上海辰华)、SHZ 82A 气浴恒温振荡器(金坛市荣华仪器制造有限公司)、SHZ A水浴恒温振荡器(上海博讯实业有限公司)、电子分析天平(常熟市天量仪器有限责任公司)、离心机(上海安亭科学仪器厂)、紫外可见光分光光度计(北京普析通用仪器有限责任)。
1 2方法
1 2 1菌株的分离纯化
称取5.g污泥样品,加入到经过高温灭菌的装有30.mL 0 9%的生理盐水和玻璃珠的250.mL锥形瓶中,振荡摇匀后,进行逐级稀释。取出0 3.mL逐级稀释后的菌液涂布于PDA培养基的平板中央,于30℃恒温培养120.h,挑取单一菌落划线培养于分离平板,经多次划线分离纯化,同时结合显微镜镜检观察,获得的真菌纯培养物划线于斜面培养基,于30℃恒温培养5.d后,保存于4℃冰箱中。
1 2 2菌株的初筛
用接菌环取一环已经分离纯化的真菌培养物点样到GU PDA平板上,每株菌分别点两个平皿,且于每个平皿中点4个样,30℃恒温培养7.d。观察菌落颜色和形状的变化情况,对于产生变色圈的菌株,分别测定其菌丝圈、变色圈的直径,并计算其平均值[21]。
1 2 3菌株的复筛
将初筛产生变色圈的菌株接种在PDA培养基上,于30℃恒温培养5.d,待平板长满孢子,在无菌操作台中用打孔筛打出直径为1.cm的菌块,接入到已灭菌的含有100.mL液体产酶培养基的250.mL锥形瓶中,于30℃静置培养5.d,取样测定发酵液中的三种木质素降解酶的活力,平行操作3次,然后取平均值。
1 2 4菌懸液的制备
将保藏于4℃的固体斜面取出,用接种环刮下其斜面培养物,接入无菌水中,制成浓度为1×10 6个/mL(血球计数法测定)的菌悬液,4℃冰箱保存备用。
1 2 5各种木质素酶活力的测定
1 2 5 1粗酶液的制备
发酵液在 6.000 r/min,4℃下离心10.min,所得的上清液为粗酶液。
1 2 5 2锰过氧化物酶活力测定
向反应体系中加入3 4.mL乙酸-乙酸钠缓冲溶液(浓度为200.mmol/L、pH值为4 5),加入0 1.mL 1 6.mmol/L的MnSO 4 溶液和0 4.mL的粗酶液,最后加入0 1.mL 1 6.mmol/L的H 2 O 2 溶液启动反应,在37℃下反应3.min,测定240.nm的吸光度值。一个酶活单位(U):每min氧化1.μmol Mn 2+ 成为Mn 3+ 的需酶量。每个样品平行操作3次,然后取平均值[22]。
1 2 5 3木质素过氧化物酶活力测定
反应液中含1.mL 15.mmol/L藜芦醇溶液、1 5.mL酒石酸钠缓冲液(浓度为250.mmol/L、pH值为3)和0 4.mL粗酶液,最后加入0 1.mL 20.mmol/L H 2 O 2 溶液启动反应,在30℃下反应2.min,测定310.nm下的吸光度值。一个酶活单位(U):每min氧化1.μmol藜芦醇成为藜芦醛的需酶量。每个样品平行操作3次,然后取平均值[22]。
1 2 5 4漆酶活力测定
向反应体系中加入2.mL乙酸-乙酸钠缓冲溶液(浓度为200.mmol/L、pH值为5)、0 5.mL 0 5.mmol/L的ABTS溶液和0 5.mL粗酶液。在28℃条件下反应10.min后,测定600.nm下的吸光度值。一个酶活单位(U):每min使1.μmolABTS转化为ABTS自由基所需的量。每个样品平行操作3次,然后取平均值[22]。
1 2 6菌丝球直径的测量
将20个菌丝球在平板上排成一排,用滤纸吸干表面水分,用直尺测总长再取平均值即为一个菌丝球的直径。
1 2 7干湿比的测定
随机选取20个菌丝球,用滤纸吸干表面水分,进行称重,此为湿重;随后将其放入烘箱中在70℃条件下进行烘干,直至恒重后再进行称重,此为干重;干重比上湿重,即为干湿比。
1 2 8菌丝球扫描电子显微镜观察
将单一真菌菌丝球取出,用生理盐水冲洗,放置在培养皿中,分别观察外观形态,用S 3400N型扫描电子显微镜观察其内部形态。
2结果与讨论
2 1菌株的分离纯化
2 1 1菌株的分离纯化
根据菌落形态的特征,从10份污泥样品中分离纯化出56株菌,接种到斜面培养基中,于4℃冰箱中保存备用。
2 1 2菌株的初筛
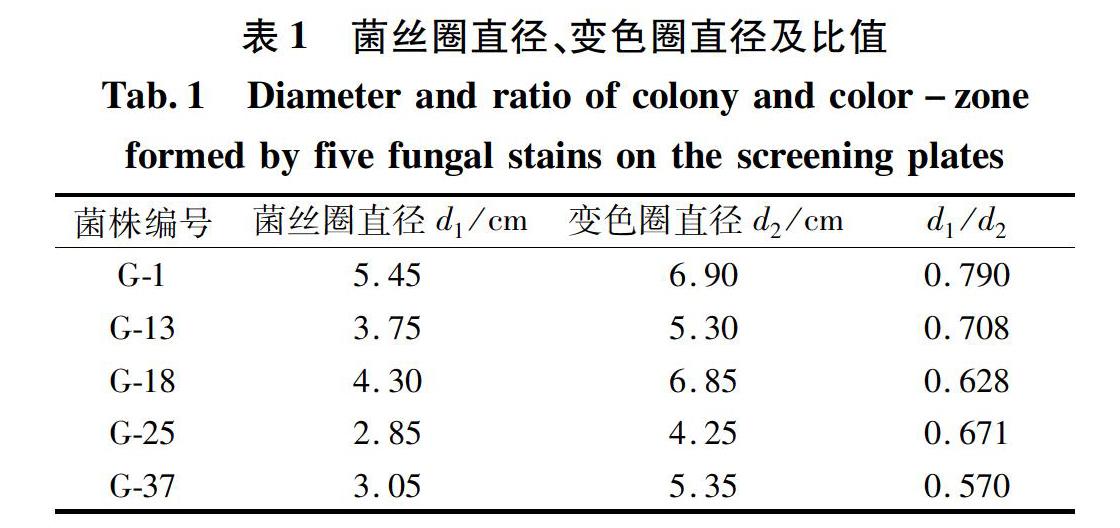
经过初筛实验,共有5株菌发生了变色反应,对于木质素降解菌来说,变色圈的产生有两种情况(菌丝圈直径为 d 1 ,變色圈直径为d 2 ):(1)菌丝圈在变色圈内部形成(即d 1
从表1中可以看出,5株菌都能产生变色圈反应,且d 1 /d 2 的比值均小于1,初步判断它们都能优先降解木质素。
2 1 3菌株的复筛
取5.mL发生颜色变化菌株的菌悬液,分别接入到含有100.mL液体产酶培养基的250.mL锥形瓶中,于30℃静置培养5.d,取样测定发酵液中的木质素过氧化物酶、锰过氧化物酶、漆酶,平行操作3次,然后取平均值。测定结果如表2所示。
由表2可知,菌株G 1没有产锰过氧化物酶的能力,菌株G 25没有产锰过氧化物酶和漆酶的能力。对于锰过氧化物酶,G 13的产酶量是最大的,为8 27.U/L,对于漆酶,G 37的产酶量最大,为1 57.U/L,对于木质素过氧化物酶,G 13的产酶量为最大,为13 55.U/L。综合考虑,选择具有相对较高木质素降解酶活力的G 13作为后续研究的实验菌株。该菌株经进一步鉴定为烟曲霉,虽已有报道烟曲霉具有产木质素降解酶及可降解木质素的能力,但本研究所获得的烟曲霉分离筛选自造纸厂废水污泥,不同于以往文献的菌株来源[23, 24],这就决定了本研究中的菌株将可能具有自身特殊的生理特性。
2 2菌丝球成球条件优化
2 2 1碳源对菌丝球成球的影响
碳源是菌体能量的来源,在微生物的生长过程中有着重要的作用。本研究分别用10.g/L的蔗糖、麦芽糖、淀粉,代替菌丝球成球培养基中的葡萄糖,将G 13接入到100.mL(250.mL锥形瓶)成球培养基中,接种量为5.mL,于160.r/min, 30℃的摇床中振荡培养,在第4.d取样测定菌丝球的直径和干湿比,结果见表3。
由表3可知,淀粉作为碳源,菌丝球的球径不均一,表面不光滑,培养基呈浑浊的白色。以麦芽糖作为碳源时,菌丝球的弹性很差。而以蔗糖作为碳源时,菌丝球的直径和干湿比均为最大,球径约2 15.mm,干湿比为0 335。综合考虑,选择蔗糖为碳源时,最有利于菌丝球的培养。
2 2 2碳源浓度对菌丝球成球的影响
研究了不同浓度的蔗糖(3.g/L、5.g/L、8.g/L、10.g/L、15.g/L、18.g/L、20.g/L)对G 13成球的影响,将G 13接入到100.mL(250.mL锥形瓶)成球培养基中,接种量为5.mL,于160.r/min,30℃的摇床中振荡培养,在第4.d取样测定菌丝球的直径和干湿比,结果见表4。
由表4可知,当蔗糖浓度为3.g/L时,菌丝球不成球。当蔗糖浓度为5.g/L、10.g/L、20.g/L时,菌丝球的弹性较差,成球状态不理想。当蔗糖浓度为18.g/L时,菌丝球球径均一,表面光滑,球径和干湿比均为最大,球径约为2 3.mm,干湿比为 0 038.4。 因此,当碳源浓度为18.g/L时,最利于菌丝球的培养。
2 2 3氮源对菌丝球成球的影响
分别用2.g/L的硫酸铵、酒石酸铵、蛋白胨,代替菌丝球成球培养基中的氯化铵,将G 13接入到100.mL(250.mL锥形瓶)成球培养基中,G 13的接种量为5.mL,于160.r/min,30℃的摇床中振荡培养,在第4.d取样测定菌丝球的直径和干湿比,结果见表5。
由表5可知,当蛋白胨作为氮源时,菌丝球的球径小,培养基呈浑浊的黄色,且有很多不规则的菌丝碎片。当酒石酸铵作为氮源时,菌丝球的球径和干湿比最大,球径约为2 55.mm,干湿比为 0 040.6。 因此,选择酒石酸铵为最佳氮源时,最有利于菌丝球的培养。
2 2 4氮源浓度对菌丝球成球的影响
研究了不同浓度的酒石酸铵(0 5.g/L、0 8.g/L、1.g/L、1 5.g/L、2.g/L、2 5.g/L、3.g/L)对G 13成球的影响,将G 13接入到100.mL(250.mL锥形瓶)成球培养基中,接种量为5.mL,于160.r/min,30℃的摇床中振荡培养,在第4.d取样测定菌丝球的直径和干湿比,结果见表6。
3不成球
由表6可知,随着氮源浓度的增大,菌丝球的球径和干湿比整体趋势上都在增大。当氮源浓度小于1 5.g/L时,菌丝球表面不光滑;当氮源浓度大于2 5.g/L时,则不成球,培养基呈浑浊分层的状态。当氮源浓度为2 5.g/L时,菌丝球的球径和干湿比最大,球径约为2 5.mm,干湿比为 0 043.4。 因此,当氮源浓度为2 5.g/L时,最利于菌丝球的培养。
2 2 5pH值对菌丝球成球的影响
将G 13接入到100.mL(250.mL锥形瓶)成球培养基中,接种量为5.mL。调节培养基的pH值,使其分别为2、3、4、5、6、7、8和9。于160.r/min,30℃的摇床中振荡培养,在第4.d取样测定菌丝球的直径和干湿比,结果见表7。
由表7可知,培养基的pH值过大或过小,G 13均不能成球,培养基的pH值在4-7的范围内能形成球径均一的球体。随着培养基pH值的增大,球径逐渐减小,当培养基的pH值为5时,所形成的菌丝球大小适中,弹性好,不会出现菌丝球球径大但内部空的情况。综合考虑,当pH值5时,最利于菌丝球的培养。
2 2 6接种量对菌丝球成球的影响
将G 13接入到100.mL(250.mL锥形瓶)成球培养基中,接种量分别为1.mL、3.mL、4.mL、5.mL、8.mL、10.mL 和15.mL。于160.r/min,30℃的摇床中振荡培养,在第4.d取样测定菌丝球的直径和干湿比,结果见表8。
由表8可知,当接种量过低时,培养基提供给单个孢子的营养物质就会过盛,导致形成的球体直径较大,弹性差。当接種量过高时,孢子个数过多会导致晶核数量多,形成菌丝球的数量就会增多,菌丝球之间会形成生长空间的竞争,再加上营养物质不充足,形成的菌丝球直径过小,球径不均一。菌丝球的球径随着接种量的增加而减小,当接种量为5.mL时,菌丝球的干湿比最大,球径均一,大小适中,弹性最好。因此,当接种量5.mL时,最利于菌丝球的培养。
2 2 7温度对菌丝球成球的影响
将G 13接入到100.mL(250.mL锥形瓶)成球培养基中,接种量为5.mL,培养基pH值为5。于160.r/min,温度分别为26℃、28℃、30℃、34℃和37℃的摇床中振荡培养,在第4.d取样测定菌丝球的直径和干湿比,结果见表9。
由表9可知,随着温度的升高,菌丝球的球径逐渐变大。当温度为26℃时,菌丝球的球径小,且球体很硬;当温度为37℃时,菌丝球的球径最大,但是球径不均一,弹性很差,培养基中还有很多菌丝碎片;当温度为28℃时,形成的菌丝球球径均一,弹性好。综合考虑,当培养温度28℃时,最有利于菌丝球的培养。
2 2 8转速对菌丝球成球的影响
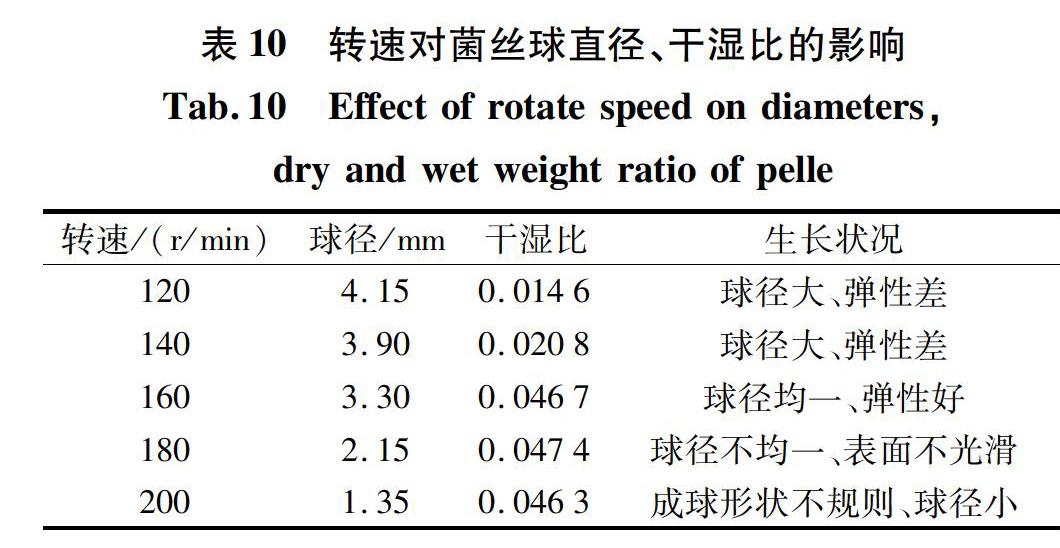
将G 13同时接入到100.mL(250.mL锥形瓶)成球培养基中,接种量为5.mL,培养基pH值为5。于30℃,转速分别为120.r/min、140.r/min、160.r/min和180.r/min的摇床中振荡培养,在第4.d取样测定菌丝球的直径和干湿比,结果见表10。
由表10可知,随着转速的增大,菌丝球的球径减小。当转速过低时,菌丝受到的剪切力小,形成的菌丝球球径大,球体呈松散状态,弹性很差,表面不光滑;当转速过高时,菌丝受到的剪切力很大,会打散菌丝球,使菌丝球球径不均一,形状不规则,培养基中有菌丝碎片。转速为160.r/min时形成的菌丝球球径均一,各方面的性能都很好。因此当转速为160.r/min时,最利于菌丝球的培养。
2 2 9培养时间对菌丝球成球的影响
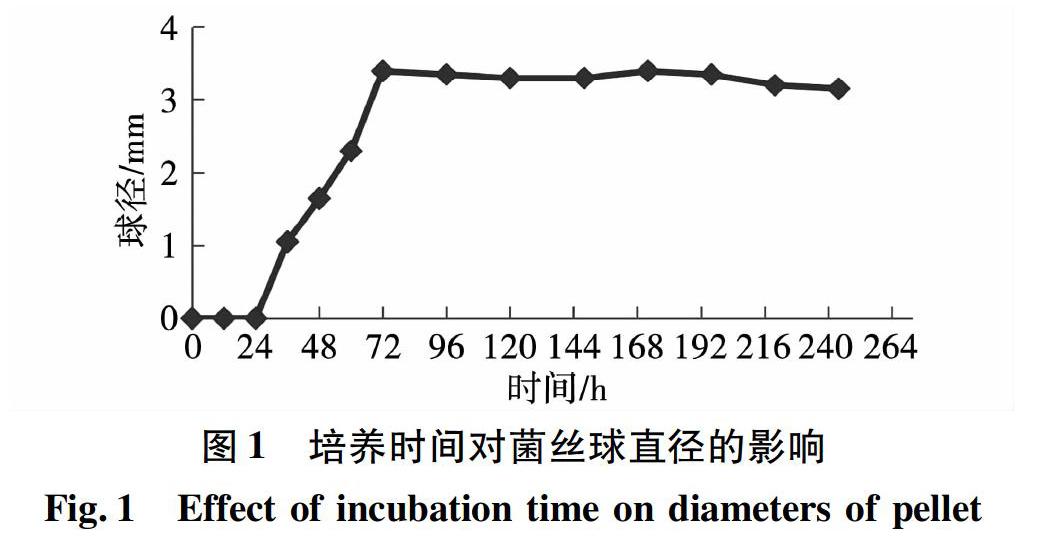
将G 13接入到100.mL(250.mL锥形瓶)成球培养基中,接种量为5.mL,培养基pH值为5。于160.r/min,30℃的摇床中振荡培养。每12.h取样测定菌丝球的直径和干湿比,结果见图1和图2。
由图1可知,随着培养时间的增长,菌丝球的球径呈增大的趋势,0-24.h内没有形成菌丝球,24.h之后,菌丝球的直径逐渐增大,当培养至72.h时,菌丝球的直径最大,平均球径约为3 4.mm,此后菌丝球的直径基本不变。如图2所示,干湿比随着培养时间的延长是先增大后减小的趋势,在72.h时,干湿比最大,为 0 048.1, 随后干湿比逐渐减小,可能是因为营养物质的消耗导致菌丝球停止生长,内部菌丝结构慢慢变得松散,导致干湿比降低。由图3可见,在最佳成球条件下形成的单一真菌菌丝球大小均匀,表面光滑。将菌丝球切开,利用扫描电镜观察其内部结构(如图4),可见此时菌丝球生长状态好,内部呈现中空的结构。从图5和图6可见菌丝之间缠绕十分紧实,表面光滑,适合作生物固定化载体。
3结论
1)从10份样品中共分离出56株菌,通过初筛实验获得5株具有木质素降解能力的真菌,经过复筛测定这5株菌的木质素降解酶的酶活,获得一株产木质素酶活力较高的菌株G 13。
2)碳源,氮源,pH值,温度,转速等因素对菌丝球成球有较大影响。在最佳成球条件下培养所获得的菌丝球球径适中,表面光滑,弹性好,易于固液分离,是一种很好的生物质载体。
参 考 文 献:
[1]MUNOZ G, VALENCIA C, VALDERRUTEN N, et al Extraction of Chitosan from Aspergillus Niger Mycelium and Synthesis of Hydrogels for Controlled Release of Betahistine[J]Reactive & Functional Polymers, 2015, 91
[2]柳荣展, 王广建 白腐菌在制浆造纸工业中的应用进展[J]青岛大学学报, 2001, 16(3):46
[3]NINOMIYA K, TAKAMATSU H, ONISHI A, et al Sonocatalytic Fenton Reaction Forenhanced OH Radical Generation and Its Application to Lignin Degradation[J]Ultrason Sonochem, 2013, 20: 1092
[4]DU X Y, MARTA P B, CARMEN F, et al Analysis of Lignin carbohydrate and Lignin ligninlinkages after Hydrolase Treatment of Xylan lignin,Glucomannan lignin and Glucan lignin Complexes from Spruce Wood[J]Planta, 2014, 239:1079
[5]吴香波, 谢益民 造纸废水微生物处理现状和发展[J]湖北造纸, 2008, 3: 7
[6]郝素娟 造纸工业废水的处理方法分析[J]产业与科技论坛, 2011, 10 (20) : 97
[7]俞丽平 生化和深度处理法处理造纸中段废水[J]环保与节能,2012, 43(1): 71
[8]FERNANDO M, MARCELA N, HELOSIA R, et al Manganese Peroxidase and Biomimeticsystems Applied to in Vitro Lignin Degradation in Eucalyptus Grandis Milled Wood and Kraft Pulps[J]J Chem Technol Biotechnol, 2016, 91: 1422
[9]范天黎, 席宇, 姚东升 土曲霉M11菌丝球对结晶紫的吸附脱色研究[J]化学与生物工程, 2010, 27(3): 77
[10]王寶娥, 周康群, 麦霖霞, 等 烟曲霉菌丝球吸附富里酸的性能及相互作用[J]环境科学与技术, 2013, 36(50): 38
[11]PHISIT S, AMPIN K, ARTHITAYA K, et al Improvement in Efficiency of Lignin Degradation by Fenton Reaction Using Synergistic Catalytic Action[J]Ecological Engineering, 2015, 85: 283
[12]ASGHER M, IJAZ A, BILAL M Lignocellulose degrading Enzyme Production by Pleurotus Sapidus WC 529 and Its Application Inlignin Degradation[J]Turkish Journal of Biochemistry, 2016, 41(1): 26
[13]程子彰, 杨洲平, 胡容, 等 粗毛栓菌菌丝球非灭菌条件下对12种染料的脱色研究[J]菌物学报, 2012, 31(6): 878
[14]NYMAN J, LACINTRA M G, WESTMAN J O, et al Pellet Formation of Zygomycetes and Immobilization of Yeast[J]New Biotechnology,2013,30(5): 516
[15]黄勋娟, 刁宁宁, 张建国 黑曲霉菌丝球的形成及应用研究综述[J]食品与发酵工业, 2014, 40(11): 171
[16]陈慧英 由高产木质纤维素酶的海洋微生物组成的双菌种共固定化体系的构建与应用[D]杭州: 浙江大学, 2013: 29
[17]山丹, 马放, 张斯, 等 低温苯胺降解菌固定化菌丝球方法与特性[J]北京工业大学学报,2008, 34(6): 636
[18]张燕, 刁宁宁, 黄勋娟, 等 发酵罐中利用黑曲霉菌丝球处理豆制品废水的研究[J]工业微生物, 2016, 46(1): 22
[19]FERNANDO M, MARCELA N, HELOSIA R, et al Manganese Peroxidase and Biomimeticsystems Applied to in Vitro Lignin Degradation in Eucalyptus Grandis Milled Wood and Kraft Pulps[J]J Chem Technol Biotechnol, 2016, 91: 1422
[20]陈平 粗毛栓菌和蜡样芽胞杆菌及其共固定对Pb 2+ 、Cu 2+ 的吸附研究[D]成都: 四川农业大学, 2008: 35
[21]燕红, 苏俊, 于彩莲, 等 高效木质素降解菌株的分离筛选[J]浙江大学学报 (农业与生命科学版), 2011, 37(3): 259
[22]燕红, 张晓甜, 刘明 木质素降解菌株产木质素降解酶的研究[J]黑龙江大学自然科学学报, 2011, 28(6): 845
[23]袁俊超, 吕宝, 屈敦妮, 等 烟曲霉YSITB Ⅰ菌株筛选及其降解木质纤维中木质素研究[J]湖北农业科学, 2015, 54(17): 4164
[24]金显春, 陶文沂 烟曲霉XC6菌株的发酵条件优化[J]安徽农业科学, 2006, 34(16): 3882

