新型导尿管超滑抗菌涂层的制备及生物安全性评价*
李育强,智倩倩△,王晓丽,王南南,韩超,孔晓颖
(1.青岛明药堂医疗股份有限公司,青岛 266111;2.青岛农业大学,青岛 266109)
1 引 言
据世界卫生组织2005年统计,全球约有140万院内感染患者。院内感染[1]将成为全球性日益严重的公共卫生问题。控制院内感染的有效途径是在医疗器械表面添加涂层。国外先进技术通过光催化接枝的方法将超滑、抗菌涂层接枝到医疗器械表面,而国内尚无此技术。为降低腔道插管造成的组织感染,同时面对国际市场的技术垄断[2-3],国内科研工作者对功能性涂层也加大了研究力度。目前临床医疗器械的抗菌成分多为纳米银,但研究表明纳米银会随大鼠血液循环进入肾脏、肝脏、脾脏、大脑和肺脏等重要器官内,并在细胞内外沉积,干扰细胞[4]。同时在国家对含银医疗器械产品不予注册的背景下,亟需研制一种对人体无毒害、无抗药性的超滑抗菌涂层导管。
我们经过对光催化接枝涂层的研究,深入探讨关键技术要点,包括单体浓度、体系温度、紫外接枝时间等,探索最佳制备工艺,制备出新型的硅胶超滑抗菌涂层[5]。本研究以导尿管为例,对新型超滑抗菌涂层进行生物安全性能研究。细胞毒性试验[6]是公认的可迅速地表征供试品对细胞新陈代谢的影响,其结果可直接反应超滑抗菌导尿管是否安全可靠。按照《GB/T 16886医疗器械生物学评价》,超滑抗菌导尿管属于黏膜接触类产品,通过细胞毒性、黏膜刺激和皮下刺激等进行生物安全性能评价试验。
2 材料与方法
2.1 新型超滑抗菌涂层的制备
选用纯硅胶导尿管为基体材料,采用光催化接枝的方法制备出超滑抗菌硅胶导尿管[5]。将导尿管经过丙酮预处理、醇洗、干燥、光催化剂处理、紫外接枝反应、醇洗、水洗等工序,将丙烯酸及牡丹酚接枝到导尿管外表面制备出超滑抗菌涂层导尿管。
2.2 单因素分析
设计单因素试验方案见表1,从单体浓度、体系温度及紫外辐照时间考察涂层的外观、厚度、体系反应现象等,优化涂层工艺。

表1 单因素试验方案
2.3 产品表征
2.3.1红外光谱 采用美国尼高力公司的傅立叶变换红外光谱仪Nicolet 510p对样品结构进行分析,评价涂层接枝结果。
2.3.2扫描电镜 采用扫描电子显微镜S-3400N进行扫描分析样品形貌及涂层厚度。
2.4 MTT法[6]
用DMEM完全培养液按照1∶5比例浸提超滑抗菌导尿管。取小鼠成纤维细胞L929细胞悬液接种于96孔细胞培养板,细胞铺板浓度为4.5×104个/孔,放置于CO2培养箱(5%,37℃)培养18 h。弃除细胞培养液,分别将100 μL DMEM 完全培养基、高密度聚乙烯 DMEM 培养基、含5%二甲基亚砜(DMSO)的DMEM培养基、两组样品浸提液加到每个孔中,每组5孔平行样。
培养72 h后取出培养板,镜下观察细胞形态。每孔加10 μL MTT,置于CO2培养箱培养4 h后,弃去孔内液体,加入150 μL DMSO,用酶标仪测OD570nm的吸光度(A)值。计算得出平均A值,并计算细胞的相对增殖率(RGH):RGH=实验组平均A值/对照组平均A值×100%。细胞毒性分级:0级,RGH≥100%;1级,RGH为75%~99%;2级,RGH为50%~74%;3级,RGH为25%~49%;4级,RGH为1%~24%;5级,RGH为0。
2.5 皮下刺激实验
取10只新西兰兔,试验前4~18 h,彻底除去动物背部脊柱两侧背毛。分别用无菌生理盐水、无菌棉籽油浸提取超滑抗菌导尿管。每只兔子背部两侧各选取8个注射点,左前侧四点为无菌生理盐水浸提液;左后侧四点为无菌生理盐水对照液;右前侧四点为无菌棉籽油浸提液;右后侧四点为无菌棉籽油对照液。每个注射点注射0.2 mL液体,并在注射后24、48和72 h观察各注射部位状况。根据国际标准化组织(ISO)制定的《医用器械生物学评价和国际标准》(ISO10993:2002)评分标准对注射点进行评分,判断皮下刺激分数。
2.6 黏膜刺激实验[7]
取6只新西兰兔,4只为实验组(2雄2雌),2只为对照组(1雄1雌)。将兔固定,提起兔尾巴使其阴道口/阴茎完全暴露,使用注射器,将1 mL浸提液,推入实验组新西兰兔阴道/阴茎内,用无菌脱脂纱布轻轻擦去溢出物,给药后使动物维持臀高头低位被动安静3 min。每隔24 h重复给药7 d后,无痛处死新西兰兔后,取生殖道组织做HE染色病理检查,观察有无组织变性、坏死、炎细胞浸润、血管充血、水肿等刺激性反应并打分评价。
2.7 统计学分析
应用SPSS软件进行数据处理,分析数据间的显著性差异。P<0.05(*)为有显著性差异,P<0.01(**)为有极显著性差异。
3 结果
3.1 单体浓度
对比分析涂层表面微观及厚度优化单体浓度,结果见图1。根据结果可知,涂层厚度随单体浓度的增高先增加后降低,但单体浓度过高使涂层表面变得粗糙。推测原因:当单体浓度较低时,单体之间接触和碰撞的几率较小,不利于分子链的增长,聚合反应慢,涂层较薄;随单体浓度的提高,反应速度加快,利于分子链的增长,相对分子质量增大,涂层厚度增加;但单体浓度过高时,反应体系升温过快,不利于热量散发,聚丙烯酸易发生交联现象,涂层表面出现结块。单体浓度优化为95 mM。
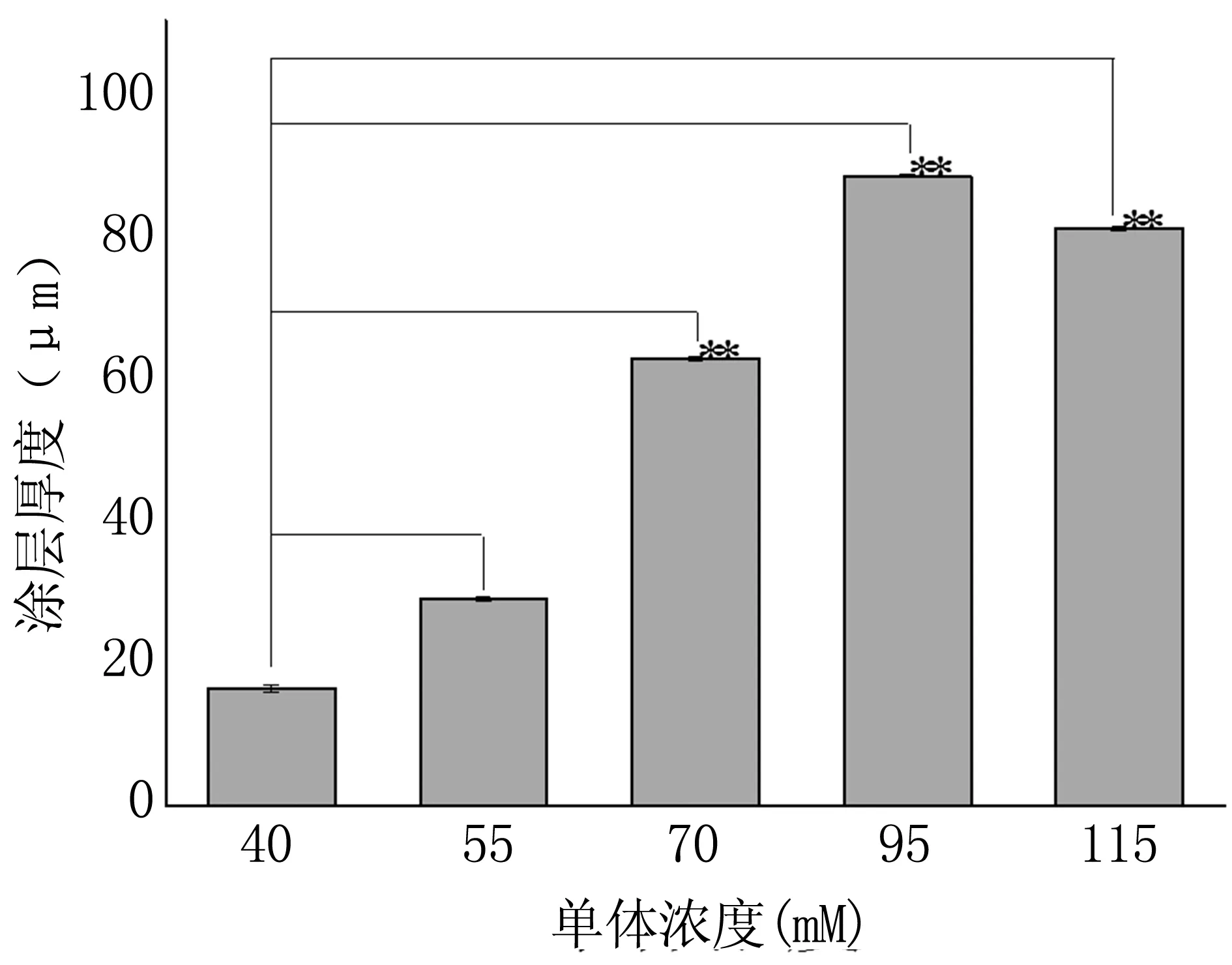
图1单体浓度对涂层厚度的影响
Fig1Theinfluenceofmonomerconcentrationonthecoatingthickness
3.2 体系温度
针对体系温度单因素,分析涂层厚度及体系反应前后变化,结果见图2。根据结果可知,涂层厚度随体系温度的升高先增加后减小,但温度过高使反应体系黏度大大增加。体系反应温度升高利于反应速度加快,有利于分子链的增长,相对分子质量增大,涂层厚度增加;但体系温度过高时,丙烯酸容易发生交联现象,使得反应体系黏度增加,不利于体系的重复利用。体系温度优化为35℃。
3.3 紫外辐照时间
通过涂层厚度及试样性状优化紫外辐照时间,结果见图3。根据结果可知,涂层厚度随紫外接枝时间增加而增加,但涂层厚度过高造成试样透明度降低,影响外观。紫外辐照下产生自由基,辐照时间越长,产生的自由基数量越多,利于分子链的增长,相对分子质量增大,涂层厚度增加。紫外辐照时间优化为7 min。
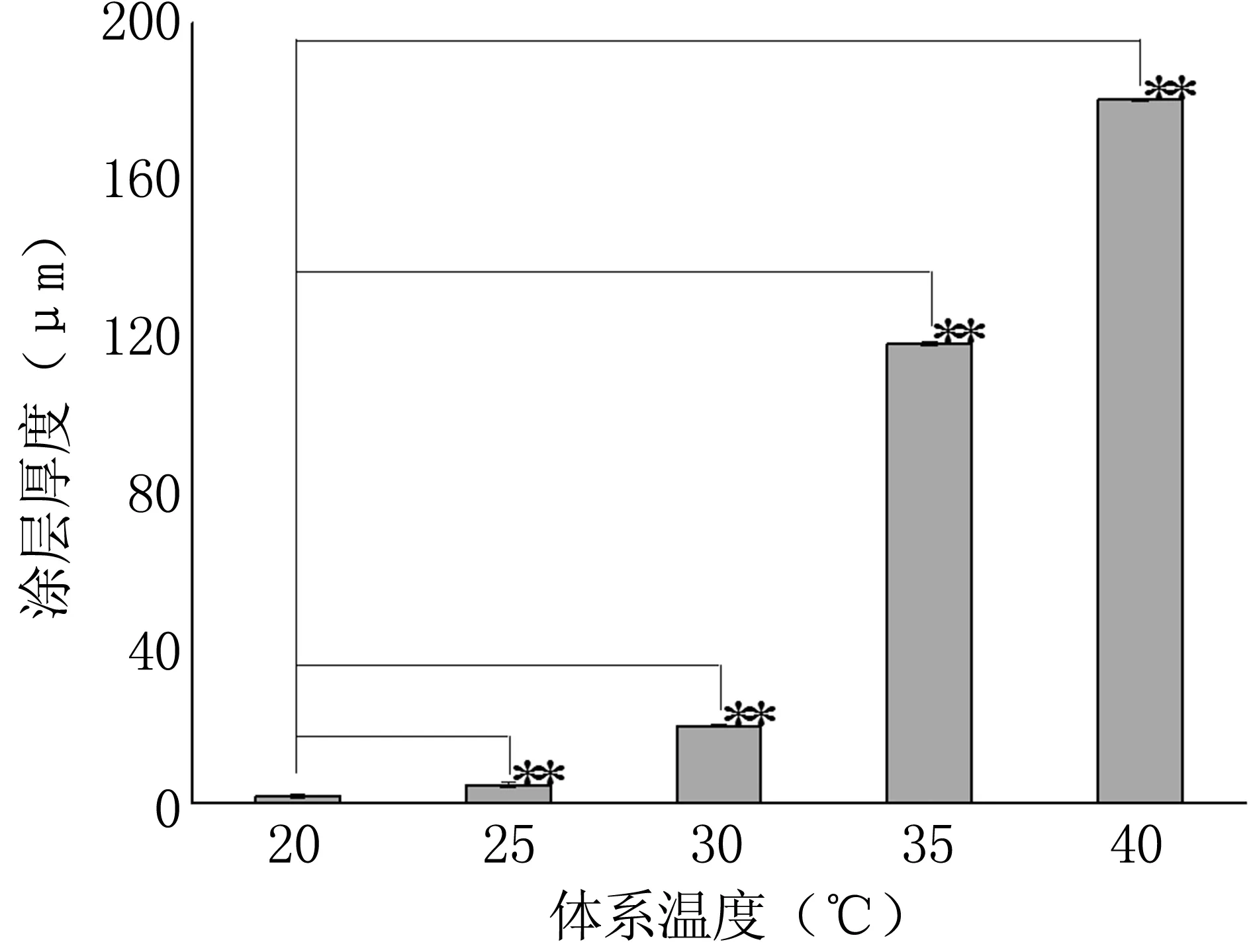
图2体系温度对涂层厚度的影响
Fig2Influenceofsystemtemperatureoncoatingthickness
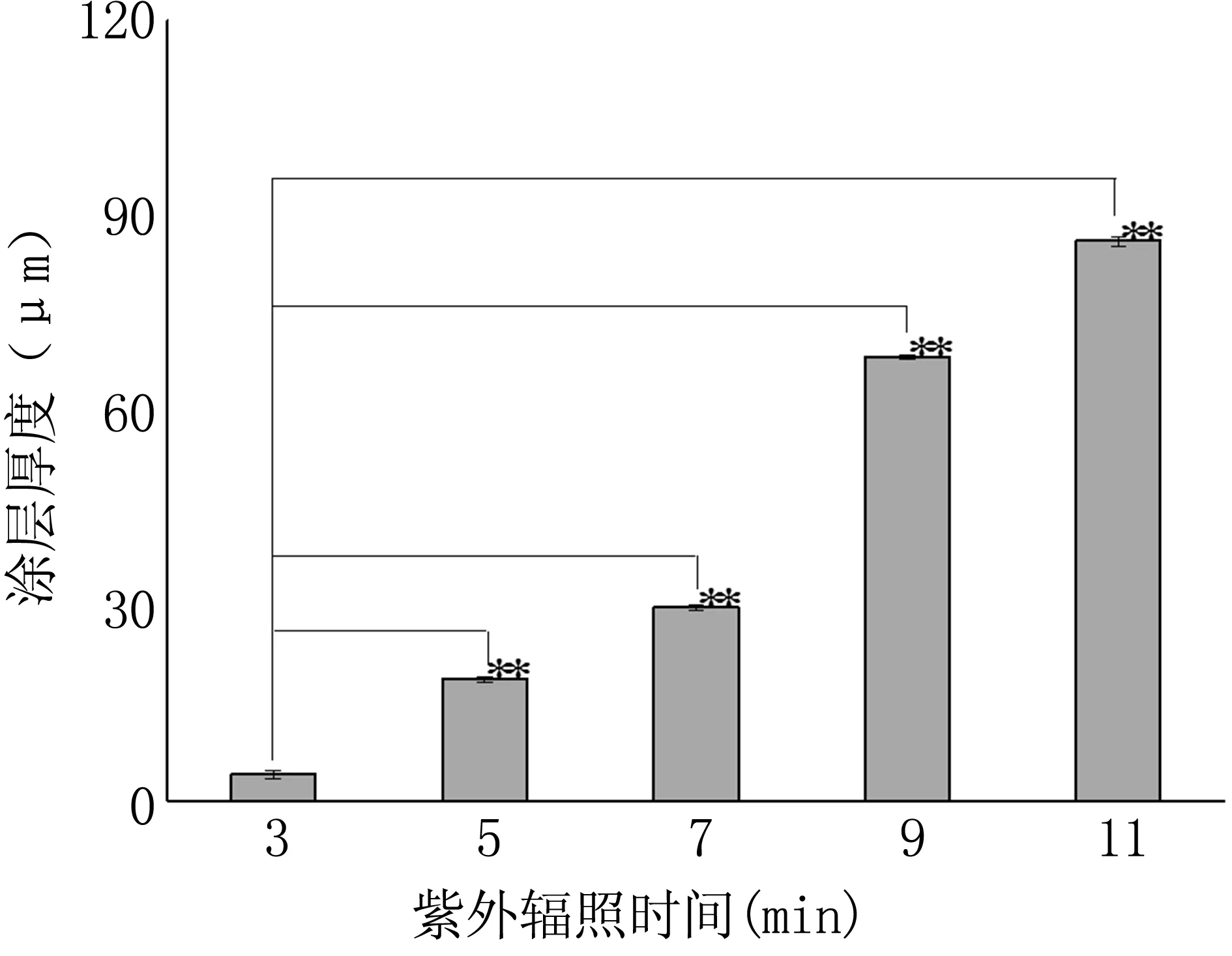
图3紫外辐射时间对涂层厚度的影响
Fig3Effectofultravioletradiationtimeoncoatingthickness
3.4 产品表征
2.4.1红外图谱 对超滑抗菌导尿管进行红外光谱分析,如图4红外光谱图对比所示,硅胶导尿管基材的特征峰包含788、1008、1258、2962 cm-1等,对比超滑涂层及超滑抗菌涂层导尿管可知,超滑涂层、抗菌涂层分别成功地引入特征峰1543、1716 cm-1,其中1716 cm-1是抑菌剂中酯基C=O双键伸缩振动峰,说明超滑涂层及抑菌涂层均成功接枝到导尿管表面。
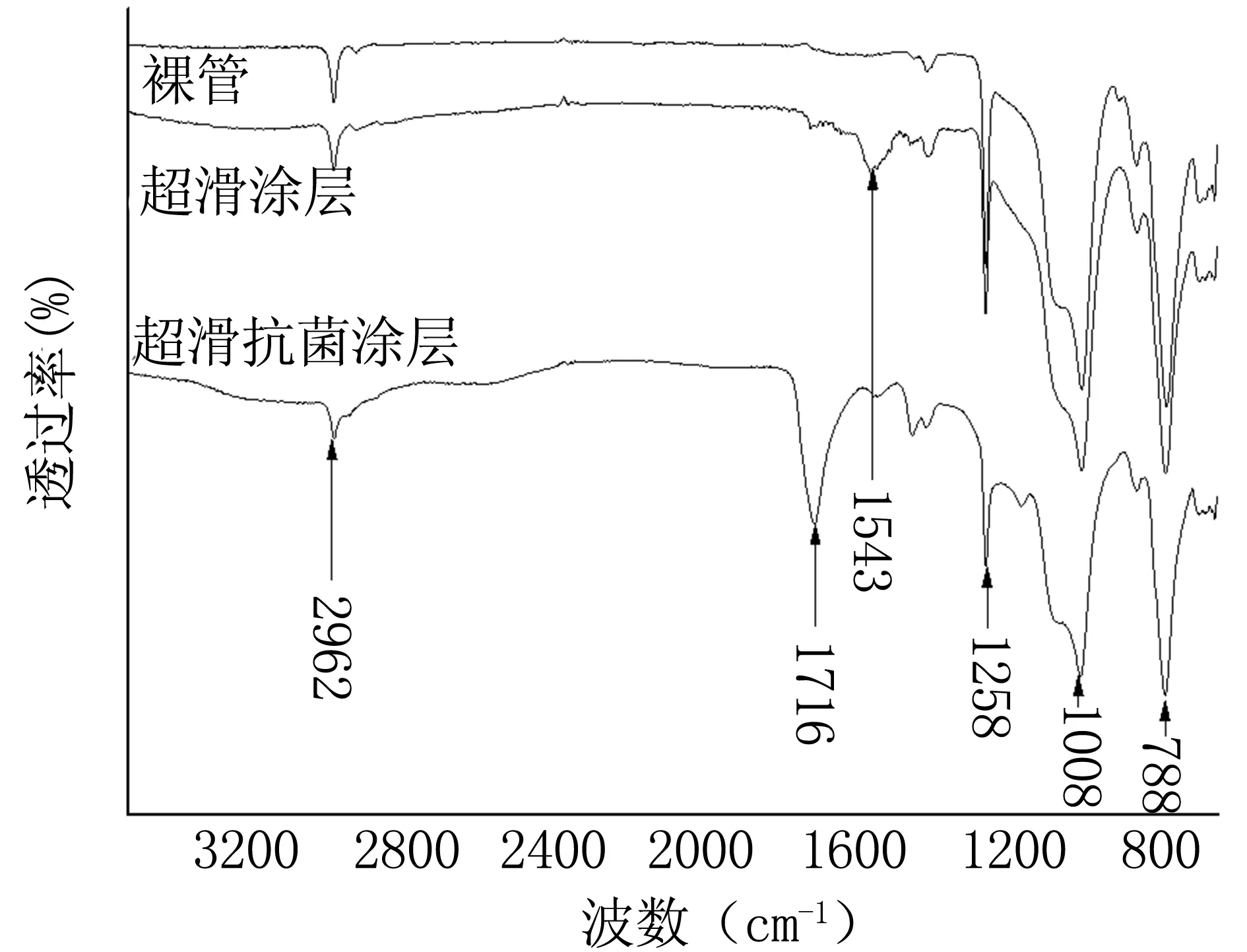
图4 裸管、超滑导尿管、超滑抗菌导尿管红外光谱图
Fig4Infraredspectraofsiliconetube,superslidecatheter,superslideantibacterialcatheter
2.4.2扫描电镜 图5为单因素试验导尿管涂层表面及横截面的扫描电镜照片,对各试验条件下样品的表观及涂层厚度进行分析。图中,A-E表示不同单体浓度下制备的涂层表面照片,涂层表面随单体浓度的增加,涂层表面由紧密平整逐渐呈现水流状;浓度过高时,涂层表面出现结块、不平整的现象。F-J、K-O分别为不同体系温度及紫外辐射时间下导管横截面照片,根据结果可以看出涂层厚度均随体系温度、紫外辐射时间的增加而增加。

图5单因素试样扫描电镜照片
(A-E:不同单体浓度涂层表面;F-J:不同体系温度导管横截面;K-O:不同紫外辐射时间导管横截面)
Fig5Scanningelectronmicrographesofsinglefactorsample
3.5 细胞毒性
新型超滑抗菌导尿管组浸提液细胞相对增殖率为94.9%~102.0%,无涂层硅胶导尿管细胞相对增殖率为97.2%~103.2%,细胞毒性均为1级。超滑抗菌导尿管与对照普通硅胶导尿管的相对增殖率平均值间的差异无显著性意义(P<0.05)。各组细胞相对增殖率平均值见图6。
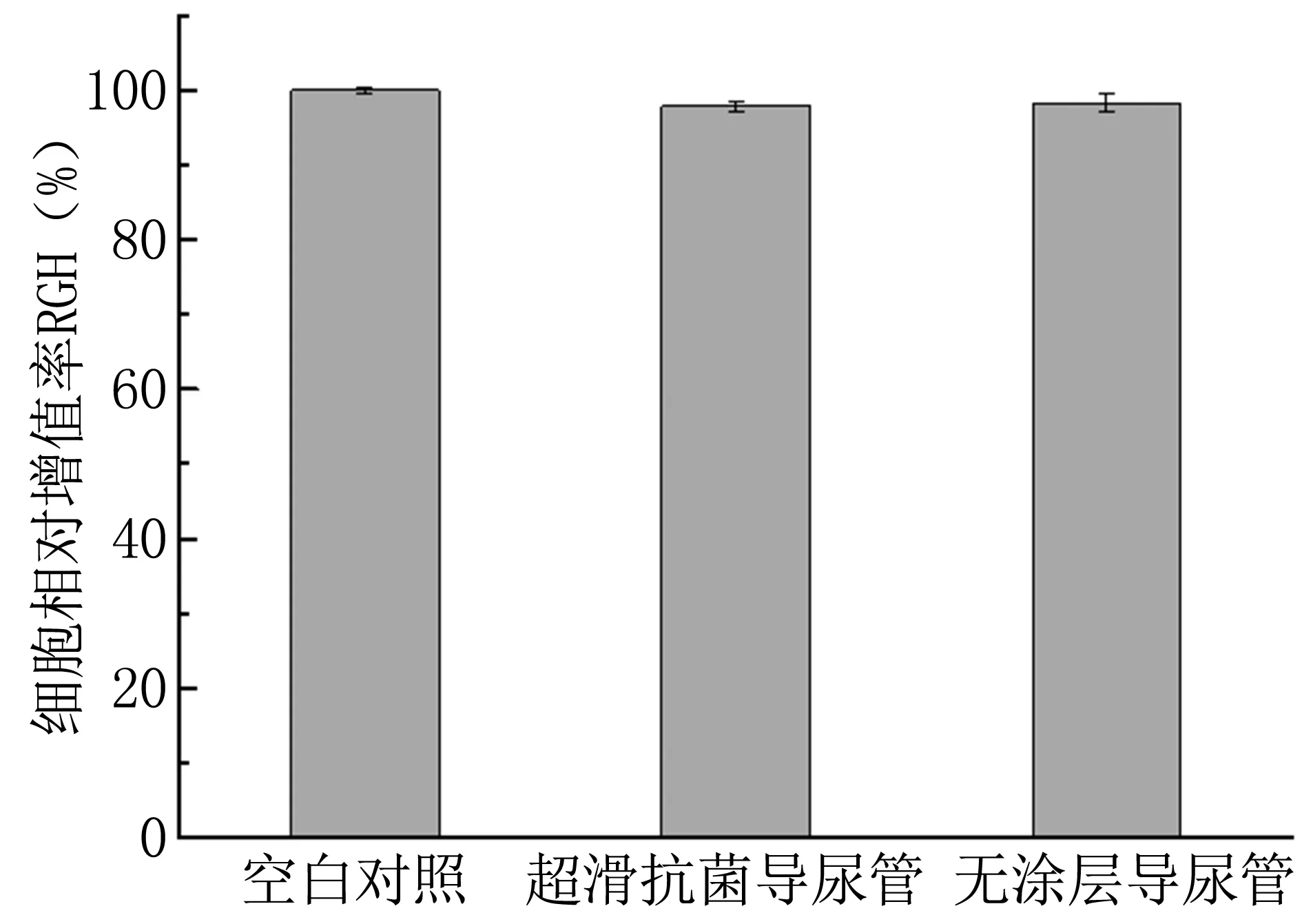
图6各组体外细胞相对增值率(RGH)
Fig6Cellrelativeproliferationrateofdifferentgroup
3.6 皮下刺激
皮下刺激24、48和72 h后,观察实验组和对照组,精神状态良好,无异常情况发生。整个观察期间实验组注射点无红斑、无水肿、无硬结,超滑抗菌导尿管皮下刺激分数为0。
3.7 黏膜刺激
见图7,超滑抗菌导尿管重复给毒7 d,对生殖道黏膜无刺激,给药部位未出现糜烂、溃疡等病变,对照组和实验组组织正常,均未出现炎症反应。
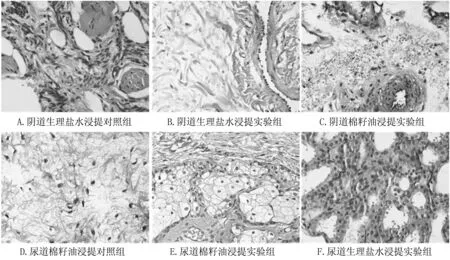
图7兔子生殖道切片照片(400×)
Fig7Themicroscopeimagesofrabbittractusgenitalissection(400×)
4 讨论
面对国内外市场上含银制品的潜在毒性,及近年来国家对含银医疗器械监管力度的加大,亟需对高生物安全性的超滑抗菌涂层材料进行研究。市场上的含银涂层导尿管直接与人体黏膜接触,其细胞毒性较高[8],将对机体细胞造成不可弥补的隐患。
牡丹酚来源于毛茛科植物牡丹皮,萝藦科植物等,具有镇痛、抗炎、抑菌等作用,尤其对金黄色葡萄球菌和大肠杆菌具有显著的抑菌效果,此外,牡丹酚可被人体迅速吸收、代谢和排泄[9]。课题组前期对硅胶光催化接枝牡丹酚涂层的体外抑菌实验效果显著,制备成超滑抗菌导尿管后,其持续抗菌时间可达30 d以上[5],可显著降低插入导管相关性院内感染。
我们对光催化接枝涂层进行研究,深入探讨关键工艺技术,包括单体浓度、体系温度、紫外接枝时间。同时参考GB/T 16886.5-2017第5部分[10]、GB/T 16886.10-2005 第10部分[11],对光催化接枝制备的超滑抗菌导尿管进行了生物学评价。研究了新型超滑抗菌导尿管的体外细胞毒性、皮下刺激以及黏膜刺激。体外细胞毒性MTT实验法[8]通过检测产品对活细胞数量及其新陈代谢的影响进行评价,能快捷地反映产品对细胞造成的损害程度。新型超滑抗菌导尿管体外细胞毒性与普通导尿管相对增值率平均值间差异无显著性意义(P>0.05),细胞毒性级别均为1级。皮下刺激72 h后,实验组注射点无红斑、无水肿、无硬结。黏膜刺激试验能反映出导尿管对黏膜腔道组织的潜在性刺激[7]。本研究试验中对动物重复给毒7 d后,超滑抗菌导尿管浸提液对黏膜无刺激,无炎症现象出现,表明新型导尿管超滑抗菌涂层在使用过程中对黏膜无潜在性危害。
综上,本研究超滑抗菌涂层优化工艺分别为95 mM、35℃、7 min,其细胞毒性为1级,皮下刺激评分为0分,阴道刺激实验中,重复给毒7 d后对阴道黏膜无刺激,生物安全性良好,符合医疗器械生物学评价标准要求。超滑抗菌涂层完全可以替代含银涂层器械,为其临床使用提供理论依据。该涂层技术不仅用于高端涂层导管系列产品,如气管插管、胃管、引流管、留置针套管等,而且也可用于骨科植入器械、牙科植入器械和呼吸机等医疗设备,带动高端医疗器械产品的开发。

