水稻中类受体蛋白激酶FERONIA-like Receptor 1的表达纯化及抗体制备
吴秀秀,蒋 顺,于 峰,曹建中,汪 龙,*
(1.中南林业科技大学食品科学与工程学院/稻谷及副产物深加工国家工程实验室,中国湖南长沙410004;2.湖南大学生物学院,中国湖南长沙410082)
类受体蛋白激酶FERONIA(FER)是CrRLK1-L亚家族的成员之一,能够调控拟南芥生长发育的多个方面[1],为近年来植物研究领域的“明星分子”。FER最早被发现参与拟南芥花粉管发育,在拟南芥fer突变体中,花粉管的生长不能停止且不将其内容物递送到胚囊中,使双受精过程受到影响[2]。FER主要参与的功能有调控细胞伸长[3~4]、免疫反应[5~6]、响应 ABA(abscisic acid)反应[7~9]、参与JA(jasmonic acid)信号调控[10]等。水稻中有16个具有完整胞内外结构域的类受体蛋白激酶FERONIA-like receptor(FLR)家族成员,其中与拟南芥FER同源性最高的成员为FLR1。目前发现FLR1能够通过赤霉素途径来影响水稻株高[11],同时参与调节花粉育性[11~12]。鉴于类受体蛋白激酶FLR在水稻中的研究处于起步阶段,我们将FLR1基因的胞外(FLR1-BW)和胞内(FLR1-BN)结构域分段克隆到不同的蛋白质表达载体上,比较其表达情况,并通过对诱导条件的筛选,选出最优的蛋白质表达及纯化策略,以期获得较高浓度及纯度的FLR1的N端和C端蛋白质,以便用于抗体制备及后续功能研究。本研究为类受体激酶的蛋白质纯化和抗体制备提供了思路,也为后续机制探索提供了基础。
1 材料与方法
1.1 材料
1.1.1 供试材料
植物材料日本晴以及原核表达载体pET-32a、pGEX-4T-1、pET-22b 由湖南大学生物学院提供;pTriEx-4表达载体为本实验室保存;大肠杆菌菌株DH5α和BL21(DE3)购自湖南擎科生物技术有限公司;293细胞购自武汉普诺赛生命科技有限公司;SPF级雄性SD大鼠(250~270 g)由湖南中医药大学中医诊断研究所提供。
1.1.2 主要设备
T100TMThermal Cycler PCR仪、凝胶成像仪(美国Bio-Rad公司);酶标仪(北京普朗新技术有限公司);JY92-IIN超声波细胞粉碎仪(宁波新芝生物科技股份有限公司);涡旋振荡器(北京鼎国昌盛生物技术有限责任公司);暗箱紫外三用紫外分析仪(上海越众仪器设备有限公司);电热恒温水浴锅(上海精宏实验设备有限公司);CO2培养箱(美国Thermo Scientific公司)。
1.1.3 主要试剂
限制性内切酶 BamHⅠ-HF、EcoRⅠ-HF、SalⅠ、NcoⅠ、XhoⅠ购自 New England BioLabs公司(美国);2×Taq Master Mix购自近岸蛋白质科技有限公司;dNTP、2× Phanta Max Buffer、Phanta Max Super-Fidelity DNA Polymerase、ExnaseⅡ、5× CEⅡbuffer购自诺唯赞生物有限公司;蛋白质marker购自 Thermo Scientific公司(美国);DNA marker、DNA凝胶回收试剂盒、质粒小量提取试剂盒购自广州东盛生物科技有限公司;Ni-NTA柱购自徐州溥博生物科技有限公司。GST单克隆抗体(CSBMA000031M0m)购自华美生物工程有限公司;Anti-6×His Rabbit多克隆抗体(D110002-0100)、HRP-conjugated Goat Anti-mouse IgG(D110087-0025)购自BBI Life Sciences Corporation;HRP-conjugated Goat Anti-rabbit IgG(HS101-01)购自Transgen Biotech 公司;ECL(enhanced chemiluminescence)购自Bio-Rad公司(美国);DMEM培养基购自Sigma公司(美国);FBS(fetal bovine serum)购自 BI公司(以色列);PS(penicillin-streptomycin)、trypsin、OPTIMEM购自Gibco公司(美国);protease inhibitors cocktail(410044)购自Bimake公司(美国);完全佐剂(1002260171)、不完全佐剂(1002679386)购自Sigma公司(美国)。引物合成及测序均由擎科生物技术有限公司完成。
1.2 方法
1.2.1 生物信息分析
进化树分析:通过BLAST找出水稻FLR家族成员,整合其蛋白质序列,将蛋白质序列文件存为.fasta格式,导入MEGA 7软件进行序列比对和进化树分析,得到进化树雏形,保存为.nwk格式,随后于FigTree v1.4.3软件中对进化树进行修饰,即得出进化树分析结果。
蛋白质序列比对:利用DNAMAN 8.0比对FER及其同源性较高的FLR,并采用BioEdit 7.0软件进行图片美化。
结构域预测:从NCBI数据库中获得FLR1(LOC_Os03g21540.1)基因序列,利用TMHMM Server(http://www.cbs.dtu.dk/services/TMHMM/)预测FLR1胞内外结构域。
1.2.2 载体构建
采用酶切连接法或Infusion连接法设计相应引物(表1)。以野生型水稻日本晴幼苗提取的DNA为模板,PCR扩增目的片段,将PCR产物用Infusion或酶切连接法连接到相应载体上,热击转化入宿主菌DH5α,挑取单个菌落培养后,用质粒提取试剂盒提取质粒DNA进行PCR检测及双酶切检测,将检测结果为阳性的重组质粒送擎科生物技术有限公司测序。
1.2.3 重组融合蛋白质的表达
大肠杆菌表达系统:将测序正确的质粒转入大肠杆菌菌株BL21(DE3),挑取单菌落接种到LB液体培养基,37℃、150 r/min培养过夜,分别吸取10 μL(摸索表达条件时取10 μL,确定条件后大量表达时取1 mL)菌液接种于5 mL(大量表达时50 mL)LB/AMP液体培养基中,37℃振荡培养至OD600≈0.6时取诱导前菌液200 μL(大量表达时取1 mL)用于后续检测。加入0.5 mmol/L IPTG,然后分别于不同温度和时间(16℃/16 h、28℃/8 h、37℃/4 h)条件下振荡培养,再取诱导后的菌液200 μL(大量表达时取 1 mL)用于 SDS-PAGE检测。选取最优温度和时间后,摸索不同IPTG浓度(0.5 mmol/L、1 mmol/L、2 mmol/L)对蛋白质表达的影响。
动物细胞表达系统(6孔板):取9 μL Lipofectamine 2000于150 μL OPTI-MEM中稀释,另取3.5 μg质粒 DNA 于 175 μL OPTI-MEM 中稀释,然后将两者按1︰1比例各取150 μL混合制成转染液,室温孵育 5 min。每孔取(0.25~1)×106个293细胞接种于2 mL不含血清和抗生素的DMEM培养基中,同时加入250 μL孵育后的转染液,轻轻摇匀,37℃培养4~6 h后更换为完全培养基,1~3 d后在冰上或4℃裂解细胞[取适当量的裂解液,在使用前数分钟内加入最终浓度为1 mmol/L的苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)和protease inhibitors cocktail备用,而后去除细胞培养液,用PBS洗一遍,每孔加入150~250 μL现配的RIPA裂解液,使裂解液和细胞充分接触],10 000~14 000 g离心 3~5 min,取上清,随后即可进行后续的SDS-PAGE、Western-blot等检测。
SDS-PAGE检测:诱导前后200 μL(或1 mL)菌液离心去上清,随后加入10 μL(或15 μL)ddH2O重悬菌体,再加入 15 μL(或 20 μL)2× SDS loading buffer混匀,95℃加热10 min(至样品不黏稠)。采用10%SDS-PAGE胶进行检测,每孔上样10 μL,设置电压70 V过浓缩胶后改为90 V电泳至溴酚蓝指示剂到胶底部附近即可停止。
Western-blot检测:将蛋白质上清经SDSPAGE电泳后恒流转移到PVDF膜上,然后用5%脱脂奶粉室温封闭1 h,弃封闭液,一抗(His-tag/GST-tag)室温孵育1 h(或4℃过夜),TBST洗膜3次,二抗(羊抗鼠IgG,HRP)室温孵育1 h,TBST洗膜3次,TBS洗膜1次后显影。
1.2.4 蛋白质的纯化及检测

表1 FLR1胞内外结构域连在不同载体上的引物信息及构建方法Table 1 Primer sequences and cloning methods used in this study
按已优化的条件大量(50 mL)表达蛋白质,在离心下来的菌体中加5 mL PBS清洗,离心去上清,再加入7 mL lysis buffer(His标签蛋白质:50 mmol/L pH 8.0 Tris-HCl、300 mmol/L NaCl、10 mmol/L 咪唑,GST标签蛋白质:50 mmol/L pH 8.0 Tris-HCl、150 mmol/L NaCl)、0.1 mmol/L PMSF、0.1 mmol/L溶菌酶重悬;25%功率下超声20 min(开5 s、停10 s)后,4℃条件下3 900 r/min离心10 min,收集上清至10 mL管;取300 μL镍珠/GST珠子,用lysis buffer清洗3次后转入10 mL管,4℃结合过夜;4℃条件下1 000 r/min离心5 min后去上清,加3 mL wash buffer 1(His标签蛋白质:50 mmol/L pH 8.0 Tris-HCl、300 mmol/L NaCl、20 mmol/L 咪唑,GST标签蛋白质:50 mmol/L pH 8.0 Tris-HCl、300 mmol/L NaCl、0.5%Triton X-100)洗涤珠子两次,每次 15 min;离心去上清,加3 mL wash buffer 2(His标签蛋白质:50 mmol/L pH 8.0 Tris-HCl、300 mmol/L NaCl、50 mmol/L咪唑,GST标签蛋白质:50 mmol/L pH 8.0 Tris-HCl、200 mmol/L NaCl)洗涤珠子两次,每次15 min;离心去上清,加3 mL wash buffer 3(His标签蛋白质:50 mmol/L pH 8.0 Tris-HCl、300 mmol/L NaCl、100 mmol/L咪唑)洗涤珠子一次,每次15 min;离心去上清,加300 μL elution buffer(His标签蛋白质:50 mmol/L pH 8.0 Tris-HCl、200 mmol/L 咪唑,GST标签蛋白质:50 mmol/L pH 8.0 Tris-HCl、20 mmol/L GSH)洗3~4 h,离心后上清液即含目的蛋白质。取部分上清进行10%SDS-PAGE和Western-blot检测,剩余样品冻于-80℃。
1.2.5 抗体的制备及验证
准备高浓度和高纯度的目的蛋白质,分3次(每次约150 μg蛋白质)腹腔注射免疫大鼠。初次免疫采用完全佐剂乳化蛋白质,之后每隔一周用不完全佐剂乳化蛋白质分别进行第二、三次免疫。然后从大鼠眼周取血检测抗体效价,达标后对大鼠进行终放血,12 000 r/min离心后取血清冻于-80℃。
将制备的抗体分别与GST-FLR1-BW蛋白和从日本晴水稻的根、茎、叶提取的内源蛋白质样品(取适量水稻根、茎、叶于1.5 mL EP管,加液氮充分研磨后每管加100~200 μL RIPA裂解液混匀,冰上放置30 min,每管加SDS loading buffer于95℃加热10 min,12 000 r/min离心10 min,上清即含内源目的蛋白质)进行杂交,通过Western-blot检测抗体效果。
2 结果与分析
2.1 生物信息分析
为了探究FER和FLR家族的同源性,我们构建了系统进化树,由系统进化树可以看出:FER与FLR1、LOC_Os01g56330.1在同一个分支上,说明这3个蛋白质的亲缘关系更近(图1A)。将这3个蛋白质的序列进行比对,结果如图1B所示:红色区域是相同序列,蓝色区域是相似序列。综合比对红色区域和蓝色区域可得出FLR1与FER高度同源,故在水稻材料中,我们选取了FLR1蛋白进行研究,并预测绘制了FLR1蛋白的结构示意图(图 1C)。
2.2 载体构建
分别将目的片段PCR克隆后连在pET-32a、pGEX-4T-1、pET-22b载体上(FLR1-BN另连p-TriEx-4载体),连接后的重组质粒转入感受态细胞DH5α中,每个样品挑单菌落做PCR及酶切鉴定。结果显示:菌落PCR出现阳性,双酶切也切出了相应的载体片段和目的片段。此外,由于FLR1-BW中含有EcoRⅠ酶切位点,所以FLR1-BW-pET-32a和FLR1-BW-pET-22b分别切出了两条目的带(871 bp、501 bp,845 bp、502 bp),这与预期结果一致(图2)。上述结果表明7个重组质粒构建成功。同时,测序结果显示序列均无误,可用于后续实验。
2.3 原核表达载体诱导表达条件的优化
2.3.1 温度条件优化
将测序正确的质粒转化到BL21(DE3),并在LB平板上挑选单个菌落于LB液体培养基进行培养,然后在37℃下加入0.5 mmol/L的IPTG诱导表达,结果表明FLR1-BW可以表达,而FLR1-BN没有表达。为了探明表达的最优条件,将FLR1-BN和FLR1-BW分别置于16℃/16 h、28℃/8 h和37℃/4 h条件下进行诱导表达,结果显示:3个FLR1-BN 蛋白(分别对应 pET-32a、pGEX-4T-1、pET-22b表达载体)与1个FLR1-BW蛋白(pET-22b表达载体)均未诱导成功。通过细胞毒性实验发现3个未表达的FLR1-BN会对大肠杆菌产生毒性(图3A),而FLR1-BN(pTriEx-4表达载体)在293细胞中能够表达。此外,两个FLR1-BW蛋白(分别对应pET-32a、pGEX-4T-1表达载体)于16℃、28℃、37℃都能成功表达,其中FLR1-BW-His蛋白(pET-32a表达载体)于16℃表达量最大;GSTFLR1-BW蛋白(pGEX-4T-1表达载体)在3个不同温度/时间下表达效果差别不明显,因此后续选择16℃/16 h表达这两个蛋白质(图3B、3C)。
2.3.2 IPTG浓度优化

图1 生物信息分析(A)拟南芥FER与水稻FLR家族的进化树分析;(B)FER和同源性较高的FLR蛋白的序列比对;(C)FLR1蛋白的结构示意图。序列相似程度:红色>蓝色>灰色。Fig.1 Biological information analysis(A)Phylogenetic tree of AtFER and OsFLR family;(B)Sequence alignment of FER and high-homology FLR;(C)Schematic diagram of FLR1 protein structure.Degree of sequence similarity:Red>blue>gray.
选择最佳温度/时间后,设置不同IPTG浓度(0.5 mmol/L、1 mmol/L、2 mmol/L)诱导表达 FLR1-BW-His(pET-32a表达载体)和GST-FLR1-BW(pGEX-4T-1表达载体),结果显示:不同IPTG浓度对这两个蛋白质的表达效果影响不大(图4)。综合考虑成本和实验目的,我们择优选取0.5 mmol/L IPTG进行后续诱导表达。
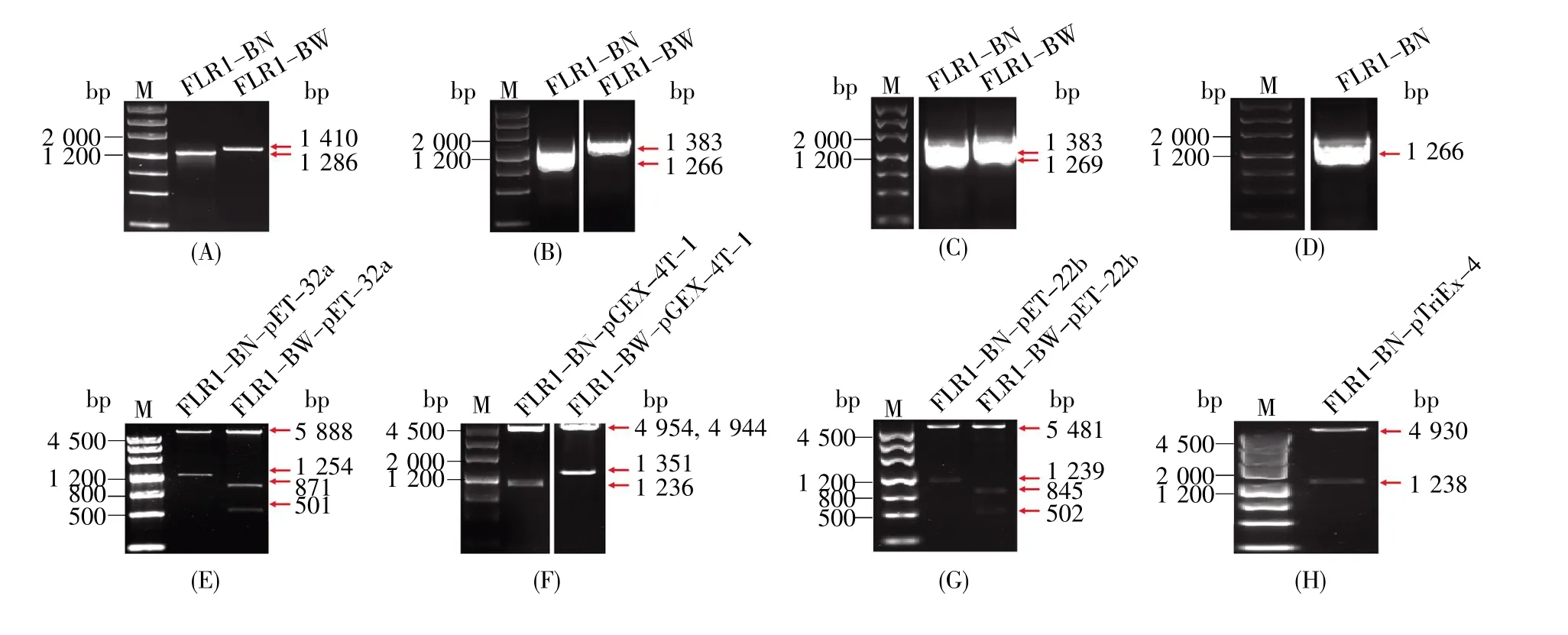
图2 目的片段PCR克隆及重组质粒双酶切鉴定结果(A)FLR1-BN、FLR1-BW连接pET-32a载体后的PCR结果;(B)FLR1-BN、FLR1-BW连接pGEX-4T-1载体后的PCR结果;(C)FLR1-BN、FLR1-BW连接pET-22b载体后的PCR结果;(D)FLR1-BN连接pTriEx-4载体后的PCR结果;(E)FLR1-BN-pET-32a和FLR1-BW-pET-32a的酶切图;(F)FLR1-BN-pGEX-4T-1和FLR1-BW-pGEX-4T-1的酶切图;(G)FLR1-BN-pET-22b和FLR1-BW-pET-22b的酶切图;(H)FLR1-BN-pTriEx-4的酶切图。M泳道均为marker 3。Fig.2 PCR cloning of the inserts and double restriction enzyme digestion of the recombinant plasmids(A)PCR results of FLR1-BN and FLR1-BW(cloned in pET-32a);(B)PCR results of FLR1-BN and FLR1-BW(cloned in pGEX-4T-1);(C)PCR results of FLR1-BN and FLR1-BW(cloned in pET-22b);(D)PCR result of FLR1-BN(cloned in pTriEx-4);(E)Digestion of FLR1-BN-pET-32a and FLR1-BW-pET-32a;(F)Digestion of FLR1-BN-pGEX-4T-1 and FLR1-BW-pGEX-4T-1;(G)Digestion of FLR1-BN-pET-22b and FLR1-BW-pET-22b;(H)Digestion of FLR1-BN-pTriEx-4.Lane M in the(A)~(H)is marker 3.

图3 细胞毒性实验与不同温度和时间诱导蛋白质表达的结果(A)将FLR1-BN-pTriEx-4质粒转入DH5α,涂布于加有AMP和(AMP+IPTG)的平板中测试其细胞毒性;(B)FLR1-BW-His蛋白(pET-32a载体)在16℃/16 h、28℃/8 h、37℃/4 h条件下的表达结果。M:蛋白质marker 26614;(C)GST-FLR1-BW蛋白(pGEX-4T-1表达载体)在16℃/16 h、28℃/8 h、37℃/4 h条件下的表达结果。M:蛋白质marker 26614。Fig.3 Cytotoxicity test and protein expression at different temperatures and induction times(A)FLR1-BN-pTriEx-4 was transformed into DH5α and the bacterial cells were incubated on AMP and(AMP+IPTG)plates to test its toxicity to cells;(B)Expression of FLR1-BW-His(pET-32a vector)under conditions of 16℃/16 h,28℃/8 h and 37℃/4 h,respectively.M:Protein marker 26614;(C)Expression of GST-FLR1-BW(pGEX-4T-1 vector)under conditions of 16℃/16 h,28℃/8 h and 37℃/4 h,respectively.M:Protein marker 26614.
2.4 蛋白质的表达与纯化
将含有目的蛋白质的上清液与镍珠(GSH琼脂糖珠)结合并最终用200 mmol/L的咪唑(20 mmol/L GSH)进行洗脱,通过10%SDS-PAGE电泳及Western-blot检测,结果显示:FLR1-BW-His(pET-32a表达载体)和GST-FLR1-BW成功纯化,得到了浓度及纯度均较好的蛋白质(图5A、5C)。同时,FLR1-BN-His(pTriEx-4表达载体)通过转染到动物细胞293中也实现了成功表达(图5B)。
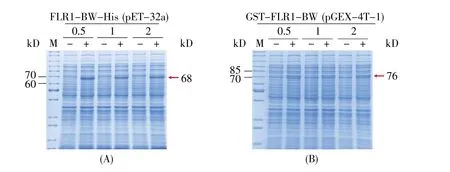
图4 不同IPTG浓度诱导蛋白质表达的结果(A)FLR1-BW-His(pET-32a载体)在0.5/1/2 mmol/L IPTG条件下的表达结果。M:蛋白质marker 26614;(B)GST-FLR1-BW在0.5/1/2 mmol/L IPTG条件下的表达结果。M:蛋白质marker 26614。Fig.4 Protein expression with different IPTG concentrations(A)Expression of FLR1-BW-His(pET-32a vector)at 0.5/1/2 mmol/L IPTG.M:Protein marker 26614;(B)Expression of GSTFLR1-BW at 0.5/1/2 mmol/L IPTG.M:Protein marker 26614.

图5 蛋白质表达纯化的检测结果(A)FLR1-BW-His纯化后的考马斯亮蓝染色(M:蛋白质marker 26614)及Western-blot检测(His抗体1︰5 000稀释,M:蛋白质预染marker 26616)。FT:FLR1-BW-His未纯化上清;W1-1:用wash buffer 1洗涤第一次的上清;W1-2:用wash buffer 1洗涤第二次的上清;W2-1:用wash buffer 2洗涤第一次的上清;W2-2:用wash buffer 2洗涤第二次的上清;W3:用wash buffer 3洗涤的上清;(B)293细胞表达FLR1-BN-His的Western-blot检测(His抗体1︰5 000稀释)。M:蛋白质预染marker 26616,Control:293细胞的总蛋白质;(C)GST-FLR1-BW纯化后的考马斯亮蓝染色(M:蛋白质marker 26614)及Western-blot检测(GST抗体1︰5 000稀释,M:蛋白质预染marker 26616)。FT:GST-FLR1-BW未纯化上清;W1-1:用wash buffer 1洗涤第一次的上清;W1-2:用wash buffer 1洗涤第二次的上清;W2-1:用wash buffer 2洗涤第一次的上清;W2-2:用wash buffer 2洗涤第二次的上清。Fig.5 Protein expression and purification(A)Coomassie brilliant blue staining(lane M is protein marker 26614)and Western-blot identification(anti-His 1︰5 000,lane M is protein marker 26616)of FLR1-BW-His after purification.FT:The supernatant of unpurified FLR1-BW-His.W1-1:The first time supernatant of washed beads with wash buffer 1.W1-2:The second time supernatant of washed beads with wash buffer 1.W2-1:The first time supernatant of washed beads with wash buffer 2.W2-2:The second time supernatant of washed beads with wash buffer 2.W3:The supernatant of washed beads with wash buffer 3;(B)Western-blot identification of FLR1-BNHis expressed in 293 cells(anti-His 1︰5 000).M:Protein marker 26616.Control:Total proteins of 293 cells;(C)Coomassie brilliant blue staining(lane M is protein marker 26614)and Western-blot identification(anti-GST 1︰5 000,lane M is protein marker 26616)of GST-FLR1-BW after purification.FT:The supernatant of unpurified GST-FLR1-BW.W1-1:The first time supernatant of washed beads with wash buffer 1.W1-2:The second time supernatant of washed beads with wash buffer 1.W2-1:The first time supernatant of washed beads with wash buffer 2.W2-2:The second time supernatant of washed beads with wash buffer 2.

图6 FLR1抗体的验证结果按照1︰4 000的效价来检测FLR1抗体识别纯化蛋白质(A)和内源性蛋白质(B)的效果;M均为蛋白质预染marker 26616。Fig.6 Validation of anti-FLR1 antibodyThe purified protein(A)and endogenous proteins(B)were recognized by FLR1 antibody(1︰4 000).Lane M is protein marker 26616.
2.5 抗体验证
大量表达并纯化GST-FLR1-BW以用于制备抗体,得到抗体后利用纯化的蛋白质和水稻根、茎、叶内源蛋白质进行验证,结果显示:用FLR1多克隆抗体检测GST-FLR1-BW蛋白只有单一的条带,特异性较好,与GST抗体效果相当(图6A);用FLR1多克隆抗体检测水稻根、茎、叶内源蛋白质时,能够在130 kD附近检测到FLR1蛋白(图6B),表明FLR1多克隆抗体制备成功,可用于后续FLR1蛋白功能等方面的研究。
3 小结与讨论
FER基因在双子叶植物拟南芥的生长发育过程中发挥着重要作用。单子叶植物水稻中的FER同源基因FLR可能也参与调控水稻的生长发育。文中通过系统进化树分析和序列比对选取FLR1进行研究,以期为后续探讨FLR1在调控水稻方面的作用奠定基础。将FLR1分段连接于不同载体后进行表达纯化并制备抗体,发现FLR1-BN-His或GST-FLR1-BN蛋白在大肠杆菌BL21(DE3)表达系统中均未有效表达,这可能是由于胞内结构域属于激酶功能结构域,蛋白质表达后具有一定的细胞毒性,会使得大肠杆菌的存活率下降,而换用293细胞表达系统则能够有效地表达FLR1-BN-His,说明在细菌难以表达得到的蛋白质可以采用动物细胞表达系统作为备选策略。与此同时,构建到pET-22b载体上的FLR1-BWHis和FLR1-BN-His蛋白在大肠杆菌BL21(DE3)表达系统中也均未表达出来,这可能是由于pET-22b载体含有PelB信号肽序列,会将表达的目的蛋白质分泌到细胞外。与上述蛋白质的表达结果不同,FLR1-BW-His(构于pET-32a载体)或GST-FLR1-BW在100 r/min、16℃/16 h条件下可实现较好的诱导表达,说明在低温和较低转速下能够有效表达某些受体激酶的胞外结构域。此外,本研究结果显示蛋白质表达后能够纯化出较纯的目的蛋白质,说明纯化条件适宜。进一步的抗体制备也得到了较高质量的抗体,说明高浓度及高纯度的FLR1蛋白能够有效地使大鼠免疫,获得高质量的抗体。
水稻和拟南芥分别属于单子叶植物和双子叶植物,两者的形态结构存在差异。在拟南芥中,已有相关研究阐明FER的一些重要功能,而水稻中FLR的功能还处于起步阶段,因此亟待系统地挖掘FLR的功能。本研究以FLR家族成员的一个蛋白质FLR1为研究目标,通过分段表达的策略将FLR1胞内外结构域进行了有效的表达,并获得了高质量的抗体,该策略为受体蛋白激酶的蛋白质表达纯化及抗体制备提供了参考,也为后续的深入研究提供了基础。

