原发性肝癌ATM基因启动子甲基化及其与放疗疗效的相关性
颜新建,李高峰*,吴添雨,袁仕善,张慧慧,杨小平
(1.中南大学湘雅医学院附属株洲医院肿瘤科,中国湖南株洲412000;2.小分子靶向药物研究与创制湖南省重点实验室湖南师范大学医学院,中国湖南长沙410013)
共济失调-毛细血管扩张突变基因(ataxia-telangiectasia mutated gene,ATM)作为一个抑癌基因和DNA修复基因在肿瘤中研究广泛,其参与细胞周期调控、DNA损伤识别和修复,与肿瘤发病机制、细胞放射敏感性关系密切[1~2]。DNA甲基化是表观遗传修饰的主要方式之一[3],目前研究报道多个瘤种如乳腺癌、脑胶质瘤、结肠癌等存在ATM基因启动子异常甲基化[4~5],且ATM基因启动子异常甲基化与肿瘤放射敏感性密切相关[6]。本课题组前期研究也发现ATM基因与原发性肝癌发病机制及辐射增敏相关[7~8],但其内在原因尚不清楚,而有关肝癌ATM基因启动子甲基化的研究暂未见报道,因此我们就原发性肝癌ATM基因启动子甲基化状态及其与放疗疗效的相关性进行了研究。
1 材料与方法
1.1 研究对象
从中南大学湘雅医学院附属株洲医院病理科选取2016年6月至2018年6月的肝癌手术切除标本及相应的癌旁肝组织共50对,包括男性38例,女性12例,患者年龄在35~73岁之间,平均年龄53.2±3.2岁,其中肝癌合并肝硬化患者25例,肝癌合并肝硬化患者中Child-Pugh A级者13例,Child-Pugh B级者6例,Child-Pugh C级者6例;同时收集20例正常肝组织。另外,随机收集2017年8月至2018年10月在我院肿瘤科住院的局部中晚期肝癌肝穿刺标本38例,入组标准:1)病理检查确诊为肝细胞癌;2)年龄在18~70岁;3)TNM分期为IIb期、IIIa期、IIIb期之一。排除标准:1)病理检查诊断肝癌为胆管细胞型或混合型;2)临床分期为IV期,且存在全身多处转移;3)治疗开始前KPS评分低于70分,预计不能耐受全程放疗者;4)证实肿瘤原发灶非肝脏,由其他部位转移至肝脏者;5)患者及家属不同意进入试验。每个穿刺标本取2~3条合格组织置于-80℃冰箱保存待用。以上组织的病理结果均经我院两位高年资病理科医生确认。实验组与对照组的年龄、性别等参数经比较无显著性差异。本实验经过患者及家属的口头知情同意,并在医院伦理委员会审核批准下进行。
1.2 材料
石蜡包埋组织DNA提取试剂盒、DNA重亚硫酸盐转化试剂盒、甲基化特异性PCR试剂盒均购自北京天根生化科技有限公司。人甲基化和非甲基化DNA标准品购自上海联迈生物工程有限公司。
1.3 DNA提取及重亚硫酸盐修饰
根据石蜡包埋组织DNA提取试剂盒操作说明书提取样品DNA,采用酶标仪测定OD260/OD280值,比值在1.7~1.9之间视为合格,所提取DNA的质量用1%琼脂糖凝胶电泳鉴定。取合格DNA样品1 000 ng,按照DNA重亚硫酸盐转化试剂盒操作方法进行重亚硫酸氢钠转化,转化后用独特的吸附柱技术完成DNA纯化,随后回收样品。
1.4 甲基化特异性聚合酶链式反应(methylation-specific PCR,MSP)及DNA电泳
实验按照甲基化特异性PCR试剂盒操作方法进行。首先设计两对特异扩增引物,引物序列用Methprimer软件设计,并预测CpG岛位置;甲基化引物:上游 5'GTTTTCGTTAGAGAAAGAAAGGC3',下游 5'CAATAACCAACGACTTAACG3';非甲基化引物:上游5'GTTTTTGTTAGAGAAAGAAAGGTG3',下游 5'CAATAACCAACGACTTAACG3'。MSP 反应体系(总共 20 μL):DNA 模板 2 μL,上下游引物(浓度 10 μmol/L)各 1 μL,MSP DNA polymerase 0.4 μL,10× MSP PCR buffer 1.7 μL,dNTPs 1.4 μL,ddH2O补足至20 μL。PCR反应程序:95℃ 5 min→(94℃ 20 s,57℃ 30 s,72℃20 s)×35 cycles→72℃ 5 min。反应设置空白对照组(ddH2O组)、甲基化对照组及非甲基化对照组,甲基化对照组所用DNA模板为完全甲基化的DNA标准品,非甲基化对照组所用DNA模板为非甲基化的DNA标准品。反应产物用1%琼脂糖凝胶电泳分析,用天能紫外光系统拍照。
1.5 亚硫酸氢盐处理后的测序验证
采用BSP(bisulfite sequencing PCR)法对肝癌组织甲基化状态进行测序验证(委托上海欧易生物医学科技有限公司实施),比对测序结果与电泳结果,证实有无甲基化,并判断甲基化程度。
1.6 放射治疗方案与疗效评价体系
由我院肿瘤科两位副高及以上职称医师对38例局部中晚期原发性肝癌患者制定放疗计划,靶区勾画原则:大体肿瘤体积(gross tumor volume,GTV)为影像学确认的肿瘤靶病灶,临床靶区(clinical tumor volume,CTV)为在GTV基础上外扩1.0 cm,计划靶体积(planning target volume,PTV)为在CTV基础上向上下扩2.0 cm,左右扩1.0 cm,细节稍加修改。38例肝癌患者均接受适形调强放疗,放疗处方:总剂量60 Gy,每次2 Gy,1次/日,5次/周。放疗过程中为增加放疗敏感性,予以“顺铂40 mg/m2ivgtt D1”治疗,每周一次,共用6周;放疗过程中每周监测血象、肝肾功能等,并行护肝及对症支持治疗。
放疗结束一个月后进行初始放疗疗效评估,初始评价一个月后再次复查肝脏MRI(magnetic resonance imaging)或 CT(computed tomography)增强等,综合两次复查结果完成总体疗效评价。评价体系采用国际通用EASL(European Association for the Study of the Liver)疗效评价标准,即完全缓解(complete response,CR):所有存活肿瘤完全消失,治疗区域没有新发病灶,至少持续4周;部分缓解(partial response,PR):所有可测量病灶总的存活肿瘤负荷缩小50%以上,至少持续4周;病情稳定(stable disease,SD):所有不符合 CR、PR、PD的情况;疾病进展(progressive disease,PD):一个或多个目标病灶的存活肿瘤增大超过25%,或在治疗区域有新的病灶出现。
1.7 统计学分析
采用SPSS 21.0软件进行统计分析,计数资料用χ2检验,相关性分析用Spearman检验,显著性水平为 P<0.05。
2 实验结果
2.1 ATM基因启动子甲基化分析
甲基化对照使用全甲基化人DNA作为模板,只扩增出甲基化条带(M带);非甲基化对照只扩增出非甲基化条带(U带)。根据是否扩增出相应条带判断样本有无甲基化,即样本扩增出M带判为有甲基化,样本扩增出U带判为无甲基化,两条带均有判为部分甲基化。BSP测序结果显示,存在ATM基因启动子甲基化的样本其CpG岛胞嘧啶(C-CH3)经重亚硫酸氢盐转换后不会转化成胸腺嘧啶(T),而无ATM基因启动子甲基化的样本其CpG岛胞嘧啶(C)经重亚硫酸氢盐处理后转化成胸腺嘧啶(T)。测序结果与电泳结果相一致,证实结果可靠。
MSP检测发现肝癌组织存在ATM基因启动子异常甲基化(包括完全甲基化和部分甲基化),甲基化率达39.8%。50例肝癌手术标本中,19例(占38%)存在ATM基因启动子甲基化,相应癌旁肝组织仅4例(占8.0%)存在ATM基因启动子甲基化;38例肝癌穿刺标本有16例(占42.1%)存在ATM基因启动子甲基化;正常肝组织无ATM基因启动子甲基化。统计分析结果显示,ATM基因启动子甲基化在肝癌组织中的发生率与癌旁肝组织和正常肝组织相比具有显著性差异(χ2=24.818,P<0.05)。代表性分析结果见图1和图2。
2.2 ATM基因启动子甲基化与临床特征的关系
ATM基因启动子甲基化与患者年龄、性别、临床分期、AFP(alpha fetoprotein)水平、门脉癌栓、肿瘤直径、组织分化水平无明显相关性,但与肝硬化、Child-Pugh分级显著相关,具体结果见表1。
2.3 ATM基因启动子甲基化与肝癌放疗疗效的相关性
38例局部中晚期肝癌患者中,16例存在ATM基因启动子甲基化,其中完全缓解(CR)1例,部分缓解(PR)7例,放疗有效率50.0%;22例ATM基因启动子无甲基化,其中完全缓解(CR)0例,部分缓解(PR)3例,放疗有效率13.6%。统计分析结果显示,存在ATM基因启动子甲基化的患者其放疗疗效明显优于无甲基化的患者,差异具有统计学意义(χ2=5.955,P=0.015)。Spearman 检验结果显示ATM基因启动子甲基化与肝癌放疗疗效呈显著正相关(r=0.396,P=0.014),而Child-Pugh分级、肝硬化、门脉癌栓与肝癌放疗疗效无明显相关性,具体结果见表2和表3。

图1 部分样本ATM基因启动子甲基化状态示例Marker:标准蛋白质;1~2:肝癌手术组织;3:肝癌穿刺活检组织;4:癌旁肝组织;5:甲基化对照;6:非甲基化对照;M:甲基化条带;U:非甲基化条带。Fig.1 Methylation status of ATM gene promoter in several samplesMarker:Standard protein;1~2:HCC surgical tissues;3:HCC puncture biopsy specimen;4:HCC corresponding paracancerous tissue;5:Methylated control;6:Unmethylated control;M:Methylation band;U:Unmethylation band.
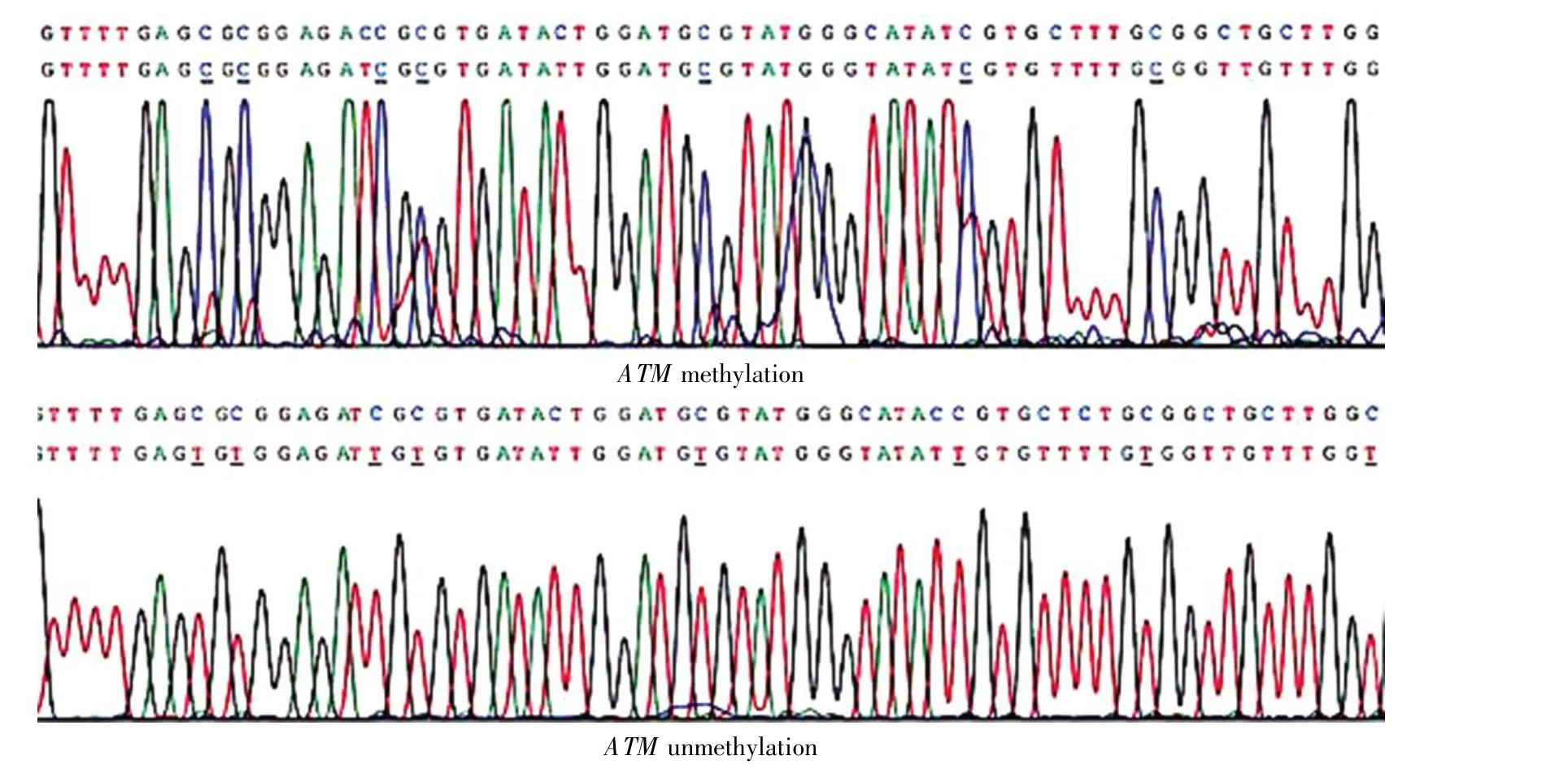
图2 部分肝癌样本的BSP结果ATM methylation:ATM基因甲基化,经重亚硫酸盐转化后胞嘧啶(C)不变;ATM unmethylation:ATM基因非甲基化,经重亚硫酸盐转化后胞嘧啶(C)变成胸腺嘧啶(T)。Fig.2 BSP results of partial HCC specimensATM methylation:Cytosine(C)unchanged after heavy sulfite transforming;ATM unmethylation:Cytosine(C)converted to thymine(T)after heavy sulfite transforming.
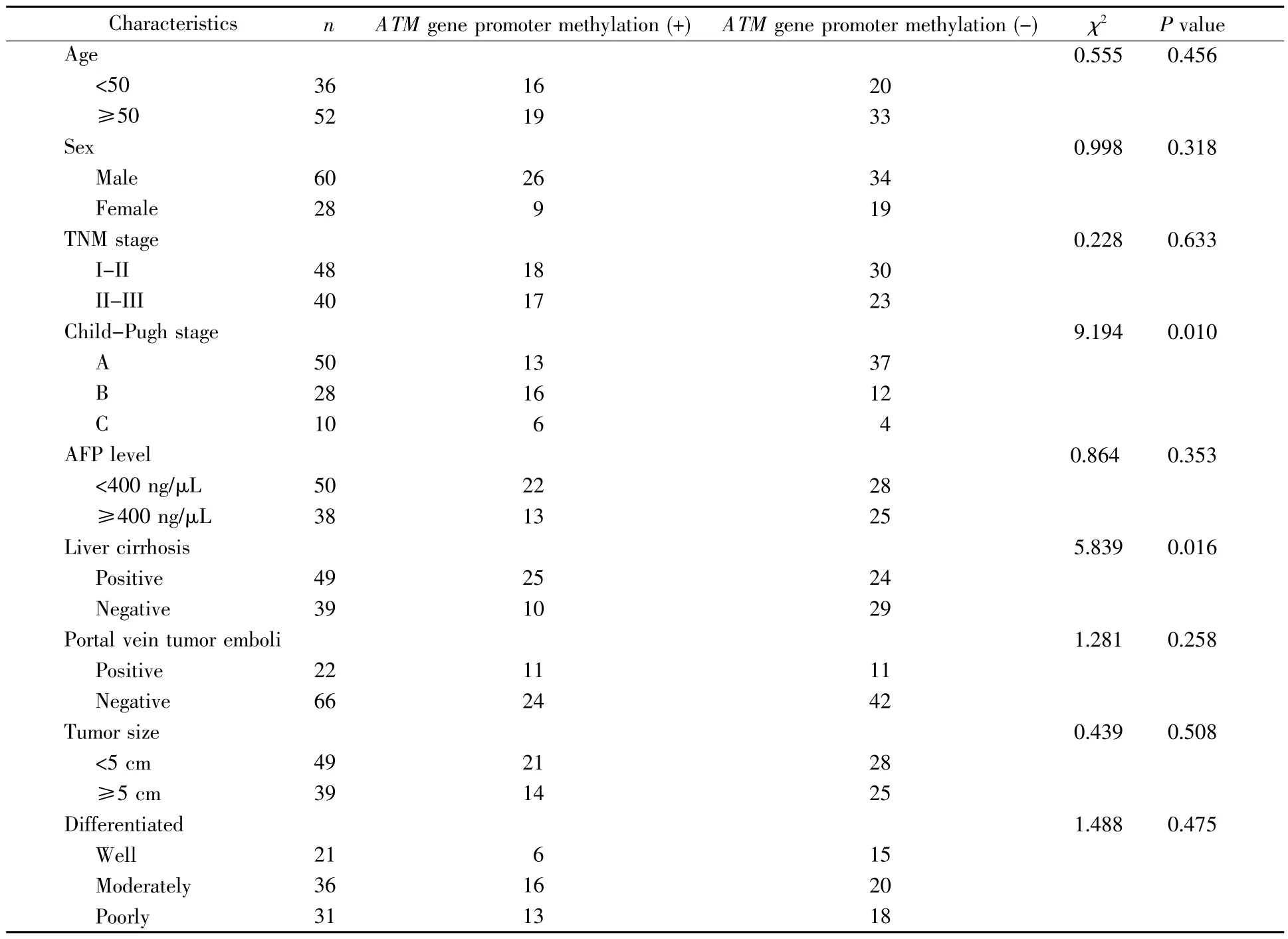
表1 肝癌组织ATM基因启动子区甲基化与临床病理特征的关系Table 1 Relationship between methylation status of ATM promoter and clinical characteristics in HCC
3 讨论
原发性肝癌是我国常见的恶性肿瘤之一,也是在我国发病率中居第4位的恶性肿瘤[9]。肝癌在诊断时多偏中晚期,其进展快、预后差等,防治形势不容乐观。目前肝癌的发病机制仍不完全清楚,原癌基因的激活和(或)抑癌基因的失活是细胞失去正常生长调控而恶变的分子基础。ATM基因是少见病共济失调毛细血管扩张症(ataxia telangiectasia,AT)的致病基因,但作为一个抑癌基因和DNA修复基因在肿瘤发病及辐射增敏中研究广泛。ATM基因编码的ATM蛋白激酶是细胞DNA损伤反应的中心元件,特别是对于放射线引起的DNA双链断裂,它能识别DNA损伤信号,快速将RAD50/MRE11/NBS1复合物募集到断裂损伤部位,并激活下游一系列分子如组蛋白H2AX、染色体结构维持蛋白1(structural maintenance chromosome 1,SMC1)、细胞周期检测点激酶1/2(cell cycle checkpoint kinase 1/2,CHK1/2)、P53 等,介导数条信号通路,从而修复DNA损伤,维持细胞基因组的稳定性[10]。ATM蛋白激酶还可以活化核转录因子NF-κB信号通路,使受损伤细胞基因组的稳定性增加,从而导致肿瘤细胞过度生长和肿瘤细胞对放化疗抵抗性的增加。ATM基因功能缺失或沉默可以通过下调ATM蛋白激酶功能使细胞DNA损伤修复机制障碍,对于放射线引起的DNA双链断裂不能及时反应、修复,从而导致细胞对放射线高度敏感。抑癌基因启动子甲基化被认为是抑癌基因表达异常中除突变和缺失外的第三种分子机制[11]。研究报道,多种肿瘤细胞存在ATM基因启动子异常甲基化。Delmonico等[12]研究发现乳腺癌病人组织及血液、唾液细胞中均存在ATM基因启动子异常甲基化,且组织中ATM基因启动子甲基化率最高;Mehdipour等[4]研究发现在不同类型脑肿瘤中73%的组织样本存在ATM基因启动子甲基化,且这些样本中ATM蛋白低表达。需要指出的是,Cao等[13]对乳腺乳头状癌患者和正常对照者的外周血进行ATM基因启动子甲基化状态检测时发现,两组ATM基因启动子的甲基化率无明显区别,该研究认为血清ATM基因启动子甲基化尚不能作为乳腺癌的诊断标志物。该研究得出阴性结果可能是因为血清中游离DNA与病变组织DNA在含量及稳定性上相差很大,提取DNA技术亦有差别,当基因甲基化水平不高或仅存在部分甲基化时,外周血标本很有可能出现阴性结果,此时其真实的ATM基因启动子甲基化状态未能体现。

表2 不同甲基化状态的局部中晚期肝癌患者放疗疗效统计Table 2 Radiotherapy efficacy statistics of locally advanced HCC patients with different methylation status

表3 Spearman检验ATM基因启动子甲基化等与肝癌放疗疗效的相关性Table 3 The correlation between ATM gene promoter methylation etc.and radiotherapy efficacy for HCC determined by Spearman test
原发性肝癌中ATM基因启动子甲基化情况如何?首先,本研究利用Methprimer软件设计ATM基因甲基化和非甲基化特异性引物,预测ATM基因CpG岛位置,发现人ATM基因启动子的CpG岛位于第11号染色体(108 222 097~108 222 457),长约361 bp,CG含量超过50%。此外,本研究结果显示原发性肝癌中ATM基因启动子CpG岛存在异常甲基化,总体甲基化率达39.8%,而癌旁肝组织的ATM基因启动子甲基化率极低,正常肝组织则无ATM基因启动子甲基化,肝癌中ATM基因启动子甲基化率明显高于癌旁肝组织和正常肝组织,差异具有统计学意义(χ2=24.818,P<0.05,图 1),这与文献研究结果[4,12]基本一致。以上信息提示ATM基因启动子出现甲基化是肝癌发生、发展过程中一个重要的分子事件,各种致病因素导致的ATM基因启动子异常甲基化可通过抑制转录因子及转录辅助因子结合到转录部位等多种机制使转录抑制,造成ATM基因低表达或沉默,导致细胞生长调控紊乱和DNA损伤修复障碍,使肝癌高危人群肿瘤易感性增加[14]。本研究进一步发现,对于ATM基因启动子甲基化率,合并肝硬化的肝癌患者显著高于不合并肝硬化的肝癌患者(χ2=5.839,P=0.016),Child-Pugh C级、Child-Pugh B级肝癌患者显著高于Child-Pugh A级肝癌患者(χ2=9.194,P=0.010,表1),并且出现了Child-Pugh C级>Child-Pugh B级>Child-Pugh A级逐级递增的现象。其中,合并肝硬化的肝癌患者ATM基因启动子甲基化率较高可能与持续乙肝病毒感染以及肝脏长期发生炎症、免疫反应等有关。此外,在合并肝硬化的肝癌患者中ATM基因启动子甲基化水平随着Child-Pugh分级增加而增加,提示ATM基因发生异常甲基化可能是肝癌发生的早期事件,甚至在肝硬化阶段就开始出现启动子CpG岛胞嘧啶(C)甲基化修饰,ATM基因启动子CpG岛异常甲基化使ATM基因功能异常,引发多种机制综合作用,最终导致肿瘤的发生、进展。
ATM基因启动子甲基化与放射敏感性关系密切[1~6]。Roy等[6]研究发现存在ATM基因启动子甲基化的胶质瘤细胞相较于无甲基化的细胞其放射敏感性提高2倍以上。本研究也发现存在ATM基因启动子甲基化的肝癌患者其放疗疗效明显优于无甲基化的患者,差异具有统计学意义(χ2=5.955,P=0.015,表2),而且Spearman检验显示ATM基因启动子甲基化与肝癌放疗疗效呈显著正相关关系(r=0.396,P=0.014,表3),这很可能与ATM基因功能异常有关。抑癌基因启动子甲基化可以通过抑制转录过程等引起基因沉默,ATM基因作为一个抑癌基因可以通过上述机制被诱导沉默。同时,作为一个DNA修复基因,ATM基因低表达或沉默使细胞DNA损伤修复障碍,这样细胞对放射线引起的DNA双链断裂不能及时反应、修复,导致放疗引起的细胞死亡量成倍增加,最终使病人的放疗疗效明显提高。如果能利用ATM基因启动子甲基化状态差异这一切入点筛选出高放射敏感性的肝癌病人,甚至将ATM基因作为放射增敏靶点,开发靶向辐射增敏药物,这将对肝癌防治具有十分重大的意义,但因本实验研究对象偏少,且治疗过程中影响因素较多,结果还有待进一步完善。
总之,本研究在较多人体肝癌组织标本上检测了ATM基因启动子甲基化状态,分析了其与肝癌临床特征的关系及与放疗疗效的相关性,发现原发性肝癌ATM基因启动子区存在异常甲基化,ATM基因启动子甲基化状态与肝癌放疗疗效关系密切,可为筛选放射敏感差异病人提供新的思路。

