纳米药物载体的结构修饰实现内体逃逸
李成龙,李荣烨,云 鹏,张冠宏,郗来顺,王元斗,宿 烽
(1.青岛科技大学化工学院,山东 青岛 266042)(2.胜利油田中心医院,山东 东营,257000)
1 前 言
纳米载体作为一种亚微粒输送系统,能大大提高药物的吸收度和稳定性,改善药物性质和靶向性,加快基因转染速率,延长作用时间,增加疗效,已广泛应用于肿瘤、血管疾病的治疗[1, 2]。目前广泛应用的纳米载体主要包括胶束、脂质体、树枝状大分子、聚合物纳米颗粒等[1, 3, 4],其包载药物进入机体,通过调节载体的表面电荷、粒径大小或与相应配体结合等方式突破细胞膜[5, 6];在跨膜过程中形成内涵体,随着内涵体被溶酶体内吞,进入到溶酶体[3, 4, 7]。一般载体会因为在内体中的长时间停留,由于内涵体/溶酶体内酸性环境(pH约4.0~6.0)及大量酶的存在导致载体水解,造成包载物质的渗漏,改变其结构、稳定性,严重影响所包载药物的治疗效果[8, 9],如图1所示。因此,针对内体逃逸的机制,研究人员对药物载体材料进行结构修饰,从而达到内体逃逸的目的,提高药物疗效,降低药物毒副作用[10]。
2 药物载体内体逃逸的方式
药物载体经过内吞进入细胞,由于内吞胞质的pH值从早期内涵体(pH 5.5~6.5)到晚期内涵体(pH 4.5~5.5),最后到溶酶体(pH<5),呈现出逐渐降低的过程[11],因此,药物载体可通过与内体逃逸剂结合实现内体逃逸。常用内体逃逸剂如表1所示。
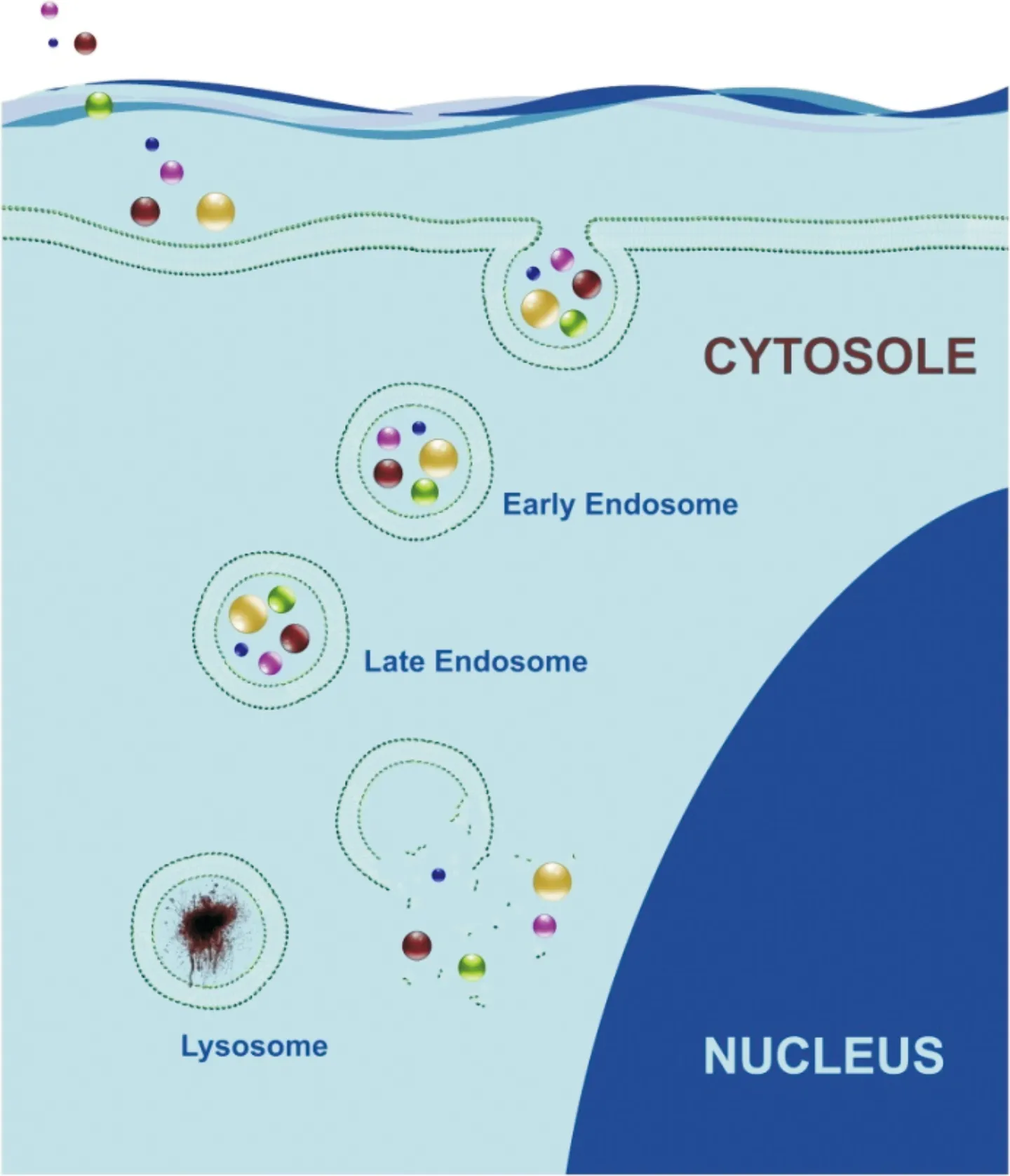
图1 胞吞及内体逃逸示意图[7]:通过内吞途径进入细胞的粒子被包裹在小泡中,形成早期内涵体、晚期内涵体,最后发展为溶酶体。在此过程中胞内物质实现内体逃逸,发挥作用;反之,在溶酶体中被酶降解Fig.1 Schematic of endocytosis and endosomal escape[7]:particles entered the cells via the endocytic pathway become entrapped in the visicles, the vesicles matured form early endosomes and late endosomes and eventually end up in the lysosome, the particles are effective by achieving the endosome escape; otherwise, enzymatic degradation processes take place
2.1 利用质子化效应胀破内体膜
质子化效应是通过具有高缓冲能力的质子化剂介导,在质子化时,能够自由膨胀,使得内体内渗透压升高,引起大量的水和离子内流进入内体,导致内体膜胀破,从而将内体内包裹的物质释放,实现内体逃逸[12],如图2所示。有研究表明,叔胺基团能在酸性条件下吸附质子,使物质免受酸性环境的影响,同时其质子化介导能力会增大内体渗透压,胀破内体膜,将物质从内体中释放出来[13]。另有研究表明,富含组氨酸的分子由于咪唑基的存在,具有很好的质子介导作用,也会导致内体膜的破裂[14]。
2.2 通过膜的融合实现跨膜
另一种内体逃逸机制是实现膜的融合,降低内体膜的稳定性[12]。对细胞而言,细胞膜由磷脂双分子层构成,膜内是疏水环境,而膜两侧为水环境。而α-螺旋类似于DNA双螺旋,具有NCCNCCNCC骨架结构,能够将疏水基团放在骨架外侧,将亲水基团置于内侧,膜蛋白能够以α-螺旋实现单次或多次跨膜[15]。
2.3 通过形成膜孔穿过内体膜
通常,孔的形成是基于膜张力和线张力之间的相互作用(图3)。膜张力大形成孔,线张力大关闭孔。多肽的一些组件和孔的边缘具有较高的亲和力,故将多肽结合到聚合物表面可以减少线张力,从而增加孔的形成数量,保持孔径的稳定[16]。如将阳离子两亲性多肽(AMPs)与脂质双分子层结合即会导致其内部应力和内膜张力的增加,足够使膜形成孔隙[17]。Kim等[18]报道了一种细胞质穿透抗体TMab4,其在酸性环境下会发生构象的变化,导致内体膜孔的形成,从而实现内体逃逸。为研究其内体逃逸行为,用TMab4脉冲Hela细胞,随后用不同内体标记物进行染色,结果表明在内吞2 h后,TMab4出现在内体中,在6 h后,逃逸到细胞质中,实现逃逸。
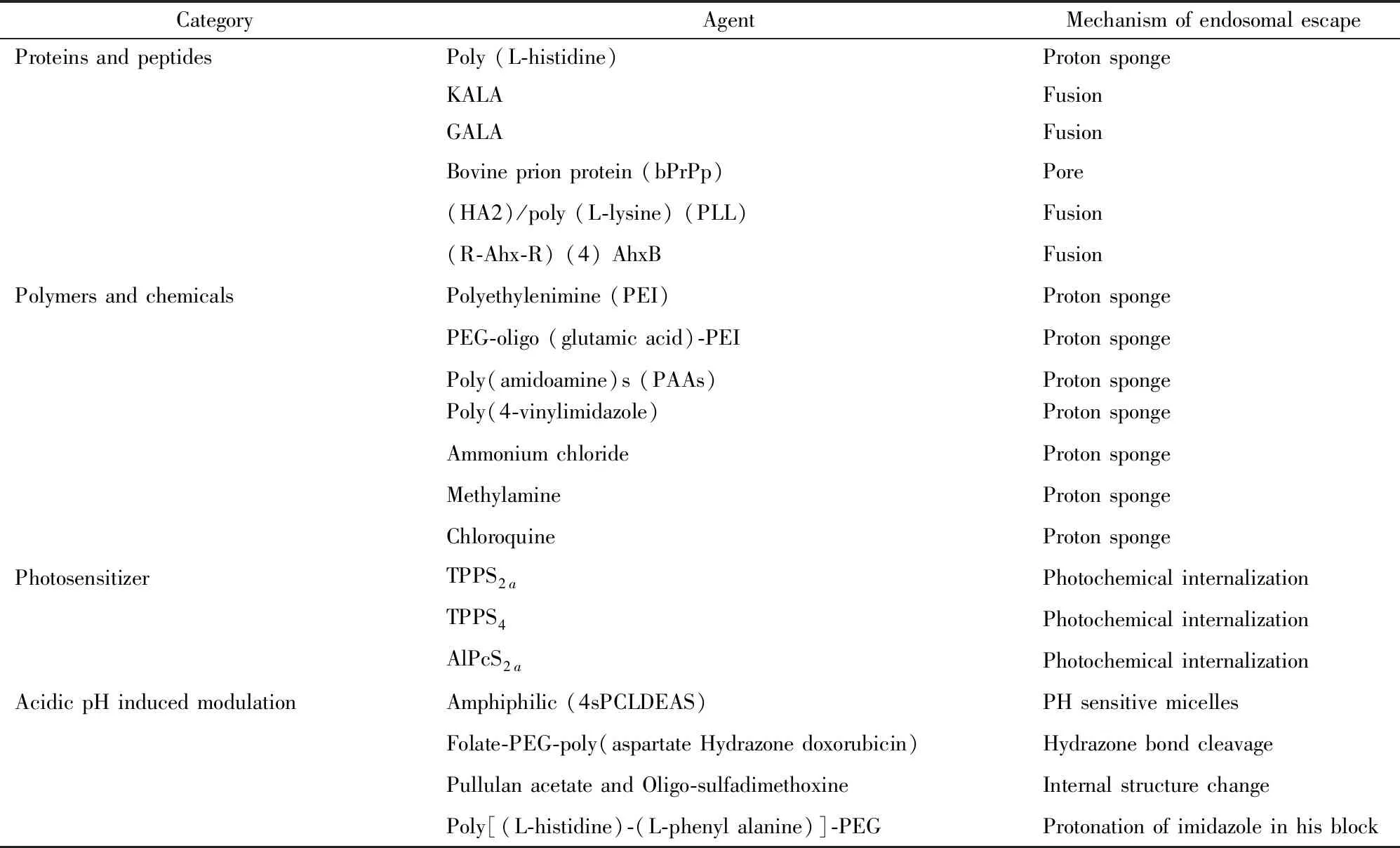
表1 内体逃逸剂及其机制[7, 10]

图2 质子化效应机理示意图[10]: 1:质子化制剂通过细胞内吞作用内化形成内小体;2:由于质子缓冲作用,伴随氯离子的注入,质子通过ATP酶内流;3:内小体离子浓度高,可从胞浆中吸水,导致渗透膨胀;4:内小体破裂,释放内容物Fig.2 Schematic of proton sponge mechanism[10]: 1: cell internalization of proton sponge agent via endocytosis to form endosome; 2: influx of protons by ATPase due to proton buffering action of the agent with concomitant influx of chloride ions; 3: high ionic concentration in endosome attracts water from cytosol leading to osmotic swelling; 4: rupture of endosome to release the endocytosed material

图3 多肽在内体膜上自组装形成膜孔[10]Fig.3 Peptides self-assemble to form pores in endosomal membrane[10]
2.4 光化学内化破坏内体膜
利用光化学作用激活进入细胞的光敏分子,产生活性氧(reactive oxygen species, ROS),破坏内体膜的过程称之为光化学内化(photochemical internalization, PCI)。光敏分子通过附着、包载等方式进入细胞,在光的照射下,释放ROS,使内体膜氧化破裂,释放内容物[19, 20](图4)。Selbo等[21]将光敏剂TPCS2a(红色荧光)与Alexa-488(绿色荧光)标记的AC133皂草素和WiDr细胞共孵育18 h后,观察到荧光共定位于内体中。曝光1 h后,在整个胞质中均发现有弥散的荧光显影,说明PCI诱导的皂草素成功实现逃逸。
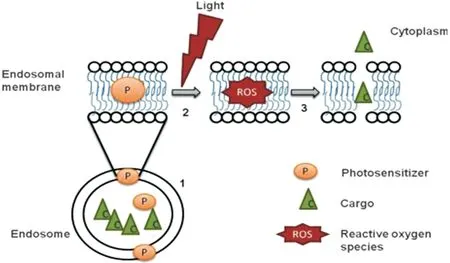
图4 光诱导内体逃逸示意图[20]:1:光敏剂定位在内体膜;2:光照激发光敏剂产生活性氧(reactive oxygen species, ROS);3:ROS破坏内膜释放内容物Fig.4 Schematic illustration of photo induced endosomal release[20]: 1: localization of photosensitizer (PS) in endosomal membrane; 2: illumination of light exciting photosensitizer to generate reactive oxygen species (ROS); 3: disruption of endosomal membrane by ROS to release cargo in cytoplasm
2.5 免疫响应的屏蔽
仿生粒子的引入,可以达到屏蔽免疫系统响应的效果,实现免疫逃逸,同时使纳米粒子具有生物特性,对特定组织、细胞具有靶向作用。Zhang等[22]从血液中分离出血小板,由于血小板外侧膜为负电性,聚乳酸-羟基乙酸(poly(lactic-co-glycolic acid), PLGA)纳米粒子也为负电性,利用静电排斥理论使体系构成“right-side-out”结构,血小板上的各种蛋白得以保留并朝向外侧,使得最终的体系既有纳米粒子载体特性,又有血小板活性。结果表明,血小板膜覆盖的纳米粒子,能有效结合人胶原蛋白,并对孤立血管的损伤区域具有靶向作用。
3 药物载体为实现内体逃逸的结构修饰
3.1 聚合物修饰
3.1.1 胺类聚合物
胺类聚合物如聚乙烯亚胺(polyethyleneimine,PEI)、聚酰胺-胺、氯化铵及甲胺等,其结构中含有大量的胺基,能够吸附质子,避免药物受酸性环境影响,还能增大内体内渗透压,使离子内流,造成膜的胀破,实现内体逃逸[23, 24]。Behr等[25]首先提出将PEI作为“质子海绵”,其缓冲能力在pH7.2~5.0,他的研究小组假设这种聚合物可以通过渗透压失衡来破坏内体。Borchard等[26]将PEI加入到PLGA溶液,得到PLGA-PEI纳米颗粒,对该纳米颗粒负载DNA后其在细胞内分布及表达进行定位。用罗丹明标记DNA,6 h后DNA进入内体,随后一段时间在Calu-3细胞内检测到蛋白表达,表明纳米颗粒逃离内体。
Jiang等[27]用富含胺的荧光碳纳米粒子(FCNs),携带能够减少polo样激素(polo-like Kinase 1,Plk1)表达的小干扰RNA(siPlk1),制备得到带有Plk1调节基因的碳纳米粒子-基因复合物(C-siPlk1),用于癌症治疗。研究者用荧光染料Cy5(红色荧光)对C-siPlk1进行标记,得到C-Cy5 siPlk1;在37 ℃下将人类黑色素瘤A375细胞与Lysotracker(绿色荧光)共孵育2 h,荧光标记内体;随后将含Lysotracker探针的A375细胞与C-Cy5 siPlk1在37 ℃下共孵育1 h。通过激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)观察发现,A375细胞与C-Cy5 siPlk1共孵育后,细胞能够对C-Cy5 siPlk1持续摄取;在3~6 h内,发现Cy5的红色荧光与Lysotracker的绿色荧光共定位,表明C-Cy5 siPlk1被内体摄取;进一步孵育9 h后,红色荧光与绿色荧光逐渐分离,表明C-Cy5 siPlk1开始内体中成功逃逸,12 h后,仅有少数C-Cy5 siPlk1未从内体逃逸(图5)。
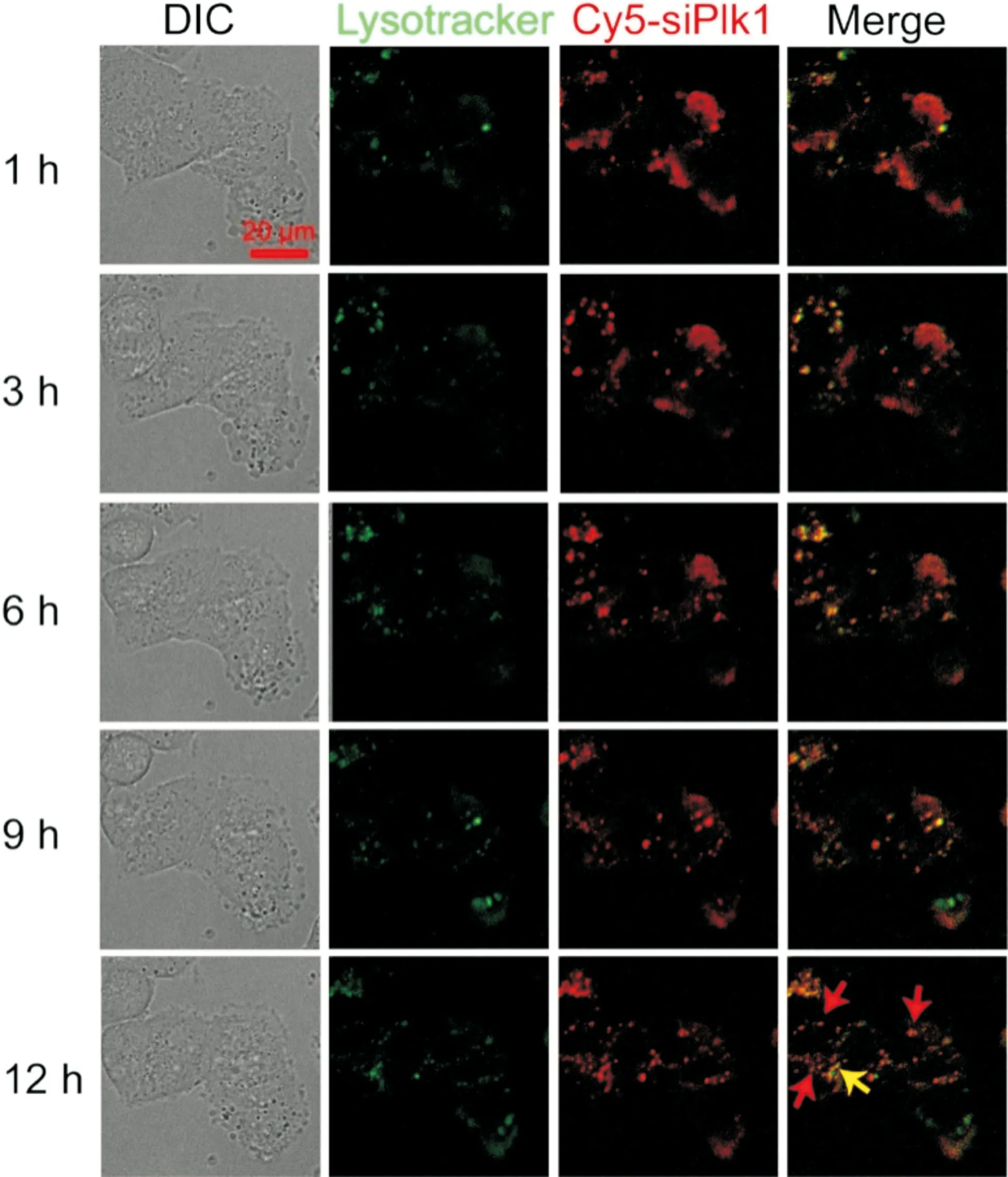
图5 Cy5标记的siPlk1在A375细胞中的内体逃逸,用激光扫描共聚焦显微镜(CLSM)观察12 h,红箭头显示为完成逃逸的siPlk1,黄色箭头为未逃逸的siPlk1[27]Fig.5 Cellular endosome/lysosome escape of C-Cy5 siPlk1 in A375 cells.The medium was replaced with optimen reduced serum medium and observed by CLSM for 12 h. The red arrows indicate the escaped siPlk1, while the yellow one indicates the encapsulated siPlk1 in endosome/lysosome[27]
PEI作为目前药物递送研究最成功的聚阳离子之一,能够大大提高转染效率,但其质子化作用越强,其细胞毒性也随着增大[28, 29]。因此,研究者们通过在聚合物上引入聚乙二醇(PEG)、聚氧胺等非离子亲水基团或直接添加阴离子来屏蔽阳离子电荷,或通过交联可降解基团等,减少其对细胞膜结构的破坏作用,降低细胞毒性[30]。Guan等[31]设计合成醛基修饰的PEG,对PEI/DNA复合物的正电荷进行屏蔽化;复合物进入微酸性肿瘤区,在席夫碱键的pH响应下,PEG脱落,发挥PEI的高效转染作用。研究表明,在pH 7.4条件下,PEI/DNA复合物的细胞存活率为83.2%,经过PEG屏蔽化后,细胞毒性明显减轻。PEG屏蔽化作用在提高稳定性和实现长循环的同时,降低了PEI的细胞毒性。Wang等[32]设计具有负电荷和疏水基团的树突状PEG端粒大分子包封蛋白质-PEI复合物,最大限度减少聚阳离子诱导的细胞毒性,同时端粒分子屏蔽层在细胞内蛋白质传递过程中能够与纳米复合物分离,恢复高转染特性。另有研究者将阴离子聚合物硫酸葡聚糖(DS)引入PEI/DNA复合物,得到粒径200 nm、分散系数0.2的复合物微粒,随着DS用量的增大,毒性降低[33]。
3.1.2 咪唑类聚合物
咪唑是分子结构中含有两个间位氮原子的五元芳杂环化合物。咪唑基在pH小于6时,会被质子化[34]。由于内体的内环境pH较低,咪唑基团具有很好的质子化介导作用,促使“质子海绵效应”的发生。与胺类聚合物相比,聚组氨酸或聚咪唑类载体的转染效率要更高,这可能与咪唑基能破坏内体膜的融合活性有关[35]。
Zhang等[36]合成了mPEG-PLA-Phis共聚物胶束,使用吖啶橙定位测定和钙黄绿素摄取研究共聚物对内体膜的破坏作用。细胞核和内体分别用Hoechst33258(蓝色)和Lyso Tracker DND-26(绿色)标记。负载阿霉素(DOX)的基于Phis的共聚物胶束被MCF-7细胞快速吸收,并在15 min后封装于内体内。随孵化时间增加,在细胞中橙色荧光(Lyso Tracker和DOX的重叠)增强,表明胶束在内体中联系积累。4 h后,发现强烈的紫色荧光(DOX与Hoechst重叠),表明DOX从内体逃逸到细胞核中。
聚(4-乙烯基咪唑)(poly(4-vinylimidazole),P4V)分子结构中含有大量咪唑环,在酸性条件下可接受质子,具有“质子海绵效应”。Jong等[37]研究了P4V作为非病毒基因递送载体,研究表明,P4V结合DNA在进入内体的酸性环境后会发生电荷的反转,发生质子化作用,与PEI作用机理类似,可实现内体逃逸。
3.2 多肽的融合
部分两性分子多肽中含有酸性氨基酸,如谷氨酸,其带有负电荷的羧基在中性条件下破坏多肽的α-螺旋结构的稳定性,而在酸性环境中,促进亲水亲油的两性螺旋结构的形成,通过与内体内膜的融合破坏内体。携带此种多肽序列的载体具有很强的内体逃逸能力[38]。蜂毒肽、聚精氨酸等碱性多肽能够在酸性环境中形成α-螺旋,此类构象的转变能够提高多肽与膜结构的亲和性。目前用于加强载体内体逃逸能力的多肽有蜂毒肽、KALA、GALA[39-41]等。
Yeom等[42]将KALA多肽与PEG缀合以防止PEI-DNA复合物自聚集,通过该配方得到稳定的PEI/KALA-PEG复合物。以PEI为参照,通过荧光素标记的寡核苷酸和C3细胞中的Cy3标记的质粒DNA,研究了PEI/KALA的内体逃逸能力,结果表明,转染24 h后,使用PEI/KALA的一组,细胞内的荧光复合物明显高于PEI,且荧光染色是在核内而非核外。这表明,KALA的加入明显增强PEI的质子化介导作用,增强载体内体逃逸能力。
Yu及其研究小组[43]得到二硫键修饰的富含树枝状精氨酸的阳离子肽。基因复合物可用荧光染料Cy5标记,荧光照射下显红色,而酸性内体可被LysoSensor Yellow/Blue DND-160染成绿色。研究表明(图6),与PEI相比,
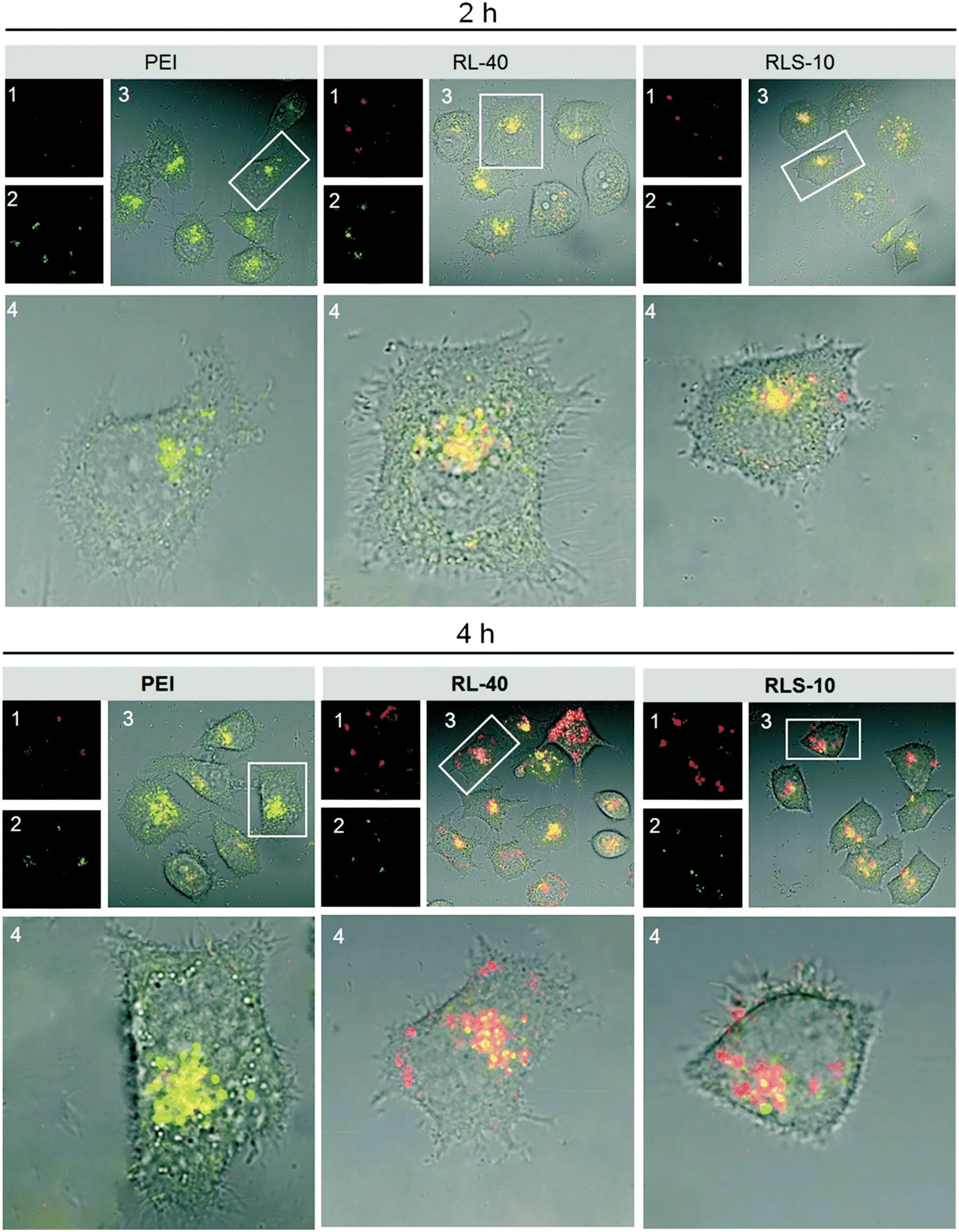
图6 Cy5标记的基因复合物在孵育2 h和4 h后内体逃逸情况:(1)Cy5通道,(2)LysoSensor Yellow/Blue DND-160通道,(3)通道合并,(4)局部视野放大[43]Fig.6 Images of endosomal disruption of gene complexes containing Cy5-labeled plasmid (red) in cells with LysoSensor Yellow/Blue DND-160 (green) after 2 and 4 h incubation: Cy5 channel (1), LysoSensorYellow/Blue DND-160 channel (2), overlay (3) and enlarged view (4)[43]
脂质-基因复合物组(RLS及RL)在转染2 h,荧光即显色为黄色荧光(红色与绿色叠加),表明进入内体环境;在转染4 h时,PEI组出现黄色荧光斑点,表明PEI组也被内体吞噬,而此时的脂质-基因复合物组的有些荧光已经开始变为橙色或红色,这表明红色荧光量增加,证明更多的基因复合物逃离了内体环境,同时也表明,精氨酸多肽的逃逸效率较PEI明显增加。
Kalina等[44]设计了pH触发的成孔肽,他们从pH不敏感的成孔肽MelP5序列的18 432个组合文库中进行高通量筛选,确定了两性螺旋极性表面的5个氨基酸残基,其在pH=7处为带电、可溶状态,在pH=5下与膜结合,螺旋成孔,实现了内体逃逸。
3.3 添加光化学诱导剂
采用光化学方法,使生物载体从内体通路释放到包浆的手段,现已被广泛研究[45]。许多光敏剂,包括TPPS4、TPPS2a、AIPcS2a和基于树枝状大分子的光敏剂(DP)主要定位在内体的膜表面,暴露于光下后,这些光敏剂会引起ROS的形成,短时间内破坏内体膜,而细胞内容物仍能保持完整并被递送至细胞质中[7, 46]。
Yuan等[47]报道了具有聚集诱导发射(AIE)特征的光敏剂(PS)与胺基丙烯酸酯(AA)结合在光存在下,会产生ROS。通过共焦激光扫描电镜评估复合物的细胞内转运特征,用吖啶橙为指标对ROS诱导的内体损坏进行评价,研究表明,Hela细胞在没有ROS参与下,呈红色荧光(内体)和绿色荧光(细胞器细胞核),而将其置于光照射下,红色荧光显著降低,表明内体被破坏,在细胞质中检测到YOYO-1标记的DNA,实现了内体逃逸(图7)。
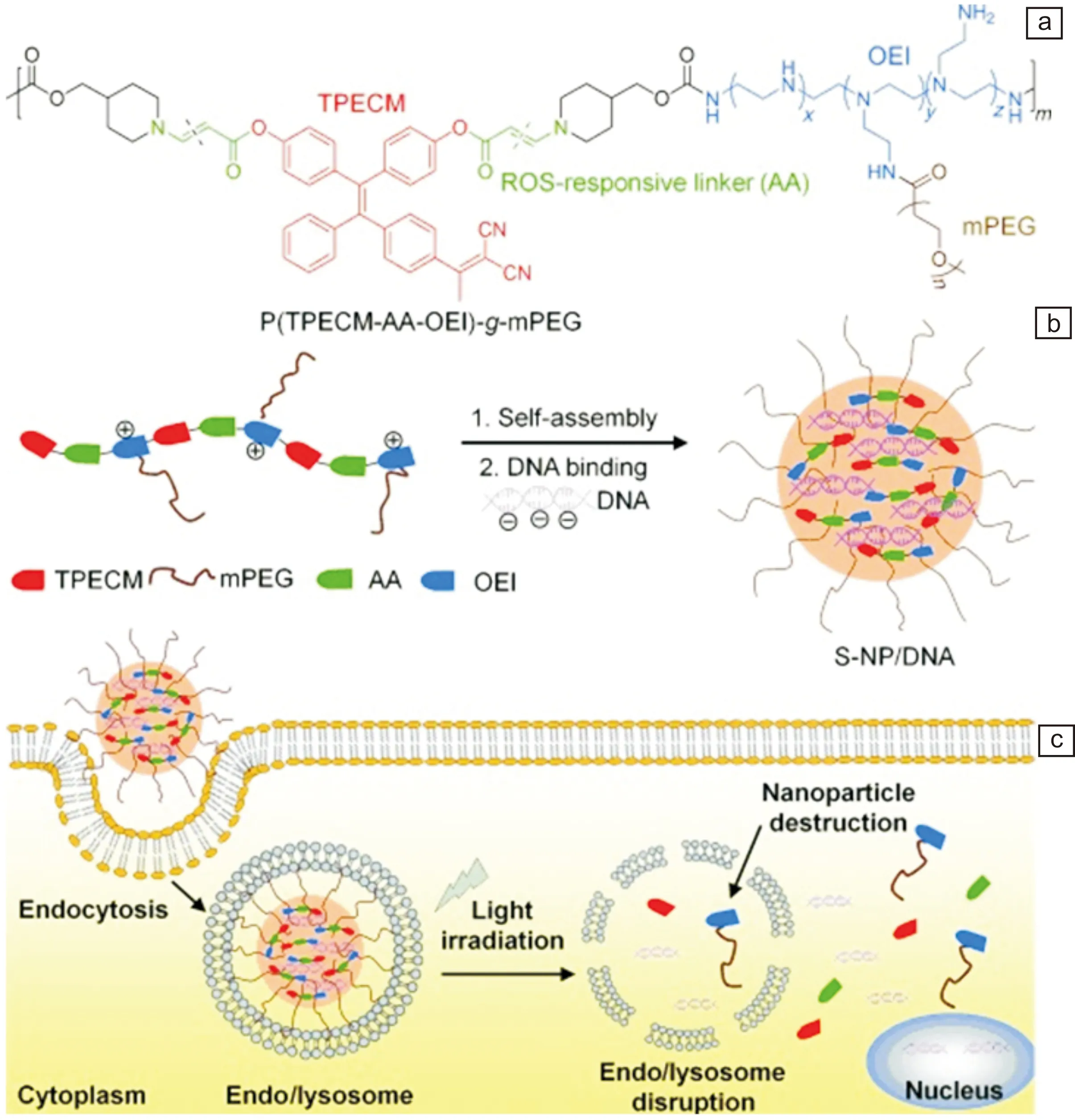
图7 ROS响应性纳米颗粒的转基因表达及内体逃逸过程[47]Fig.7 The transgene expression and endosomal escape of ROS-responsive nanoparticles[47]
Kun等[48]也报道了负载DOX和光诱导剂的聚合物胶束(D-LRPM),用荧光分别标记内体和细胞核,有光照射下内体荧光强度较无光照射明显降低,且DOX在细胞核处的荧光强度增加,结果表明,D-LRPM中光诱导剂产生的ROS能够成功破坏内体膜,将包载物释放至细胞质中。
在研究过程中,PCI技术仅通过光强度来进行调节,无光区域不会受到损失,进一步降低风险,是一种有效可控的逃逸方式[20]。
3.4 pH敏感材料的结合
pH敏感型材料是一类能够响应所在环境pH值的微小变化,其分子结构和物理性能发生一定变化的新型材料。在机体病变细胞,以肿瘤细胞为例,肿瘤微环境具有低O2、pH降低、间质高压、血管高渗透性等特点,生理状态下,正常组织细胞外pH介于7.2~7.4,而恶性肿瘤细胞外pH介于6.5~6.9之间[49]。通过在药物载体上引入pH敏感型材料,使其仅在靶点特定pH条件下完成药物释放,既实现了内体逃逸,又能使药物在靶点处有效释放。ZnO纳米颗粒在生理条件下(pH 7.4)保持良好的稳定性,但在pH 5~6左右能够快速分解[50]。Zhang等[51]利用这一特性,合成具有pH敏感特性的ZnO-MSNs,达到内体逃逸效果,实现药物释放的可控性。Ma等[52]将半乳糖、葡聚糖与视黄醛进行缀合,得到GDR缀合物,分别研究了pH为5.0,6.5和7的PBS缓冲液中GDR纳米凝胶的流体动力学尺寸。研究表明,其在pH=7.4下,粒径保持不变;在pH=6.5下,粒径有所增加;在pH=5.0时,粒径增大为中性条件下的3倍,具有明显的pH敏感效应。通过荧光标记示踪可知,孵育6 h后,包载疫苗的GDR与内体共定位,并观察到有超过50%的内含物从内体中解离出来,实现内体逃逸。研究推测,腙键的裂解消耗大量质子,从而增加了质子、氯离子和水的流入,从而引起内体溶胀和损伤。
3.5 脂质材料
二油酰磷脂酰乙醇胺(DOPE)及其衍生物在环境中会发生相变,继而破坏内体膜,相关研究表明,磷脂酰乙醇胺连接不同种类的不饱和脂肪烃链在生理条件下为负电性,复合物表现为层状,在pH下降时,PE质子化使得复合物变为六角形[53]。六角形的复合物对膜具有较大的破坏性,能完成内体逃逸。Safinya课题组[54]使用小角度X射线散射加速器将二油酰三甲基铵丙烷(DOTAP)-二油酰磷脂酰乙醇胺(DOPE)的结构与其转染效率相关联,DOPE被发现可以诱导DNA-脂质复合物从多层结构向个倒六角液晶相的转变。反向六边形结构能够促进与阴离子膜之间的相互作用,导致膜融合和DNA释放。
4 结 语
近年来,一系列具有良好的生物相容性、组织渗透性、高靶向性、无毒、易吸收的纳米载体得到了广泛的开发和应用,但内体屏障的存在也限制了纳米药物的发展。目前,通过膜融合或形成膜孔的形式实现内体逃逸的多肽、蛋白类材料逃逸效率高但具有一定免疫原性;而聚合物类逃逸材料在胞内仍存在一定毒性;利用仿生粒子实现免疫逃逸,一定程度避免免疫原性,又无细胞毒性,但其不具有普遍作用性,仍难以得到实际应用。
在现有载体材料基础上,通过对内体逃逸机制的进一步了解,将会推动药物载体的发展和应用。相信随着对药物载体在胞内的转运、代谢及内体免疫等机理的进一步揭示及新型药物载体的开发,内体逃逸剂将会有更为广阔的发展空间。

