CT引导下多种微创技术联合治疗肺癌
张 晶,张 肖,张啸波,何晓锋,张 欣,魏颖恬,李 竞,肖越勇
(中国人民解放军总医院放射诊断科,北京 100853)
近年来,肺癌发病率逐年增高,影像学引导微创技术在肺癌的治疗中发挥越来越重要的作用,包括物理消融(射频消融、微波消融及冷冻消融等)、化学消融、放射性粒子植入及纳米刀消融等[1]。胸部解剖结构复杂,重要组织结构较多,且肺癌往往伴有全身多发转移,采用单一微创技术治疗的效果欠佳[2]。本研究探讨CT引导下多种微创技术联合治疗肺癌的有效性及安全性。
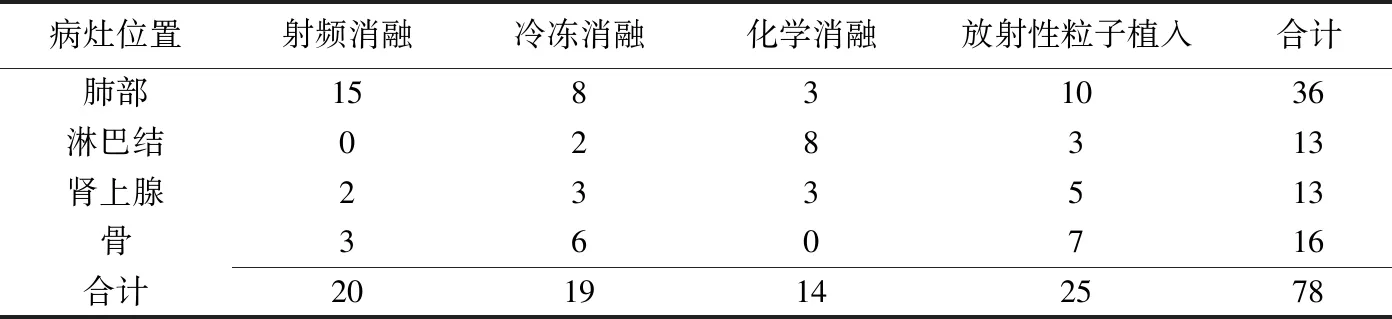
表1 34例肺癌患者78个病灶的位置及治疗方法(个)
1 资料与方法
1.1 一般资料 选取2015年6月—2017年6月于我院接受CT引导下物理消融、化学消融和/或放射性粒子植入治疗的原发肺癌患者34例(78个病灶,包括肺部36个、淋巴结13个、肾上腺13个、骨16个),均伴有肺内或远隔部位转移;其中男23例,女11例,年龄42.0~78.0岁,中位年龄56岁。对34例患者治疗前均完善相关实验室及CT检查;并行CT引导下经皮穿刺活检,病理诊断为腺癌22例、鳞癌12例。
1.2 仪器与方法 采用Philips Brilliance大孔径16层螺旋CT为引导设备(管电压120 kV、管电流 250 mAs、层厚5 m、层间距5 mm)。根据术前影像选择微创治疗方法:①物理消融,病灶最大径<3 cm,未毗邻重要组织结构(如血管、气管等),患者可耐受治疗;②放射性粒子植入,病灶邻近血管或胸膜、形状不规则且内部有分隔,或成骨性或溶骨性骨转移灶;③化学消融,病灶位置深、毗邻结构复杂,一般多为转移性淋巴结,内部无分隔。
术前6 h患者禁食,术前1 h给予镇痛和镇咳药物,并建立静脉通道,常规监测心电图、血压及血氧饱和度。根据病灶位置进行微创手术规划并设计方案,经CT扫描确定穿刺点及穿刺路径。局部注射1%盐酸利多卡因5~10 ml进行麻醉,按照既定方案采用步进式穿刺法植入射频电极针(Cool-tip)、冷冻探针(Galil Medical Cryo-Hit)或注射用千叶针(直径0.9 mm,上海埃斯挨医械塑料制品有限公司)。进行物理消融时,确定消融针和麻醉用千叶针到位后,采用消融系统进行消融(如消融区邻近胸膜,需留置千叶针以维持麻醉)。化学消融时,采用2 ml注射器通过千叶针将化学消融剂缓慢注入靶病灶内。植入放射性粒子时,采用18G粒子植入针和全封闭防辐射粒子植入枪将放射性125I粒子源释放至病灶内。化学消融剂:碘佛醇注射液及无水乙醇,注射用盐酸表柔比星,注射用洛铂。125Ⅰ放射性粒子源:平均能量27.4 keV,活度0.7~0.8 mCi,半衰期60.1天,组织穿透力1.7~2.0 cm。
术中间断进行CT扫描,观察消融情况和化学消融剂及放射性粒子分布,并注意是否出现咯血、疼痛、出血等并发症。术后即刻再行CT扫描,观察病灶及并发症情况。术后监测心电图、血压、血氧饱和度6 h,并给予抗生素治疗3天以预防感染。
1.3 评价与随访 对所有患者分别于术后1、3、6个月随访时复查CT,并与术前对照,以评价疗效。疗效显著:物理消融后实变区域无强化,边缘清晰,消融后1个月CT示病灶体积较术前增大,术后3、6个月CT示病灶呈不同程度渐进性缩小,体积较术前缩小>50%;化学消融后病灶持续缩小,体积较术前缩小>50%,其内可见残余高密度消融剂;放射性粒子植入后病灶持续缩小,体积较术前缩小>50%,可见粒子集聚。病灶进展:消融后1、3、6个月CT示病灶体积较术前持续增大,病灶中心持续强化,或边缘呈结节状强化。病灶稳定:介入疗效显著与病灶进展之间。
2 结果
对34例患者共78个病灶均成功实施CT引导下物理消融、放射性粒子植入和/或化学消融治疗(表1),手术时间45~85 min、平均(65.03±17.82)min,住院时间4~8天、平均(5.52±1.31)天。
术中5例患者(冷冻消融3例、射频消融1例及放射性粒子植入1例)出现少量咯血,局部注射及静脉滴注止血药物后咯血停止;4例(射频消融3例及冷冻消融1例)有轻或中度疼痛,局部胸膜注射5%利多卡因及静脉滴注镇痛药物后好转。术后4例(放射性粒子植入2例、化学消融1例及冷冻消融1例)出现少量或中等量气胸;对其中1例中等量气胸患者行胸腔闭式引流,对3例少量气胸患者密切观察、未给予特殊处理,后均恢复良好。所有患者术中及术后均未出现大出血、支气管胸膜瘘等严重并发症。
术后即刻复查CT显示物理消融病灶边缘模糊,范围增大,邻近肺组织见边缘模糊的晕环状改变,其中射频消融病灶区域变实、部分病灶内见点状低密度气体影(图1A);化学消融病灶内见高密度消融剂充填,病灶体积稍增大,邻近组织间质内及拔针后针道内见少许消融剂外渗(图1B);125I放射性粒子植入后椎体病灶前缘溶骨性破坏伴软组织肿块形成(图1C)。
术后1、3、6个月随访复查CT显示,经物理消融(图1D)、化学消融(图1E)、放射性粒子植入(图1F)治疗后,69个(69/78,88.46%)病灶疗效显著,5个 (5/78,6.41%)病灶稳定,4个(4/78,5.13%)病灶进展。
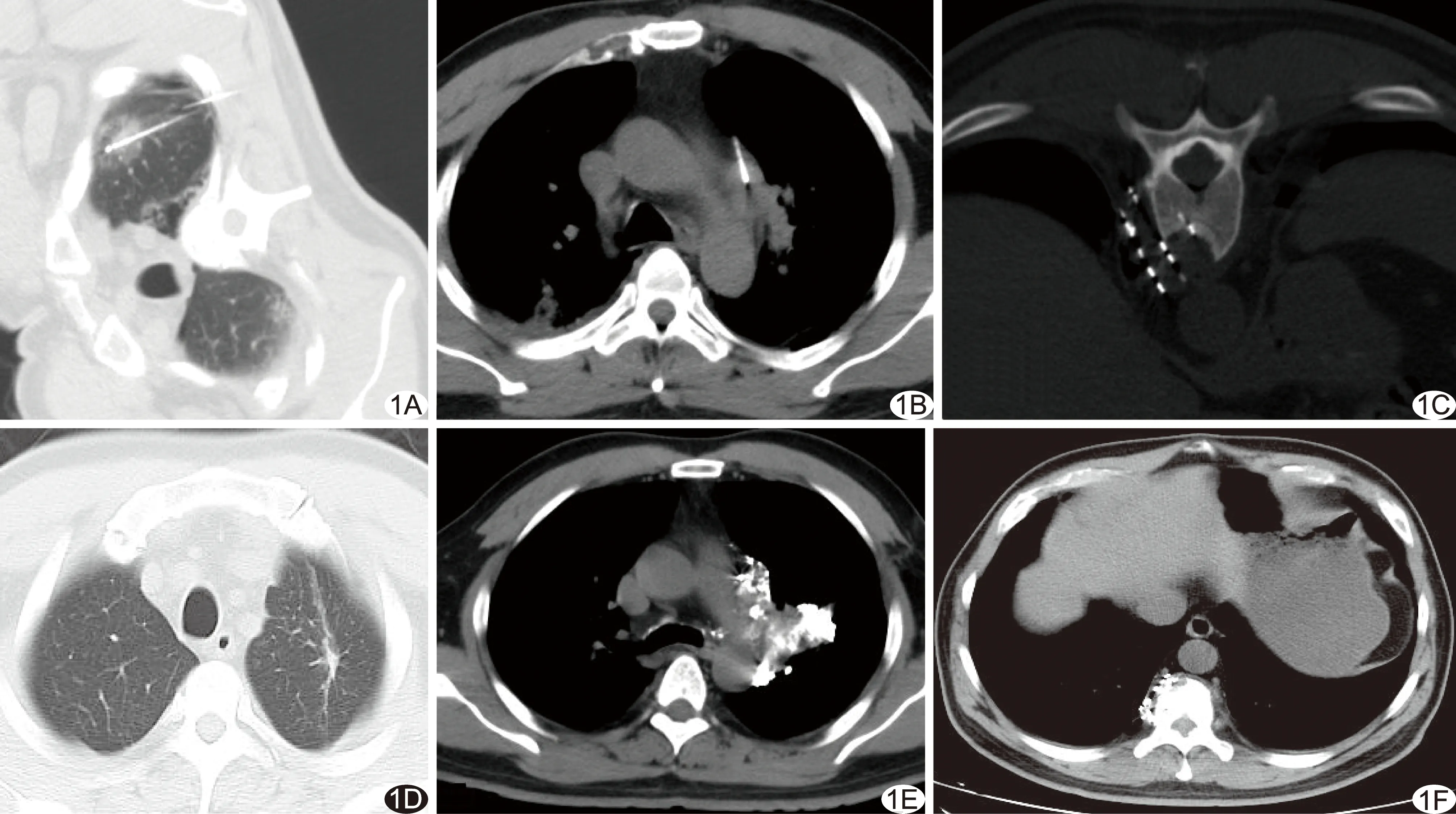
图1 患者女,55岁,双肺腺癌伴淋巴结、椎体转移,CT引导下微创治疗 A.肺部病灶射频消融后,病灶实变,周围可见环晕征; B.纵隔及肺门淋巴结病灶化学消融,于CT引导下将穿刺注射针置入肿大淋巴结中心注入化学消融剂; C.椎体病灶125I放射性粒子植入后,椎体前缘呈溶骨性破坏伴软组织肿块形成; D~F.术后3个月复查CT示肺部病灶射频消融后呈条索状改变(D),肿大淋巴结经化学消融明显缩小,其内可见残留消融剂(E),椎体病灶经125I放射性粒子植入治疗明显缩小,溶骨性破坏区出现成骨成分(F)
3 讨论
肺癌居全身恶性肿瘤发病率首位,大部分患者就诊时已有局部侵犯或远处转移而无法手术切除。影像学引导下微创治疗具有疗效好、费用低、并发症少等优点,已广泛应用于治疗肺癌原发病灶和转移病灶[3]。在众多微创技术中,物理消融的效果最为直接,当射频消融温度达到80℃~100℃、冷冻消融温度达-150℃~-200℃时,可使肿瘤组织迅速坏死[4-5];但胸部解剖结构极其复杂,且血管的“热池效应”常致物理消融难以完全灭活肿瘤细胞,造成肿瘤残留;且部分病灶邻近气管或胸膜,过度物理消融可导致气管壁或胸膜损伤等严重并发症[6]。另一方面,骨转移病灶常邻近神经结构,物理消融难以控制消融范围,可致神经损伤。如何在物理消融过程中联合应用其他技术,以安全、有效地控制肿瘤,是临床亟待解决的问题。
放射性粒子植入和化学消融通过经皮穿刺将放射性粒子源和化学消融剂直接释放或注射到瘤体内,使肿瘤组织受到持续的高剂量射线照射或在高浓度药物作用下坏死;其最大优势为不易损伤周围重要脏器,患者对治疗的耐受性好。一般采用18G穿刺针植入放射性粒子,采用21G千叶针进行化学消融,二者的直径均小于物理消融针,故在穿刺过程中对正常组织结构的损伤更小,适用于解剖位置深在、毗邻关系复杂的病灶。但这2种技术也存在局限性:植入放射性粒子需要进行多点适形分布,以全面覆盖病灶,治疗较大肿瘤的费用较高;化学消融剂局部弥散速度快,药物与肿瘤细胞的作用时间短,常因组织不均匀及组织内纤维间隔阻挡使药物弥散受限,且化学消融剂剂量过大会导致患者出现严重的全身不良反应[7]。
本研究根据病灶具体情况选择不同的微创治疗方法,对无重要脏器结构毗邻的病灶给予物理消融,并在CT引导下实时监测消融效果及并发症[8];对于邻近神经结构的骨转移病灶采用放射性粒子植入控制其进展,对溶骨性病灶采用粒子植入针直接穿刺入病灶内适形释放粒子,而对成骨性病灶则先选用骨穿针建立释放通道后再进行粒子植入[9];对毗邻重要结构的较小病灶(如转移性淋巴结)则采用化学消融治疗。
进行化学消融时需注意以下几方面:①混合使用多种药物时,将多种药物混匀后注入病灶,不仅可增加药物之间的协同作用,且能示踪药物的弥散情况;常用化学消融剂包括盐酸表柔比星、丝裂霉素、无水乙醇、碘佛醇/碘化油等;②肿瘤组织成分复杂,且存在纤维分隔,使消融剂不能得到充分弥散,影响治疗效果;本组采用2 ml注射器匀速、缓慢、高压注射药物,注射速率为0.5 ml/min,待消融剂弥散满意后插入千叶针针芯,保持千叶针位于病灶内10 min以上,以保证病灶内消融剂压力恒定,利于消融剂充分弥散渗透,并防止消融剂经针道外渗;③积极进行疼痛管理,化学消融病灶一般位于位置复杂区域,周围神经、血管丰富,在注射消融剂过程中,病灶内部压力增高,可刺激周围神经致患者感觉疼痛,而化学消融剂中无水乙醇可外溢至肿瘤周围刺激周围神经亦可引起疼痛;对于神经丰富的病灶,可在给予消融剂前局部注射5%利多卡因,并在术后拔针时同步注射利多卡因,以减轻疼痛[10-11]。
综上所述,CT引导下多种微创技术联合可实现对肺癌的个体化、微创化治疗,治疗效果确切,且安全性好。但本研究为单中心研究,样本量较少,随访观察时间较短,有待进一步完善。

