糖调节受损模型大鼠肝脏组织PPAR-γ、GLUT2、InsR mRNA表达水平及胰岛β-细胞超微结构变化
古丽娜扎尔, 艾比拜·玉素甫, 麦合苏木·艾克木
(1新疆医科大学维吾尔医学院, 乌鲁木齐 830011; 2新疆医科大学第一附属医院内分泌科, 乌鲁木齐 830054)
糖调节受损(Impaired glucose tolerance,IGT)即糖尿病前期,是介于正常血糖与糖尿病之间一种糖调节失衡表现,包括空腹血糖受损和糖耐量受损,是Ⅱ型糖尿病(T2DM)的主要危险因素[1]。调查表明我国20岁以上成年人IGT发病率为15.5%,IGT极易发展成为T2DM,若此阶段进行有效干预,可有效防止和延缓糖尿病(DM) 的发生、发展,减少微血管和大血管并发症[2]。IGT主要的病理生理基础是胰岛素抵抗(IR)和胰岛β细胞功能受损[3-4]。王东等[5]建立IGT模型研究空腹血糖(Fasting blood glucose,FBG)、胰岛素水平(Fasting serum Insulin,FINS)、葡萄糖耐量试验(Oral glucose tolerance,OGTT)的变化及胰岛素抵抗指数(Homeostasis model insulin resistance index,HOMA-IR)和胰岛β-细胞功能指数(Pancreatic β-cell function index,HOMA-β)等。尚未见有关IGT模型PPAR-γ、GLUT2、InsR mRNA表达水平及胰岛β-细胞超微结构变化等研究报道。本研究通过灌胃高脂乳剂和腹腔注射小剂量链尿佐菌素(Streptozotocin,STZ),建立IGT大鼠模型,并测定FBG、FINS、OGTT、计算HOMA-IR和HOMA-β的基础上,采用RT-PCR技术,检测肝脏组织中PPAR-γ、InsR及GLUT2 mRNA表达水平,利用透视电镜观察胰岛β细胞超微结构的变化,现报道如下。
1 材料与方法
1.1仪器DG-3022型酶标仪(美国Bio-Rad公司),H2050R1型低温超速离心机(上海华岩仪器有限公司),t100型RT-PCR仪(美国Bio-Rad公司), AF100型制冰机(美国Scotsman公司),768/07865凝胶成像仪(美国Bio-Rad公司),三诺GA-3血糖仪(泰博科技股份有限公司)。
1.2试药大鼠胰岛素酶联免疫试剂盒(华美生物工程有限公司,批号CSB-E05070r),生理盐水(国药集团新疆制药有限公司,批号100103473),盐酸二甲双胍(中美上海施贵宝制药有限公司,批号110807A),链脲佐菌素(美国Sigma 公司,批号GX72-1000)、cDNA合成试剂(英国Thermo 公司,批号1622),TRNzol Universal总RNA提取试剂(天根生化科技公司,批号DP140901),DEPC-treated water(上海生工试剂有限公司),2×Taq Plus PCR 试剂(天根生化科技公司,批号KT121221),氯仿(上海试剂厂,批号20170625),异丙醇(上海试剂厂,批号20171216),无水酒精(北京赛奥科技有限公司,批号20170521)。
1.3实验动物选取SPF级别的雄性Wistar大鼠20只,体质量(180±20)g,由新疆医科大学动物实验中心提供[许可证号:SCXK(新)2016-0002]。
1.4高脂饲料与药物配制
1.4.1 高脂饲料的配制 取猪油1 000 g、胆固醇500 g、猪胆酸盐100 g、丙基硫氧嘧啶50 g、吐温-80 1 000 mL、丙二醇1 000 mL、加蒸馏水5 000 mL混匀即得。
1.4.2 药物的配制 (1)柠檬酸盐缓冲液的配制:A液取柠檬酸钠2.94 g置于100 mL 容量瓶,加蒸馏水定容至100 mL;B液取柠檬酸2.1 g置于100 mL容量瓶,加蒸馏水定容至100 mL;将A液与B液按1∶1.32混合均匀,PH调节至4.2,即得柠檬酸盐缓冲液。(2)STZ溶液的配制:取STZ 1 g,避光,4℃下,以pH为4.2 的0.1 mmol/L柠檬酸盐缓冲液配制1%STZ的溶液。
1.5动物分组与模型建立方法选取SPF级别的雄性Wistar大鼠20只,随机分为对照组和模型组。模型组:灌胃高脂饲料2 mL/只、每天1次,连续32 d,于第33 d禁食、水8 h后,腹腔注射STZ 25 mg/kg。对照组以生理盐水代替高脂饲料,以柠檬酸钠缓冲液代替STZ。
1.6标本的采集及指标测定方法
1.6.1 大鼠血液样本的采集及FBG、FINS、OGTT的测定 实验第33 d更换大鼠笼子,大鼠自由进食、水8 h,12 h后大鼠尾巴末端取血,血糖仪快速测定FBG。大鼠灌胃葡萄糖(2.5 g/ kg体质量),用血糖仪分别测定灌胃后30、60、120 min时大鼠的血糖浓度值(OGTT)。大鼠眼静脉丛取血1 mL按照大鼠胰岛素(FINS)酶联免疫试剂盒说明,测定大鼠空腹FINS,计算HOMA-IR、HOMA-β,计算公式为:HOMA-IR=FBG×FINS/22.5,HOMA-β=20×FINS/(FBG-3.5)。
1.6.2 大鼠肝脏样本的采集及PPAR-γ、GLUT2、InsR mRNA表达水平的测定 取大鼠肝脏组织30~50 mg,置于无RNA酶的EP管中,在通风的情况下,每管依次加入l mL TRNzol Universal试剂,匀浆处理,室温放置5 min。各管中加入氯仿200 μL并颠倒混匀15 s,室温放置3 min,以4℃ 12 000 r/min离心15 min,取上清液,加入等体积的异丙醇500 μL,室温放置10 min,以4℃ 12 000 r/min离心10 min。离心后可见沉淀于管底的白色RNA,弃去上清液,保留沉淀。将沉淀用1 mL 75%的乙醇清洗,以4℃,10 000 r/min离心5 min,弃上清液,保留沉淀,干燥后用50μL RNase-Free ddH20将RNA充分溶解,-20℃冰箱保存,待用。取1 μL RNA检测RNA样品260 nm和280 nm处的吸光度(OD)。逆转录合成cDNA,反应体系的配置:取DNAse、RNase-free (EN0521)、Total RNA、10×Reaction Buffer with MgCl2各1 μL,用RNAse 定容至10 μL。反应条件:37℃,30 min,再向反应体系中加入50 mmol/L的 EDTA1 μL,65℃下反应10 min,反应结束后取出置于冰上作为逆转录酶的模板。向消化DNA后的RNA反应管中加入如下体系:Oligo dT 18 primer 1 μL,10 mmol/L dNTP mix 2 μL,反应缓冲液4 μL,抑制剂 1 μL, M-MuLV反转录酶1 μL,总体积为20 μL。反应条件:42℃,60 min;70℃,5 min;待温度降至4℃取出保存。此时为反转录后的单链cDNA,可直接进行PCR或-20℃保存备用。以反应缓冲液将逆转录cDNA反应生成的cDNA稀释1∶1 000,并添加以下试剂,反应体系为25 μL。吸取cDNA模板1 μL,上游引物F 1 μL,下游引物R 1 μL,2×Taq Plus PCR Master Mix 12.5 μL,ddH2O 水 9.5 μL,总体积为25 μL。反应条件:共30个循环(每个循环后自动读板 1次),每个引物相应的退火温度上退火,94℃ 3 min;94℃ 30 s;55℃ 30 s;72℃延伸1 min,做55℃~95℃的融解曲线分析。每个样品做3 个平行管。mRNA相对表达量= 2-ΔCT×100%,ΔCT=目标基因CT值-内参(GAPDH)CT值。cDNA片段的PCR引物序列,见表1。

表1 用于合成cDNA片段的PCR引物序列
1.6.3 大鼠胰腺样本的采集及胰岛β-细胞超微结构的观察 取出大鼠肝脏及胰腺组织,将胰腺组织切成花1 mm×1 mm×1 mm小块,立即放入2.5%戊二醛固定液固定,用0.1 mol/L PBS缓冲液漂洗3次,10 min/次,再用1%戊二醛固定液固定2 h,逐级丙酮脱水,石蜡包埋、切片,取用普通载玻片制作的胰腺组织切片,经二甲苯脱蜡2次、每次5 min,无水乙醇2次、每次2 min,95%、85%、75%乙醇各1次、每次1 min,用水浸洗2 min,逐级水化后浸入苏木精染液5 min,自来水浸洗1 min,浸入1 %稀盐酸酒精溶液分色20 s,用水浸洗1 min,浸入1%氨水中反应30 s,用水浸洗1 min,浸入伊红染液5 min,用水浸洗1 min,再分别用75%、85%、95%乙醇各浸洗1次、每次1 min,无水乙醇浸洗2次,每次2 min,逐级脱水后,用二甲苯透化2次,每次5 min,中性树胶封片,于镜下观察、拍照记录结果。

2 结果
2.12组大鼠FBG、FINS、HOMA-IR以及HOMA-β的比较与对照组比较,模型组大鼠血清FBG、FINS和HOMA-IR升高,HOMA-β降低,差异均有统计学意义(P<0.05),见表2。
2.22组大鼠不同时间点血糖的变化与对照组相比,模型组大鼠糖负荷后30、60、120 min时的血糖值均升高,其中大鼠糖负荷后60 min时的血糖值最高,差异有统计学意义(P<0.05),见表3。
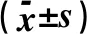
表2 2组大鼠FBG、FINS、HOMA-IR以及HOMA-β的比较
注:与对照组相比较,*P<0.05、**P<0.01。
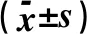
表3 2组大鼠不同时间点血糖的变化
注:与对照组相比,*P<0.05、**P<0.01。
2.32组大鼠胰岛β-细胞超微结构的比较对照组大鼠胰岛β-细胞核膜完整,核染色体分布均匀,胞质内线粒体、粗面内质网和高尔基复合体丰富而发达、有大量的分泌颗粒,为圆球形,颗粒内有电子密度不一的芯,界膜与芯之间的间隙较大,明亮清晰,细胞核形状为圆形或卵圆形,较大,核膜光滑。与对照组比较,模型组大鼠胰岛β-细胞胞质内线粒体、粗面内质网和高尔基复合体数量减少,线粒体、粗面内质网和高尔基复合体部分肿胀,胞浆中分泌颗粒数量和致密芯密度略减低,见图1。


对照组(电镜,×12 000倍) 模型组(电镜,×15 000倍)
2.42组大鼠肝脏组织中PPAR-γ、GLUT-2及InsRmRNA的表达与对照组比较,模型组大鼠肝脏组织中PPAR-γ、GLUT-2及InsR mRNA表达量均降低,差异有统计学意义(P<0.05),见图2。

图2 2组大鼠肝脏组织中PPAR-γ、GLUT-2及InsR mRNA的表达水平
3 讨论
IGT即糖尿病前期是糖代谢紊乱而产生的病理状态,是T2DM的主要危险因素,其发病原因至今尚未完全阐明。目前糖尿病模型的相关研究主要集中在T2DM模型的建立技术和方法等[6-7],IGT模型分子机制等方面的研究报道甚少,其分子机制尚未清楚。建立IGT模型并探讨可能的分子机制对糖尿病和IGT的发病因素、发病过程及防治等方面具有重要意义。本实验采用灌胃高脂乳剂和腹腔注射小剂量STZ,建立IGT大鼠模型[8-11],采用RT-PCR技术,检测肝脏组织中PPAR-γ、InsR及GLUT2 mRNA表达水平,利用透视电镜观察胰岛β细胞超微结构的变化。通过对IGT模型大鼠β细胞超微结构变化观察可见,与对照组相比,模型胰岛β-细胞胞质内线粒体、粗面内质网和高尔基复合体数量减少,线粒体、粗面内质网和高尔基复合体部分肿胀,胞浆中分泌颗粒数量和致密芯密度略减低,说明IGT模型胰岛β-细胞结构变化导致其功能紊乱。IGT模型胰岛β-细胞功能紊乱特征与临床糖调节受损病理生理特征一致。
PPAR-γ是胰岛素抵抗、糖代谢调节因子之一,主要作用是改善胰岛素抵抗,增加外周组织对胰岛素的敏感性,从而促进葡萄糖的摄取[12-13]。葡萄糖转运体(GLUT)是一类调控细胞外葡萄糖进入细胞内的跨膜蛋白家族,参与糖代谢,炎性反应和免疫应答等过程。GLUT2作为GLUT蛋白亚型,具有很高的转运能力,其高表达能改善肝葡萄糖摄取和利用[14-15]。Ins是机体内不可缺少的蛋白质激素,由胰腺胰岛β-细胞分泌,促进细胞的增殖,分化。Ins和InsR结合后才能发挥降低血糖的作用,Ins和InsR结合过程任何一个环节受损,都会引起胰岛素抵抗。从实验结果可推测,IGT模型大鼠FBG、FINS、OGTT等糖代谢指标异常可能与PPAR-γ、GLUT-2及InsR mRNA表达水平下降有关。本研究不仅为IGT模型分子机制的初步探讨,也为糖调节受损发病机制及干预手段研究奠定基础。

