一例梅花鹿布氏杆菌和日本乙型脑炎混合感染的诊断
郭倩妤 石远菊 汤德元 叶 丽 杨 伟 廖少山 刘巧玲
(贵州大学动物科学学院,贵阳,550025)
近年来,随着畜牧养殖的发展,特种经济类养殖也得到了迅速发展,目前梅花鹿养殖业经济效益非常可观,梅花鹿(Cervusnippon)的养殖数量不断增加,但是梅花鹿的疾病防治也显得尤为重要,各类疫病的传播已成为梅花鹿养殖的障碍[1]。日本乙型脑炎(Japanese encephalitis)是由黄病毒科(Flaviviridae)黄病毒属(Flavivitus)日本乙型脑炎病毒(Japanese encephalitis virus,JEV)引起的一种危害严重的自然疫源性、虫媒性人兽共患病[2],畜禽感染率很高,多为隐性感染,该病的传染媒介是蚊子,有明显季节性,鹿多为隐性感染但也有散发死亡的,是近年来新发现确定的病毒性疫病[3]。该病毒在血液中存留时间较短,于中枢神经系统与肿胀的睾丸内存留时间长。马、猪、牛、羊、鹿、鸡、鸭和鸟均能感染该病,马最易感,牛、羊、鹿多呈隐性经过[4]。JEV非结构蛋白NS1是病毒的主要抗原成分,能够产生免疫保护作用,此外NS1蛋白参与病毒的早期复制及病毒的组装和释放[5]。本研究测序分析了梅花鹿感染JEV的NS1部分基因,为防治梅花鹿JEV的感染奠定基础。
1 材料与方法
1.1 病料
病料来自贵州省梅花鹿养殖场发病梅花鹿的4份血样。
1.2 主要试剂
TaKaRa Min BEST Viral DNA/RNA Extraction Kit Ver.5.0试剂盒、One Step RT-PCR Kit Ver.2、DL-2 000 Marker、Sanprep 柱式DNA 胶回收试剂盒、Sanprep 柱式质粒DNA小量抽提试剂盒,均购自生物工程(上海)股份有限公司。
1.3 布氏杆菌检测
取被检血清30 μL与抗原30 μL相混合,于4 min内观察结果,若反应液呈均匀粉红色,无凝集现象,则表示布氏杆菌阴性;若反应液稍有卷边形成,凝集物间液体呈红色;形成明显卷边,凝集块间液体稍清亮;凝集块呈菌丛状,凝集块间液体清亮明显,均表示布氏杆菌阳性。
1.4 引物设计与合成
根据GenBank中发表的日本乙型脑炎强毒株SA-14株(登录号:M55506)的NS1基因设计1对特异性引物:JEV-F:GGAAGCCTGGGTGGATAGGT,JEV-R:GTAGTGGTTCTGACCGAAGGG,预扩增片段大小为831 bp,引物由英潍捷基(上海)贸易有限公司合成。
1.5 梅花鹿JEV NS1基因的RT-PCR扩增、克隆及序列分析
把送检的4份血样12 000 r/min 离心10 min,分别取200 μL上清,用TaKaRa Min BEST Viral DNA/RNA Extraction Kit Ver.5.0试剂盒提取总RNA,利用日本乙型脑炎NS1基因的引物进行该病毒的鉴定。PCR扩增体系总体积25 μL:2×1 Step Buffer:12.5 μL,DNA模板2.0 μL,上下游引物各1 μL,PrimerScript 1 Step Enzyme Mix:1 μL,用dd H2O补足25 μL。扩增程序为:50℃ 40 min;95℃ 5 min;94℃ 30 s,58.5℃ 30 s,72℃ 30 s,38个循环;72℃ 10 min。反应结束后取6 μL PCR产物于1%的1×TAE琼脂糖凝胶中电泳检测(110 V,35 min),用凝胶成像系统拍照记录。经RT-PCR鉴定阳性的PCR产物送昆泰锐(武汉)生物技术有限责任公司测序,应用DNAStar、MegAlign、MEGA 5.05软件等把测序结果与GenBank上已收录的国内外毒株进行核苷酸同源性分析及构建遗传进化树。
2 结果
2.1 临床症状观察
发病梅花鹿下颌肿大(图1-A),单侧睾丸肿胀(图1-B),前肢关节肿大(图1-C)。

图1 梅花鹿临床症状观察Fig.1 Observation of clinical symptoms of sika deer
2.2 布氏杆菌检测
布氏杆菌虎红平板凝集试验结果如图2所示,015号和039号为布氏杆菌阳性。
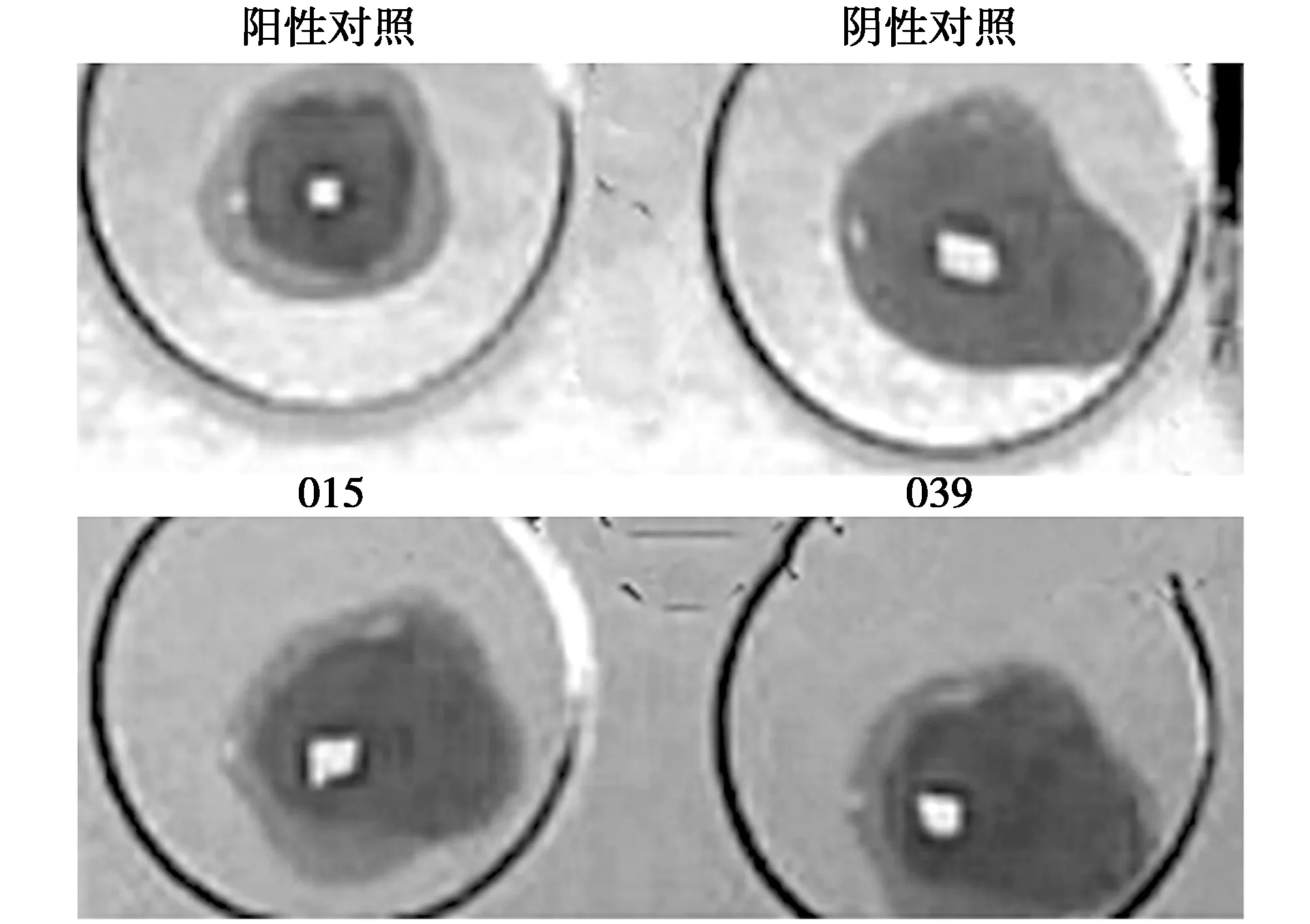
图2 布氏杆菌虎红平板凝集试验结果Fig.2 The Rose Bengal Plate test of brucella
2.3 JEV NS1部分基因的检测及序列分析
JEV NS1基因的RT-PCR扩增结果显示:4份梅花鹿的血样均检测出乙型脑炎病毒NS1基因的特异性条带(图3)。

图3 JEV NS1基因 RT-PCR扩增结果Fig.3 The RT-PCR amplification result of JEV NS1 gene 注:M.DL-2000 Marker;1.阴性对照;2.JEV NS1阳性对照;3.3—6为4头鹿的血液样品检测结果 Note:M.DL-2000 Marker;1.Negative control;2.Ppositive control;3-6.They represent the blood samples of 4 deers
将上述PCR产物送昆泰锐(武汉)生物技术有限责任公司测序,应用MegAlign、MEGA 5.05等软件把测序结果与GenBank上已收录的国内外毒株进行核苷酸同源性分析及构建遗传进化树分析。4份梅花鹿血样检测到的乙型脑炎病毒NS1部分基因序列(GZ-015、GZ-019、GZ-022、GZ-039)间的核苷酸同源性分别为99.9%、99.3%、99.4%,与强毒株SA-14、国内外的疫苗株及四川、吉林等地的JEV分离株之间核苷酸同源性为99%以上(图4)。
遗传进化树分析结果显示:GZ-015、GZ-019、GZ-022、GZ-039与强毒株SA-14、弱毒株、国内外的疫苗株及四川、吉林等地的JEV分离株处于同一个较大的遗传进化分支(图5)。

图4 JEV NS1基因核苷酸同源性分析Fig.4 The nucleotide homology analysis of JEV NS1 gene

图5 JEV NS1基因遗传进化树分析Fig.5 The genetic evolutionary tree analysis of JEV NS1 gene
3 讨论
曾认为乙型脑炎只在单蹄兽中发生,反刍兽都隐性感染不出现临床症状,1980年长春市动物园因病损失仔鹿百余头,试验结果表明被检病鹿的死因是由JEV感染所致[6]。1980—1983年,在马属动物流行期间,有的鹿场发现了具有中枢神经症状和后躯麻痹的病鹿,经过调查与研究,确认在具有中枢神经症状和后躯麻痹症候群的病鹿中,有日本脑炎病例[7]。据报道,1986年调查吉林省鹿群中日本脑炎中和抗体阳性率在60%—90%,但很少出现临床症状和病死现象,说明病鹿多数以隐性经过[3]。
本次检测贵州某梅花鹿场的发病梅花鹿出现下颌肿大、单侧睾丸肿胀、前肢关节肿大等症状,015号血清和039号梅花鹿的血清检测出了布氏杆菌感染,采集的4份血样均检测出了日本乙型脑炎病毒感染,4份梅花鹿血样检测到的乙型脑炎病毒NS1部分基因序列(GZ-015、GZ-019、GZ-022、GZ-039)间的核苷酸同源性分别为99.9%、99.3%、99.4%,与强毒株SA-14、国内外的疫苗株及四川、吉林等地的JEV分离株之间核苷酸同源性为99%以上。遗传进化树分析结果显示:GZ-015、GZ-019、GZ-022、GZ-039与强毒株SA-14、弱毒株、国内外的疫苗株及四川、吉林等地的JEV分离株处于同一个较大的遗传进化分支,说明本次从梅花鹿血样中所检测到的JEV NS1基因未发生变异。研究揭示黄病毒NS1的基因和表型具有高度同源性,其核酸序列可适用于7 种黄病毒,其中就有JEV,这就为NS1可能发展成为一种具有广泛作用的黄病毒亚单位疫苗提供了理论依据[8]。金吉东[9]克隆了日本脑炎病毒 SA-14-14-2 株NS1基因测定并分析了其核苷酸序列,结果表明NS1基因编码区全长为1 087 bp 编码358 个氨基酸与GenBank 中收录的同类毒株NS1基因序列完全一致,表明在该疫苗株多年应用过程中 NS1 基因未发生变异,提示该疫苗株遗传性状比较稳定。
药物治疗对病毒无效,结合4份梅花鹿血样JEV NS1部分基因的测序分析结果,可对未发病的梅花鹿紧急使用日本脑炎弱毒活疫苗来预防该病的发生,对血清凝集反应呈阴性的梅花鹿进行布鲁氏菌羊型疫苗接种。有症状的和无症状的分开饲养,无症状的经血清凝集反应试验呈阴性的和呈阳性的隔离饲养,对有症状的和无症状但凝集反应试验呈阳性的梅花鹿进行扑杀、烧毁及深埋处理。

