合欢枯萎病菌的分离鉴定和培养特性
蔡 悦,王储炎,黄明华,程俊文,钱中一,葛春梅,*
(1.合肥学院 生物与环境工程系,安徽 合肥 230601; 2.中徽生态环境有限公司,安徽 合肥 230001; 3.浙江省林业科学研究院,浙江 杭州 310023)
合欢(AlbiziajulibrissinDurazz)又名绒花树,分类上属于豆科含羞草亚科合欢属。因其树姿优美,气味芬芳,是城市绿化和庭院点缀的观赏佳木,在园林绿化中被广泛应用。吴玲等[1]于1990年首次发现合欢枯萎病,其病原为尖孢镰刀菌变异型(Fusariumf. sp),具有极强的致病性。近年来,合欢树因感染枯萎病死亡的问题日益凸显,在北京、天津、山东、河北、河南、江苏和安徽等多个地区均有报道[2-4]。由于病害发生具有隐蔽性,早期不易诊断而失去防治机会[5];而且传播速度快,病菌定殖后根除困难,植株死亡率超过30%[6],严重影响合欢发挥绿化观赏价值和生态效益,造成不可挽回的经济损失。除此之外,合欢的药用价值高,其提取物还具有抗抑郁作用[7]。由于巨大的商业价值合欢病害在国外已受到关注。Luongo等[8]通过研究发现Phytophthoratropicalis是造成意大利合欢树根腐病的主要病原,该菌孢子囊易脱落且生存力强,已被视为农业和自然环境中的严重威胁。国内已报道的合欢枯萎病病原菌有尖孢镰刀菌[9]、尖孢镰刀菌变型[10-11]和尖孢镰刀菌致病型[12]等。曹杰等[13]对合欢病样进行分离纯化后将病原鉴定为尖孢镰刀菌,并通过灌根接种试验发现,该菌分离物可使树苗发生枯萎病症,且获得的菌丝和分生孢子与接种前的菌株在形态上一致。Baayen等[14]利用测序联合扩增片段长度多态性(AFLP)方法对引起植物萎蔫病的F.oxysporum复合种进行系谱分析,结果显示通常认为的非致病镰刀菌并未在分子系统树(基因家谱)中形成单独分支,因此F.oxysporum复合种的命名体系尚存在缺陷。总体上看,目前国内主要关注对农作物、果树和蔬菜等枯萎病害的筛选,对林业病害特别是景观植物的研究力度还不够;报道的合欢枯萎病原菌种类较单一,且大部分侧重病原菌生物学特性和防治效果的研究,对病菌的鉴定结果主要依据形态学特征,少量的分子鉴定也仅停留在序列比对层面,并未对病菌组成和系统发育关系进行分类学研究。
由于化学防治不仅杀伤天敌、污染环境,还会破坏生态平衡,形成愈来愈严重的“3R问题”,枯萎病害的防治措施已逐渐向环境友好、对人畜安全的生物防治转变。同时,生物防治中使用的微生物具有改善环境、获得长期效益的作用,符合现阶段植物病害控制的发展方向[15]。使用F.oxysporum复合种概念不仅在分类和系统演化上造成混乱,而且对开发防治药剂也有不利影响。为探索合欢枯萎病病菌类型,本研究利用形态学和分子生物学方法,对来自罹病合欢根、茎、枝的病菌进行分类鉴定,进而考察碳源、氮源、温度和pH对病菌生长的影响,以期明确菌种类型及其生长条件,为实践中合欢病害检测、预报及防治药剂开发提供参考。
1 材料与方法
1.1 试验材料
合欢枯萎病样品采集于中徽生态环境有限公司园林培育基地,位于安徽省合肥市长岗镇。2015年4月和6月分别从发病合欢树根、茎、枝采集20份枯萎病标本。样品带回实验室后置于4 ℃冰箱保存,1周内分离。
1.2 菌株分离纯化
病菌分离采用组织块分离法[16]。无菌条件下将病原组织接种至SDAY平板,每个平板接4个组织块,每份样品设置3个平行,置于28 ℃恒温培养。待菌落长出,挑取不同特征菌落边缘菌丝至PDA平板(含0.04%青霉素和0.1%链霉素)划线分离,直至获得单一的纯菌株为止。将纯化获得的菌株保存于PDA斜面,置于4 ℃冰箱备用。
1.3 形态学与分子鉴定
1.3.1 培养性状
供试菌株在PDA平板上活化3~5 d,在菌落边缘取直径5 mm的菌丝块接至新平板;对产孢量较大的菌株,先于PDA培养液中培养3 d生成菌丝团,再挑取菌丝团转接PDA平板[17]。28 ℃恒温培养7 d,十字交叉法测量菌落生长直径。观察记录菌落形态、色泽和生长状况等宏观培养性状。
1.3.2 微观形态特征
观察分离纯化的菌株,待产孢后挑取少许培养物至载玻片,制成临时水封片,在Motic数码显微镜下观察菌丝、产孢结构和孢子形态,并用测微尺测量孢子大小。根据菌落形态和微观特征将病菌初步鉴定到属。
1.3.3 病菌分子生物学鉴定
采用改良的氯化苄法提取病原菌基因组DNA[18],扩增菌株的ITS1-5.8S-ITS2 rDNA序列,上游引物ITS5(5’-GGAAGTAAAAGTCGTAACAAGG-3’),下游引物ITS4(5’-TCCTCCGCTTATTGATATGC-3’)[19]。扩增反应在BIO-RAD公司S1000TMThermal Cycler上进行。反应体系:模板DNA 1 μL、10×Buffer(含Mg2+)2.5 μL、25 mmol·L-1dNTP 0.5 μL、10 mmol·L-1引物各1 μL、5 U·μL-1Taq酶0.2 μL,ddH2O补足体系至25 μL。ITS-PCR反应条件:95 ℃预变性1 min;95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸45 s,35个循环;72 ℃延伸10 min。PCR产物使用1%琼脂糖凝胶电泳检测,委托生工生物工程(上海)股份有限公司进行序列测定。
扩增获得的rDNA-ITS序列在NCBI网站在线Blast比对,搜索相似性序列,确定匹配值最高的菌株。从GenBank下载相关菌株的同源ITS区序列,BioEdit软件编辑后使用PAUP*4.0b10软件进行系统发育分析。以最大简约法(MP)构建系统进化树,采用启发式搜索和TBR分支交换算法,比对后缺失的碱基视为空格,字符状态转换到最佳。通过1 000次自举值检验分支的支持率[20]。结合形态学和分子生物学鉴定结果将致病菌鉴定到种。
1.4 致病力测定
采用室内离体枝条接种法进行致病力测定。将菌株接至PDA平板28 ℃培养5 d,选取典型菌株1-2、2-3、3和4备用。从中徽生态环境有限公司培育基地选取长约40 cm,直径10~20 mm健康合欢枝条,75%乙醇擦拭消毒,无菌水冲洗3次后自然晾干,枝条两端用石蜡封口。沿菌落边缘取直径5 mm的菌丝块接种于枝条上,每个枝条等间距接种3个点。枝条分无伤和刺伤2种处理,每处理5根枝条,重复3次,以接种无菌PDA培养块为对照。接种后置于密封保湿的保鲜盒内,25 ℃恒温培养,观察并记录发病情况。
1.5 病菌的培养特性
1.5.1 碳源对病菌生长的影响
以PDA为基础培养基,其中葡萄糖分别用等量碳的蔗糖、乳糖、甘油、可溶性淀粉等替代,配制为不同的碳源培养基。从已活化菌株的菌落边缘取直径5 mm菌丝块分别接种于不同培养基,每个处理3次重复。28 ℃恒温培养,逐日观察菌落形态,4 d后采用十字交叉法测量菌落直径[21]。
1.5.2 氮源对病菌生长的影响
以改良的PDA培养基(马铃薯200 g、葡萄糖20 g、乙酸铵1.5 g、琼脂20 g、水1 000 mL)为基础培养基,乙酸铵分别用等量氮的草酸铵、硝酸钠、硫酸铵、磷酸氢二铵等替代,配制为不同的氮源培养基。接种和测量方法同1.5.1节。
1.5.3 pH对病菌生长的影响
菌丝块接种于不同pH值(pH 3.0~11.0)的PDA平板。置于28 ℃下培养,每个处理3次重复[22]。测量方法同1.5.1节。
1.5.4 温度对病菌生长的影响
菌丝块接种于PDA平板上,分别置于不同温度(20~36 ℃)下培养,每个处理3次重复[22]。测量方法同1.5.1节。
2 结果与分析
2.1 病菌的分离和形态学
2.1.1 培养性状
样品经过常规分离得到7株镰刀菌,各菌株的宏观形态、色泽和生长状况等培养性状如下:菌株1-2,菌落呈圆形,灰白色、直径6 cm,绒毛状,菌丝密集,表面有水分分泌;菌株2-3,菌落灰白、圆形,直径7.5 cm,菌丝密集,菌落表面有水分分泌;菌株3,菌落直径7.5 cm,圆形,产生大量气生菌丝,生长旺盛,呈浅粉色;菌株3-1,菌落近圆形,中部浅黄色,周边呈浅橙色,直径6.7 cm,菌丝密集;菌株3-2,菌落圆形、灰白色,直径7 cm,绒毛状,菌丝密集,背面中心呈浅橙色;菌株4,菌落圆形,外边缘处有灰白色的圆环,菌丝稀疏粘滑,直径约7 cm;菌株10,圆形,白色棉絮状,菌丝稀疏,背面呈现淡黄色,直径6.5 cm。
2.1.2 微观特征
菌株1-2营养菌丝细长,小型分生孢子单生于瓶梗,在梗顶端形成淡色的孢子团;孢子椭圆形,大小(4.8~9.5)μm×(2.6~4.6)μm,长宽比1.86,大型分生孢子缺或很少(图1)。菌株2-3孢梗束较长,多分枝,小型分生孢子在产孢细胞端部呈球状团簇,镰刀形或新月形,大小(4.8~8.0)μm×(1.6~3.1)μm,长宽比2.72;大型分生孢子未见(图2)。菌株3分生孢子梗单生或形成孢子座,大型分生孢子长椭圆形或镰刀形,无色,内有分隔,中部膨大两端渐尖或呈鸟嘴状,多为3~4分隔,大小(18.7~31.0)μm×(2.5~4.9)μm,长宽比5.35;孢子梗表面光滑,有分支并在顶端产孢;小型分生孢子少见(图3)。菌株3-1营养菌丝孢子梗光滑,端部膨大形成小泡,分生孢子在孢梗束上顶生或者侧生,大型分生孢子长棒状或月牙形,大小(15.5~28.4) μm×(3.4~4.8)μm,长宽比5.35(图4)。菌株3-2营养菌丝茂密,小型分生孢子产于有柄单生孢梗,有隔,数量较多,易形成孢子团;孢子中部膨大两端变窄,呈长椭圆形或卵形,大小(5.7~11.1)μm×(2.7~5.5)μm,长宽比1.94;大型分生孢子数量少或缺(图5)。菌株4孢子多产于单瓶梗顶端,瓶梗较长;小型分生孢子0~1隔,卵形或肾形,大小(4.5~10.3)μm×(1.5~3.4)μm,长宽比1.85;大型分生孢子分隔1~4个,多为3分隔;两端较钝,茄形、椭圆形或镰刀形,大小(9.4~29.3)μm×(2.5~6.3)μm,长宽比4.41(图6)。菌株10分生孢子梗较长,孢子产生于瓶梗顶端,小型分子孢子数量多,椭圆形和卵形,无隔或1隔,单生或假头状着生,大小(3.5~7.2)μm×(1.9~3.6)μm,长宽比1.95;大型分生孢子以3分隔居多,3分隔以上少见,两端略弯曲较钝,卵形或月牙形;孢子大小(8.5~36.2)μm×(2.7~6.6)μm,长宽比4.81;还存在少量厚垣孢子,多呈球形(图7)。
2.2 病菌的分子鉴定

图1 菌株1-2的显微形态特征Fig.1 Microscopic characteristics of strain 1-2
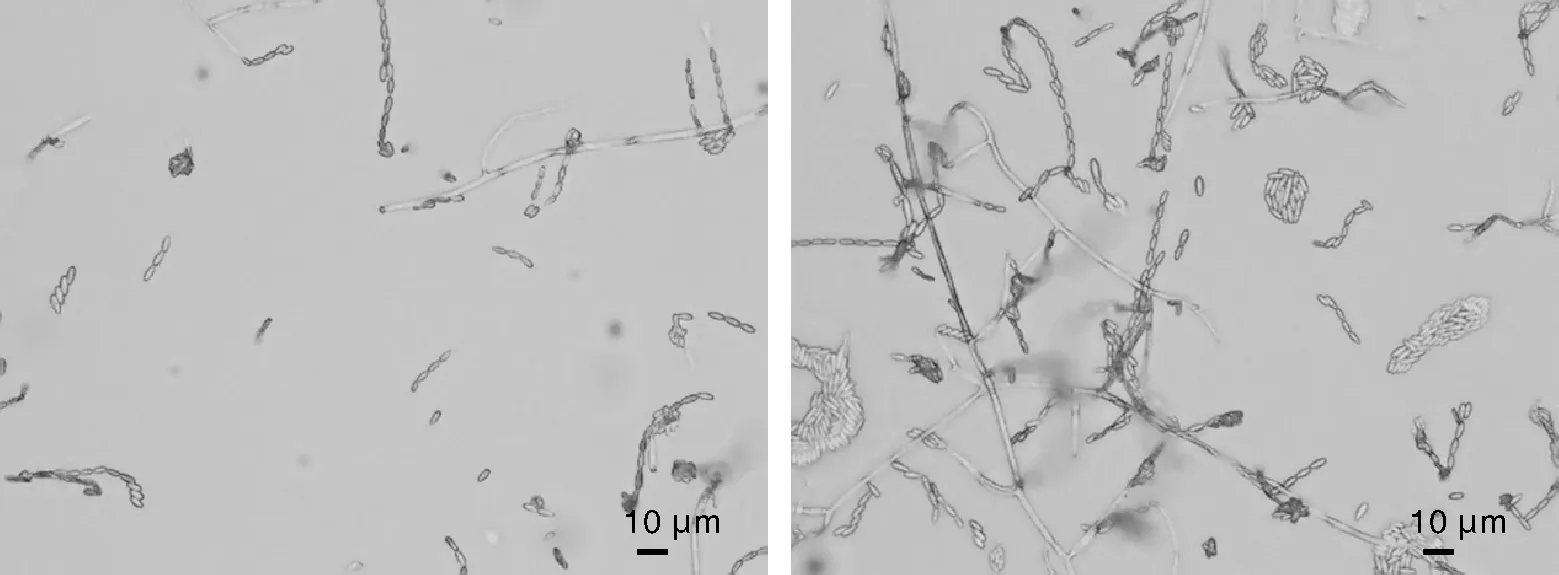
图2 菌株2-3的显微形态特征Fig.2 Microscopic characteristics of strain 2-3

图3 菌株3的显微形态特征Fig.3 Microscopic characteristics of strain 3

图4 菌株3-1的显微形态特征Fig.4 Microscopic characteristics of strain 3-1

图5 菌株3-2的显微形态特征Fig.5 Microscopic characteristics of strain 3-2
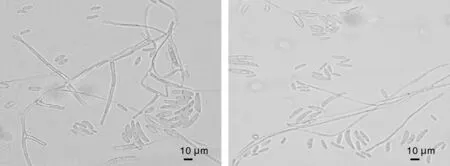
图6 菌株4的显微形态特征Fig.6 Microscopic characteristics of strain 4

图7 菌株10的显微形态特征Fig.7 Microscopic characteristics of strain 10
2.2.1 序列特征
以ITS5/ITS4为引物,扩增获得病菌rDNA-ITS区序列(图8)。各菌株序列比对信息结果见表1。
2.2.2 系统发育树
序列分析比对结果表明:7株致病菌均为镰刀菌属(Fusarium),该属真菌在罹病合欢组织中广泛存在,是导致合欢染病的重要因子。从Gen-Bank中下载Fusarium属18个代表种rDNA-ITS序列,以丛赤壳属(Nectriasp.)为外群构建系统发育树。建树序列总长540 bp,保守位点376个,变异位点51个,简约信息位点113个。树长253,一致性指数0.794 5,类似指数0.205 5,保留指数0.904 2,调整后的一致性指数为0.718 4。建树结果表明,菌株3和3-1与F.equiseti明显地聚为同一分支(自举检验值98),2-3与F.proliferatum聚为一支,而菌株4和10与F.oxysporum聚为一类,1-2和3-2则与F.solani聚为一类。尽管菌株4的ITS序列与F.solani(KM268684)相应位点的覆盖率和相似度分别达到100%和99%,在系统发育树中4和10一起以99的支持率与F.oxysporum(KJ573079)聚为一支,而与F.solani(KJ573076)的距离较远,意味着菌株4应与F.oxysporum在同一进化水平。综上所述,将菌株3、3-1鉴定为木贼镰刀菌(F.equiseti),2-3为层出镰刀菌(F.proliferatum),4、10为尖孢镰刀菌(F.oxysporum),1-2、3-2为腐皮镰刀菌(F.solani)。

10、4、3-2、3-1、3、2-3、1-2为菌株编号。10, 4, 3-2, 3-1, 3, 2-3, 1-2 were strain No.图8 致病菌rDNA-ITS产物电泳图Fig.8 Electrophoresis of rDNA-ITS products of pathogens
表1菌株ITS区产物比对结果
Table1Blast description based on ITS sequences

菌株编号StrainsITS产物ITS products/bp覆盖率Query cover/%相似度Identity/%Blast比对结果Blast descriptionGenBank登录号GenBank accession number1-25959899F. solaniKY3077862-358510099F. proliferatumHF93059435739999F. equisetiKR3645973-157610099F. equisetiEU3262023-25849799F. solaniFJ914886459510099F. solaniKM2686849999F. oxysporumJF439472105809999F. oxysporumJF439472

Bootstrap支持率≥50%已在分支上分别显示,GenBank登录号在菌种名称后注明。Nodes that received ≥50% bootstrap support values were indicated. GenBank accession number were followed the species.图9 基于ITS序列的Fusarium属系统进化树Fig.9 Phylogeny of Fusarium based on ITS sequence
2.3 病菌致病力
离体枝条接种试验表明,菌株4在刺伤处理下可使枝条发病。接种8 d,刺伤处理表面菌丝开始蔓延,部分枝条出现褐色斑点;接种15 d后刺伤处理组菌丝生长旺盛,枝条接种处出现褐色病斑并被菌丝覆盖,部分病斑处有淡黄色液体渗出。接种20 d后刺伤处理表面被菌丝和分生孢子完全覆盖,接种处深褐色并向四周扩展,树枝开始干枯,皮孔开裂并溢出汁液。无伤处理表面接种的菌种生长缓慢,部分枝条接种处有颜色变深现象,但整体无明显变化;而菌株1-2、2-3和3刺伤接种20 d,只有少数枝条出现轻微感染病状,菌丝生长缓慢,用酒精棉擦去菌丝观察,并未发现维管束褐变,表明这3种病菌对合欢的致病力弱。所有对照组枝条均未发病。从发病枝条上分离纯化致病菌,获得的菌株与原接种物的培养性状和微观特征一致,证明接种菌为合欢枯萎病原菌。
2.4 病菌的培养特性
2.4.1 碳源对病菌生长的影响
由图11可知致病菌均可利用供试碳源。其中,菌株1-2在以蔗糖和乳糖为碳源的培养基上生长最佳,甘油和葡萄糖次之,可溶性淀粉较差;菌株2-3在以乳糖和甘油为碳源的培养基上生长最好,蔗糖次之,葡萄糖和可溶性淀粉较差;菌株3在以蔗糖为碳源的培养基上生长最佳,乳糖、甘油和可溶性淀粉次之,葡萄糖较差;菌株3-1在以蔗糖和乳糖为碳源的培养基上生长最佳,显著优于甘油、可溶性淀粉和葡萄糖。说明F.equiseti(菌株3、3-1)对蔗糖利用最佳,而葡萄糖较差。菌株4在以蔗糖为碳源的培养基上生长最好,其次是葡萄糖、乳糖和甘油,在可溶性淀粉为碳源的培养基上生长最慢。菌株3-2和10在不同碳源培养基上的菌落直径无显著差异。

A,枝条刺伤处理15 d;B,枝条无伤处理15 d;C,刺伤处理枝条发病症状。A, wounded-inoculated branch 15 days; B, Nonwounded-inoculated branch 15 days; C, Symptoms of wounded-inoculated branch.图10 菌株4的致病力测定Fig.10 Pathogenicity test of strain 4 on the branch
2.4.2 氮源对病菌生长的影响
致病菌均可利用所供氮源且在以硝酸铵为氮源的培养基上生长最好,因此硝酸铵为最佳氮源。除硝酸铵外,F.equiseti(3、3-1)在硫酸铵上生长较好,而草酸铵最差;F.oxysporum(4、10)在磷酸氢二铵上较好,草酸铵最差;F.solani(1-2,3-2)则偏好乙酸铵,草酸铵上同样最差。F.proliferatum(2-3)在乙酸铵平板上生长最慢,此特性与其他病菌均不同。综合菌株对碳(氮)源的利用情况,病菌在不同培养基上的生长速率有较大差异。以F.equiseti为例,在供试的碳氮源中,最大菌落直径与最小菌落直径差异分别为9.7 mm
和46.9 mm,说明氮源对F.equiseti生长的影响程度大于碳源,其他菌株的情况类似。
2.4.3 pH对病菌生长的影响
由图13可知,所有病菌在pH为3.0时生长最慢,菌落直径均显著低于pH为5~11时。除2-3外,各菌株在pH为7.0时生长最快,而2-3在pH 9.0时菌落直径最大(59.1 mm),pH 11.0时也达到52.6 mm且与pH 7时没有显著差异,说明F.proliferatum较其他病菌更耐受偏碱性条件。菌株3、3-1在pH为7.0时生长最快,pH 9.0次之,然后为pH 5.0和11.0;菌株4和10也表现为同样的趋势。总体上看,中性环境有利于致病菌生长,各菌株对不同pH的耐受力存在差异。
2.4.4 温度对病菌生长的影响
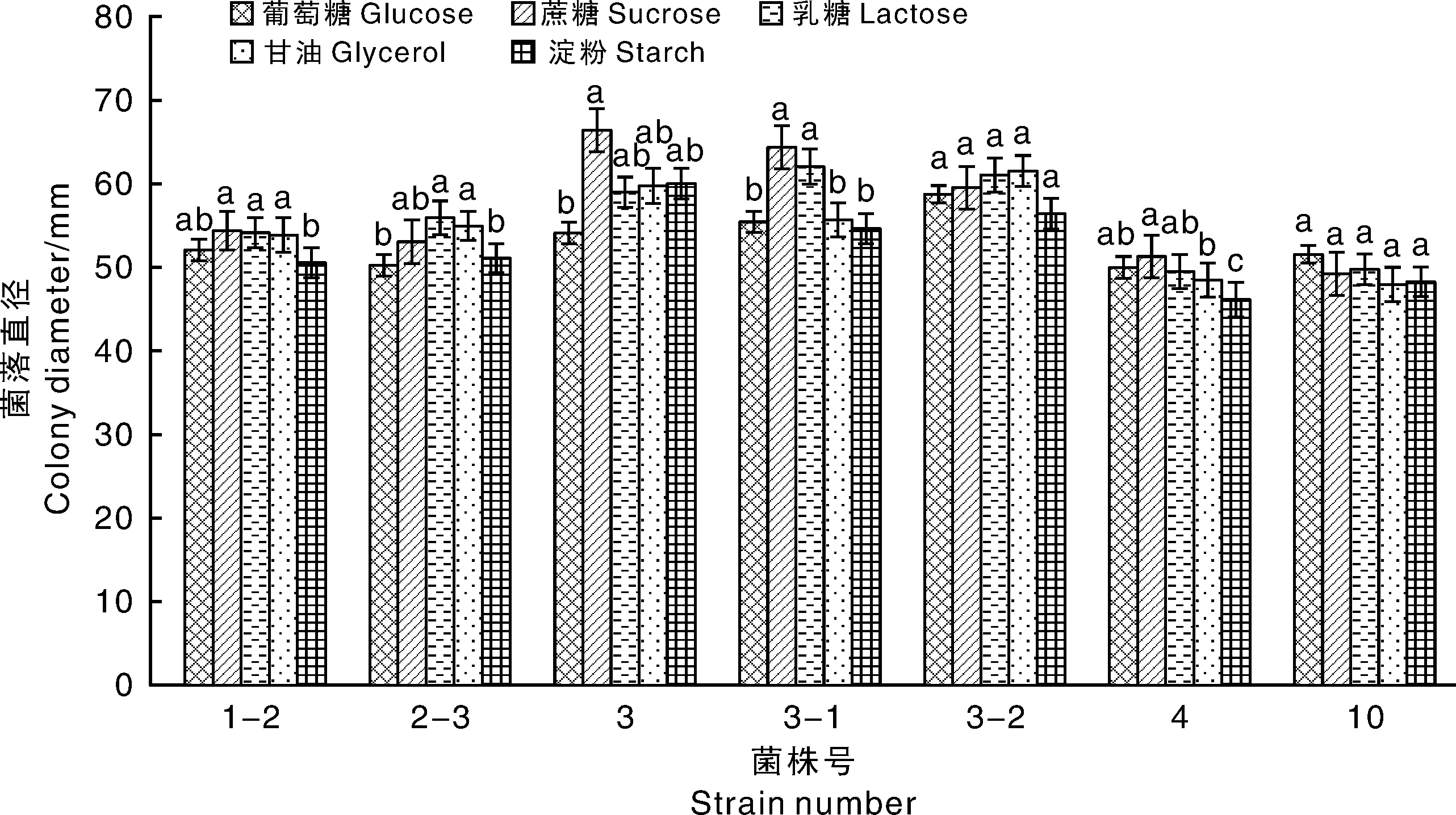
柱上无相同小写字母表示差异显著(P<0.05)。下同。Data on the bars marked without the same lowercase letter indicated significant differences at P<0.05. The same as below.图11 碳源对病菌生长的影响Fig.11 Effect of carbon on mycelia growth of pathogens

图12 氮源对病菌生长的影响Fig.12 Effect of nitrogen on mycelia growth of pathogens
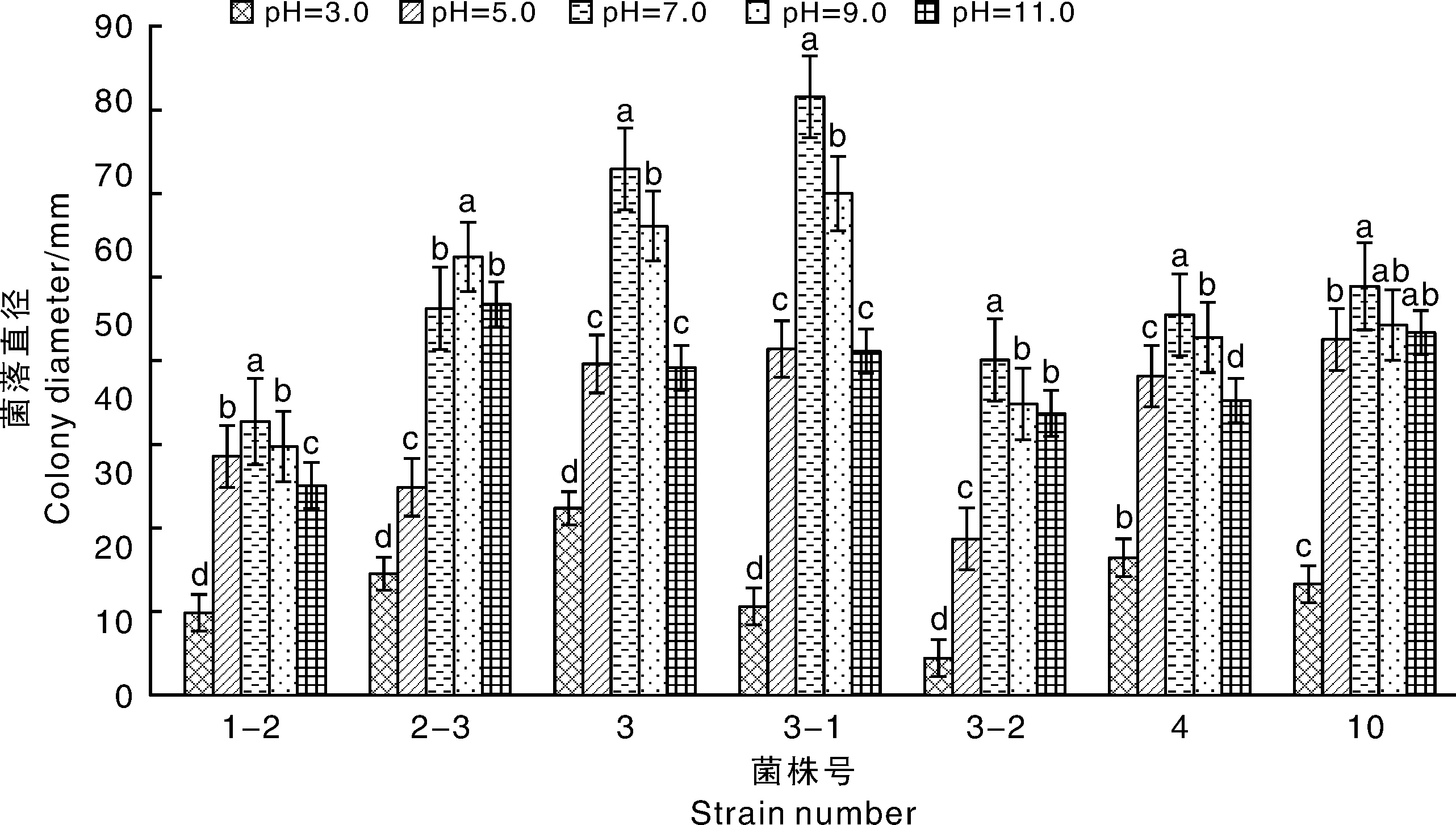
图13 pH对病菌生长的影响Fig.13 Effect of pH on mycelia growth of pathogens
由图14可知,各菌株在20~36 ℃均能生长,20~32 ℃菌落直径显著大于36 ℃,且32 ℃生长最佳。在20~32 ℃,除3-1外,各菌株的菌落直径随着温度降低而显著降低。菌株3-1在28~32 ℃、20~24 ℃的生长情况均不存在显著差异,菌株3在20 ℃时的菌落直径显著大于24 ℃,表明F.equiseti较其他病菌更耐受20~28 ℃的低温环境。总体上看各致病菌生长的最适温度为32 ℃。
3 讨论
由致病性镰刀菌(Fusarium)侵染引起的植物枯萎病是一种世界性的土传真菌病害,可感染包括甜瓜、番茄、棉花和香蕉等在内的100余种作物[23]。在《Molecular Plant Pathology》基于科学和经济重要性提名的十大植物病原真菌中,F.graminearum和F.oxysporum分别位列第四和第五位[24]。随着森林生态效益优势的逐渐显现,开展林木病害菌的筛选和防治工作,将有力促进森林健康,更好维护环境可持续发展[25]。
了解合欢枯萎病菌的种类和生物学特性是开展有效防治的前提和基础,本研究根据形态学和rDNA-ITS序列分析方法对采集的合欢枯萎病样进行分离鉴定,结果表明7株致病菌均为镰刀菌属,分别为F.equiseti(3、3-1),F.oxysporum(4、10),F.solani(1-2、3-2)和F.proliferatum(2-3),其中,F.oxysporum对合欢有强致病力与已有报道一致,而F.solani、F.equiseti、F.proliferatum的致病力较弱。这一差异可能与样本材料选择、采集区位置和气候条件、分离方法等因素有关。尽管前期很多报道将合欢枯萎病原菌描述为F.oxysporum及其变异型,但也有研究发现除尖孢镰刀菌外[26],其他如腐皮镰刀菌(F.solani)与潮湿镰刀菌(F.udum)或层出镰刀菌(F.proliferatum)也可能是枯萎病致病菌[27]。考虑到本研究在进行分离时选用SDAY平板,可能忽视生长慢、不易产孢的菌株,在今后的研究中应注意改进分离方法,以期尽可能获得应有的病原[28]。合欢枯萎病很可能不是由单一病原菌引起,而是多种病原共同作用的结果。镰刀菌是一个庞大而复杂的属,还有许多致病种有待分离和描述,这些病菌通常在基因序列上的亲缘关系更为密切,每种菌的致病作用都可能相当[29]。今后可利用多基因位点对F.oxysporum复合种进一步分割,并选择更多的人工接种方法分别进行致病力测定,以模拟最佳田间发病情况。
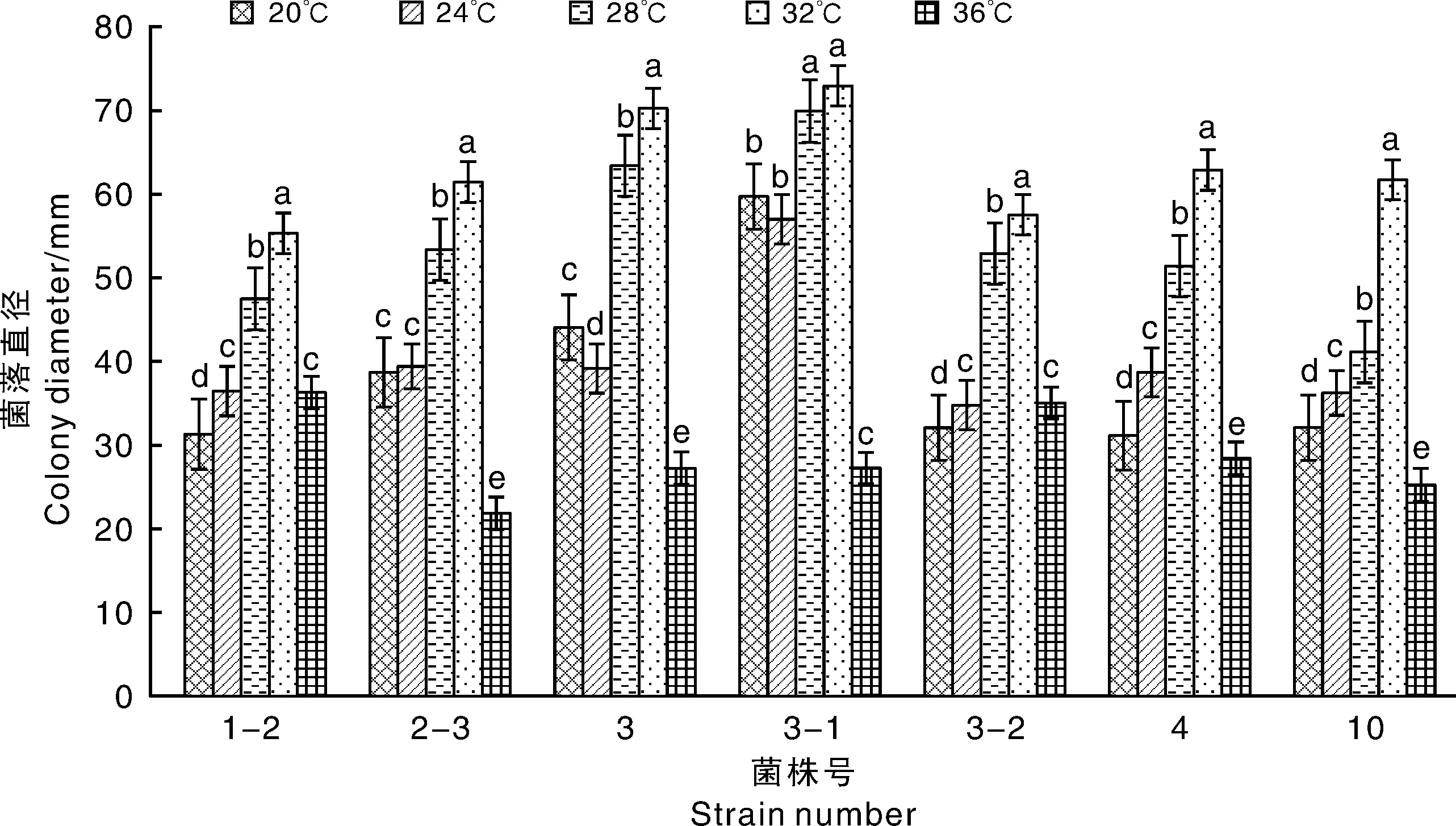
图14 温度对病菌生长的影响Fig.14 Effect of temperature on mycelia growth of pathogens
在枯萎病菌的生物学特性研究中,郑莉等[30]报道F.oxysporium生长最适pH值为6~9,菌丝致死温度为65 ℃,可利用多种糖类碳源和硝酸钠、尿素、硫酸铵等氮源。冯雪等[2]认为合欢枯萎病菌对环境有较强的适应力,最适pH为6,最适温度30 ℃,对蔗糖和可溶性淀粉、硝酸钠和硝酸钙的利用较好。浦冠勤等[10]发现,F.oxysporun最适生长温度为23~29 ℃,在中性偏碱的环境下生长更好,在PDA和PSA培养基上长势一致。综上所述,本研究中F.oxysporum生长最适温度32 ℃与冯雪等[2]的研究接近,尽管最适温度高于上述报道,但与枯萎病发病症状在5月出现,流行期为6~8月的特点较为一致[31]。病菌的最适pH为7.0且F.proliferatum(2-3)和F.oxysporum(10)对碱性条件的耐受力较酸性更强,与浦冠勤等[10]的研究结果一致。除可溶性淀粉外,病菌对供试碳源的利用率较高,与郑莉等[30]结论相同;而最佳氮源为硝酸铵,普遍对草酸铵利用较差的结果与曹君等[21]报道一致。合欢枯萎病菌的培养特性存在若干差异,可能与发病时间、生长环境、植株种类等条件不一致有关。后续研究应围绕菌株致病力、主要入侵途径和综合防治措施等方面展开。
郭甜等[32]通过调查认为,定植合欢属植株有利于土壤有机碳固持,增强种植土壤微生物的活性,提高土壤质量。不同的合欢种类对枯萎病的抗病能力会存在差异,可根据种植的地理位置、环境温度、土壤酸碱度等特征总结枯萎病发生的规律,为今后合欢种植中病害检测、预防和研究提供参考[33]。在合欢枯萎病的防治中应尽可能采取生物防治为主导的综合措施,不宜大量使用杀菌剂。同时避免采用硝酸铵类肥料,通过其他酸性肥料抑制病原菌生长。这对保持种植区土壤生态环境,提高合欢对枯萎病菌的抗性具有重要意义。

