不同品种茶树新梢响应“倒春寒”的转录组分析
王君雅,陈玮,刘丁丁,陈亮,姚明哲,马春雷*
不同品种茶树新梢响应“倒春寒”的转录组分析
王君雅1,2,陈玮1,2,刘丁丁1,2,陈亮1,姚明哲1,马春雷1,2*
1. 中国农业科学院茶叶研究所国家茶树改良中心/农业部茶树生物学与资源利用重点实验室,浙江杭州 310008; 2. 中国农业科学院研究生院,北京 100081
为探究“倒春寒”冻害对不同品种茶树新梢转录水平的影响,本研究以茶园“倒春寒”发生时受冻害和未受冻害的龙井43和中茶126新梢为研究材料,对两组样品进行转录组分析,分别鉴定到1 012个和1 079个差异基因,以及284个共同差异基因。从中选取18个差异基因进行实时荧光定量PCR验证,结果与转录组测序结果基本一致,证明转录组数据可靠。利用GO和KEGG数据库,对差异基因进行代谢通路富集分析,发现两个品种的差异基因主要集中在光合作用、碳代谢和细胞色素P450等代谢进程,说明“倒春寒”对新梢生长发育相关的基础代谢造成了严重损伤,抑制了相关基因的正常表达;随后对284个共同差异基因进行表达聚类分析,结果表明,其中99个差异基因在两个茶树品种中的表达模式完全相反,涉及的生物过程包括MAPK信号通路、谷胱甘肽和苯丙烷代谢等,推测这些差异基因与龙井43和中茶126在受到低温胁迫后产生的不同信号传导模式有关。
茶树;倒春寒;转录组;差异基因
茶树[(L.) O. Kuntze]抗寒性研究包括茶树抵御低温的越冬抗性和春季抗“倒春寒”能力这两个方面。早期大多数研究主要围绕前者开展,多以茶树的成熟叶片为研究对象,通过对茶树叶片的形态结构、细胞膜透性、细胞液浓度,以及超氧化物歧化酶、过氧化氢酶等保护性酶活性进行检测,从而实现抗寒茶树资源的鉴定筛选。而随着分子生物学技术在茶学研究中的不断应用,很多低温响应相关的基因也得到克隆和鉴定,如Wang等[1]采用抑制性消减杂交技术对低温处理前后的茶树叶片进行检测分析,筛选到10个在茶树中受低温诱导表达的基因,包括β-淀粉酶、查尔酮合成酶和黄酮醇合成酶基因等。Wang等[2]分离克隆了2个茶树低温响应相关的转录因子和,并且发现4℃处理茶树叶片后,的表达快速升高。随后,茶树精胺合酶[3]、CsbZIP转录因子[4]、H1组蛋白家族成员[5-6]、NAC转录因子家族[7]、水通道蛋白[8]等均被报道在茶树低温响应过程中起重要调控作用。Wang等[9]通过对冷驯化不同阶段的茶树成熟叶片进行全转录组分析,发现糖代谢和Ca2+信号途径在茶树冷驯化过程中起关键作用。这2个途径相关基因在茶树低温响应中的作用在后续的研究中被进一步证实[10-12]。
近些年,由于“倒春寒”对江南茶区和江北茶区的绿茶生产造成严重损失[13],茶树响应“倒春寒”的机理研究越来越受关注。如Hao等[14-15]利用人工气候室模拟茶树冷驯化、脱驯化和“倒春寒”冷胁迫的发生条件,对龙井43不同发育时期的新梢进行比较转录组分析和代谢组分析,提出4℃是茶园“倒春寒”发生的温度阈值,并推测MAPK介导的乙烯和钙离子信号是茶树新梢响应“倒春寒”的两个主要早期途径。而在自然条件下,“倒春寒”对茶树的影响是一个复杂的生物学现象,涉及到茶园的生态环境、小气候条件、栽培模式,以及不同茶树品种的抗寒性、芽叶形态、物候期等。因此,本研究以“倒春寒”发生时两个茶树品种受冻害和未受冻害的新梢为研究材料,比较分析二者的转录水平差异,以期为茶树响应“倒春寒”机制研究提供新的理论依据。
1 材料和方法
1.1 试验材料
试验材料为2018年春季“倒春寒”发生时,栽植于国家种质杭州茶树圃内的十年生龙井43和中茶126新梢。物候期观测结果显示,龙井43的一芽一叶期为3月19日,一芽二叶期为3月26日,中茶126的一芽一叶期为3月15日,一芽二叶期为3月23日。2018年4月份杭州遭遇低温寒潮,气温从四月初开始持续降低(图1-A),4月7日晚间气温降至6℃,8日早上茶园发生明显的霜冻现象,霜冻后两个品种未受冻害的正常新梢仍然保持嫩绿色,而受冻害的新梢呈现黄褐色。课题组于同一时间分别选取两个品种未受冻害(CK)和受冻害(CS)的一芽二叶新梢(图1-B),用液氮固定后保存于–80℃超低温冰箱,用于后续的转录组测序和RT-qPCR验证。
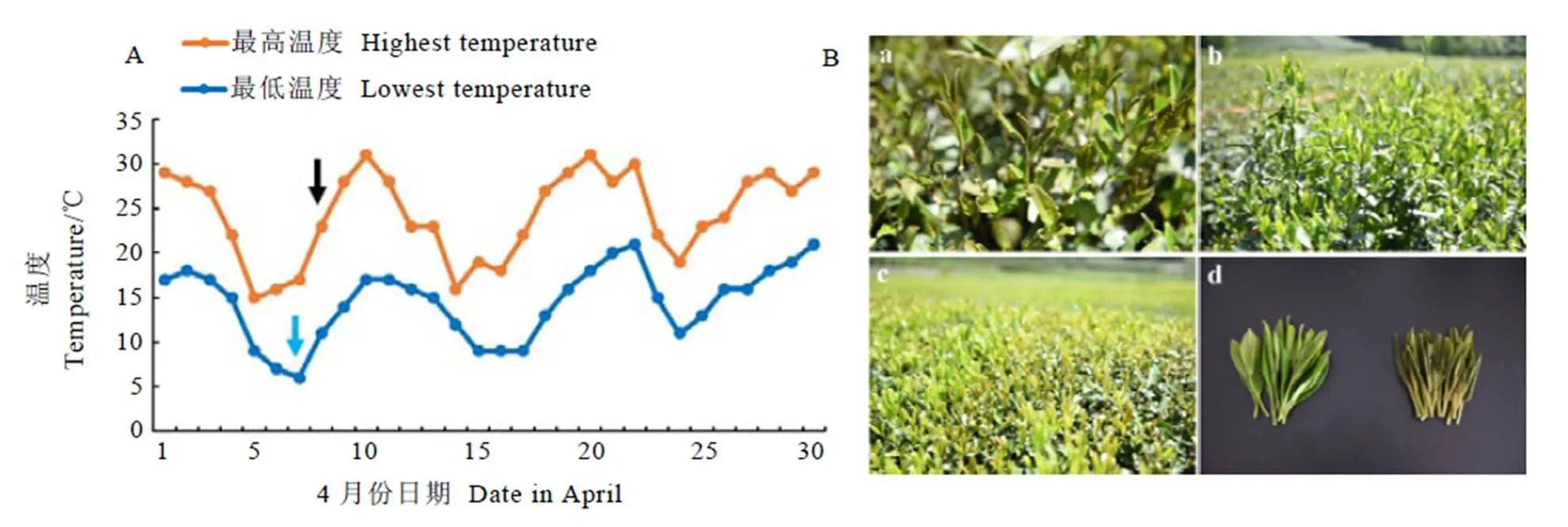
注:A:蓝色箭头代表日气温降至最低的日期,黑色箭头表示取样时间;B:a:中茶126受冻害新梢;b:中茶126未受冻害新梢;c:龙井43受冻蓬面;d:龙井43受冻害和未受冻害新梢比较
1.2 样本总RNA提取和cDNA文库构建
使用Trizol试剂盒提取各样本的总RNA,通过琼脂糖凝胶电泳和Agilent 2100 Bioanalyzer检测RNA的浓度和质量,利用mRNA特有的polyA结构纯化总RNA中的mRNA,再通过离子打断的方式,将mRNA打断成200~300 bp片段,以此为模板,通过随机引物和逆转录酶相继合成cDNA第一链和第二链,构建链特异性文库。采用PCR扩增进行文库片段富集,通过Agilent 2100 Bioanalyzer对文库片段进行质检,为各样本的cDNA文库加上不同index序列,按比例混合,稀释到2 nmol·L-1,通过碱变性形成单链文库。
1.3 Illumina测序、数据质检和参考基因组比对
通过Illumina HiSeq测序平台,对文库片段进行双末端(Paired-end,PE)测序,得到原始下机数据fastq文件。使用FastQC软件的默认参数对fastq文件进行测序质量统计,使用Cutadapt软件进行reads的过滤和去除低质量序列(overlap≤10 bp,20%的碱基错误率),最终得到高质量的clean reads。再通过Bowtie2和Tophat2将clean reads比对至舒茶早茶树参考基因组[16],得到SAM/BAM比对结果文件。
1.4 基因表达量分析
利用SAM/BAM文件和参考基因组的结构注释GTF文件,通过HTseq软件的union方案统计比对至每个转录本的reads数目,用FPKM对转录本的表达量进行标准化。采用DEGseq软件进行差异基因筛选,差异基因的筛选条件为:表达差异倍数|log2FoldChange|>1(FoldChange=CS/CK),显著性-value<0.05。
1.5 差异基因富集分析和表达分析
利用GO和KEGG公共数据库,以整个基因组为背景,利用超几何分布计算差异基因显著富集的GO term和KEGG pathway,以确定差异基因显著富集的GO功能条目以及主要参与的代谢途径和信号通路。利用Pheatmap软件绘制各样本中基因表达量的热图。
1.6 实时荧光定量PCR验证

表1 RT-qPCR引物序列
2 结果与分析
2.1 转录组数据质控和参考基因组比对结果
本次试验共构建了4个cDNA文库,根据每个文库下机数据的碱基错误率、高质量reads数目和数据量统计结果(表2),结合单碱基质量分布图、碱基含量分布图,以及reads平均质量分布,表明本次RNA-seq测序错误率小、单碱基质量高、无AT/CG分离。Clean reads与舒茶早茶树参考基因组的比对结果显示,各样品的clean reads与参考基因组的比对率达到79%,其中在基因组上比对位置单一的clean reads中,比对至基因外显子区域的reads数占比高于85%,结合测序reads在基因上覆盖度的分布情况,说明本次RNA-seq的reads整体测序质量好、与参考基因组的比对率高,符合后续分析要求。
2.2 差异基因分析
两个组合差异基因的基本分布图显示(图2),龙井43的受冻新梢与正常新梢相比,一共检测到1 012个差异表达基因,其中上调的有438个基因,下调的有532个基因;中茶126的受冻新梢与正常新梢相比,共检测到1 079个差异表达基因,其中上调的有452个基因,下调的有627个基因。两个组合的差异基因用韦恩图呈现,结果显示有284个基因在两个品种中都呈现差异表达,可能与其共有的“倒春寒”响应模式有关。
2.3 差异基因的GO富集分析
GO功能富集分析结果显示(图3),龙井43受冻新梢与正常新梢的差异表达基因一共被显著富集到34个GO功能类别。在最显著的GO功能类别中,属于分子功能类别的有叶绿素/色素结合、金属离子/阳离子结合等;属于细胞组分类别的有光合系统、类囊体、膜蛋白复合体等;属于生物过程类别的有光合作用、光吸收、光反应等。中茶126受冻新梢和正常新梢的差异基因GO功能富集结果与龙井43相似,除了具有二者相同的富集功能外还包含质子ATP酶活性、质子跨膜转运、嘌呤核苷三磷酸生物合成等。表明倒春寒冻害使两个品种的光合作用和碳代谢等基础代谢发生了巨大的变化,中茶126的细胞膜受倒春寒冻害的影响可能较龙井43显著。叶绿体等细胞器对低温极为敏感,低温霜冻会导致叶绿体内部结构的瓦解,抑制新梢的光合作用,影响叶绿体结构和光合作用相关基因的表达,其中包括细胞核中的叶绿体蛋白编码基因和叶绿体基因。

表2 测序数据统计
注:LJ43_CK:未受冻害的龙井43新梢;LJ43_CS:受冻害的龙井43新梢;ZC126_CK:未受冻害的中茶126新梢;ZC126_CS:受冻害的中茶126新梢。下同
Note: LJ43_CK: unfrozen shoots of LJ43. LJ43_CS: frozen shoots of LJ43. ZC126_CK: unfrozen shoots of ZC126. ZC126_CS: frozen shoots of ZC126. The same below

图2 两个品种的差异基因火山图(A,C)和韦恩图(B)
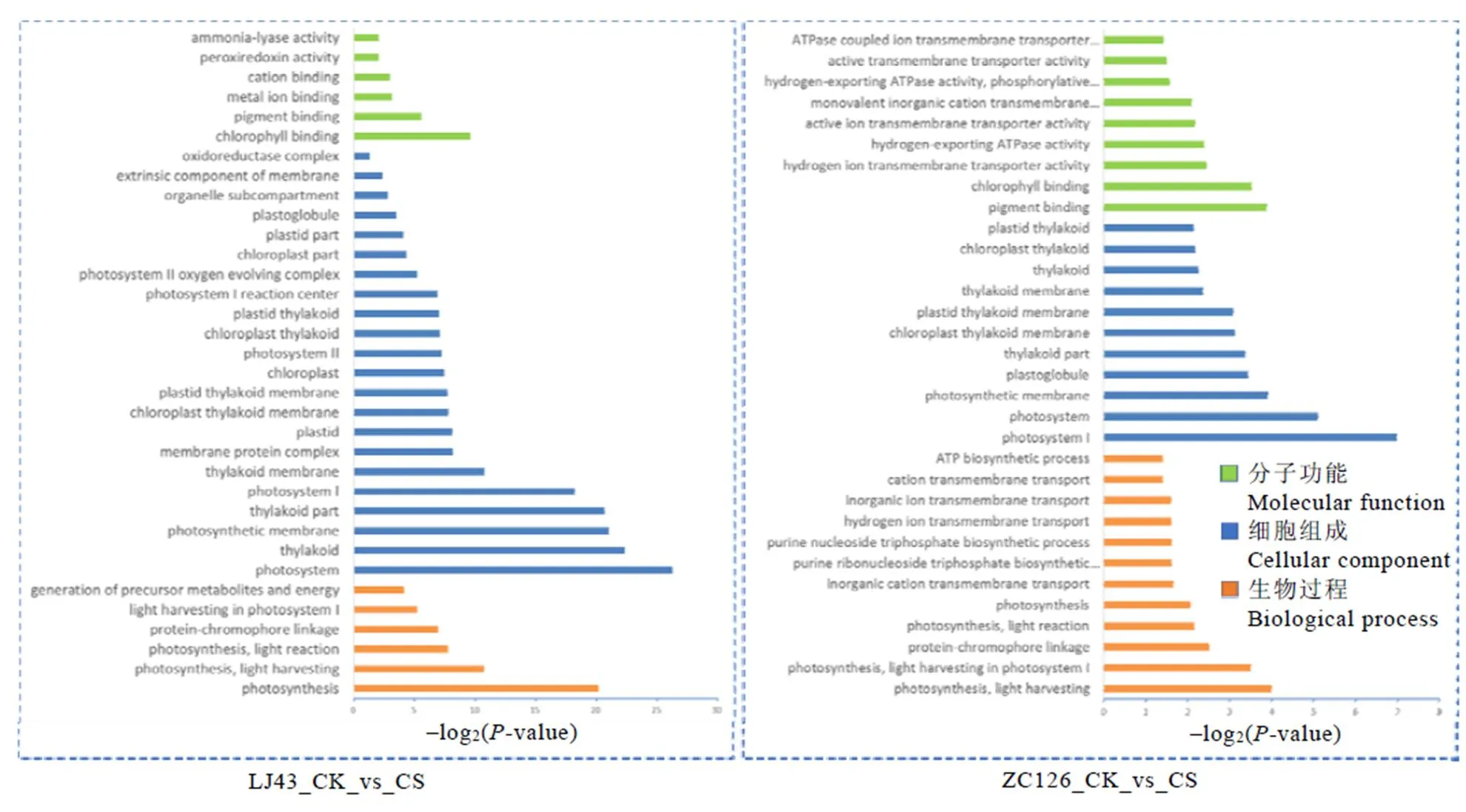
图3 两个品种差异基因显著富集的GO分类
2.4 差异基因的KEGG富集分析
KEGG代谢通路富集分析结果显示(图4),在两个品种中均显著富集的代谢通路有光合作用、细胞色素P450以及碳代谢等。其中龙井43和中茶126分别有38个和18个差异基因富集在光合作用代谢通路中,包括编码光吸收复合体蛋白、铁氧还蛋白、光系统I亚基,光系统II亚基的相关基因,这些基因在受冻新梢中的表达水平均显著低于正常新梢;同样,在碳代谢通路中,我们发现有超过三分之二的差异基因(LJ43:20/26;ZC126:20/28)在受冻新梢中的表达水平显著低于正常新梢。说明霜冻破坏新梢基础代谢,抑制了光合作用和碳代谢相关基因的表达,进而造成组织失绿坏死。细胞色素P450代谢通路中显著富集的差异基因的编码蛋白主要是谷胱甘肽硫转移酶(Glutathione S-Transferase,GST),GST催化谷胱甘肽的巯基与亲电子类物质结合,保护核酸和蛋白质免受自由基损伤,多数富集的基因在龙井43(9/16)受冻新梢中的表达水平显著高于正常新梢,而在中茶126(8/10)的冻梢中的表达水平显著低于正常新梢。同样在非酶促抗氧化过程起重要作用的抗坏血酸盐、类黄酮代谢途径相关基因在两个品种中的富集程度不同,表明倒春寒冻害发生时,两个品种受冻新梢的抗氧化机制存在一定差异。
除了共同富集的代谢通路外,龙井43受冻新梢和正常新梢差异基因显著富集的代谢通路还包括萜类骨架的生物合成和肌醇磷酸代谢等,中茶126受冻新梢和正常新梢差异基因则在色氨酸代谢、硫代谢以及乙醛酸和二羧酸代谢等通路中富集。其中萜类骨架是脱落酸和赤霉素的合成前体,可能参与激素的合成和信号响应;肌醇磷酸代谢中三磷酸肌醇是细胞内重要的第二信使,是Ca2+信号通路的上游信号因子,与脂质代谢密切相关;而色氨酸代谢、硫代谢以及乙醛酸和二羧酸代谢等通路中也包含了大量起到信号传导的次生代谢物。推测这些差异代谢通路与两个品种受到低温胁迫后产生的不同信号传导模式有关。
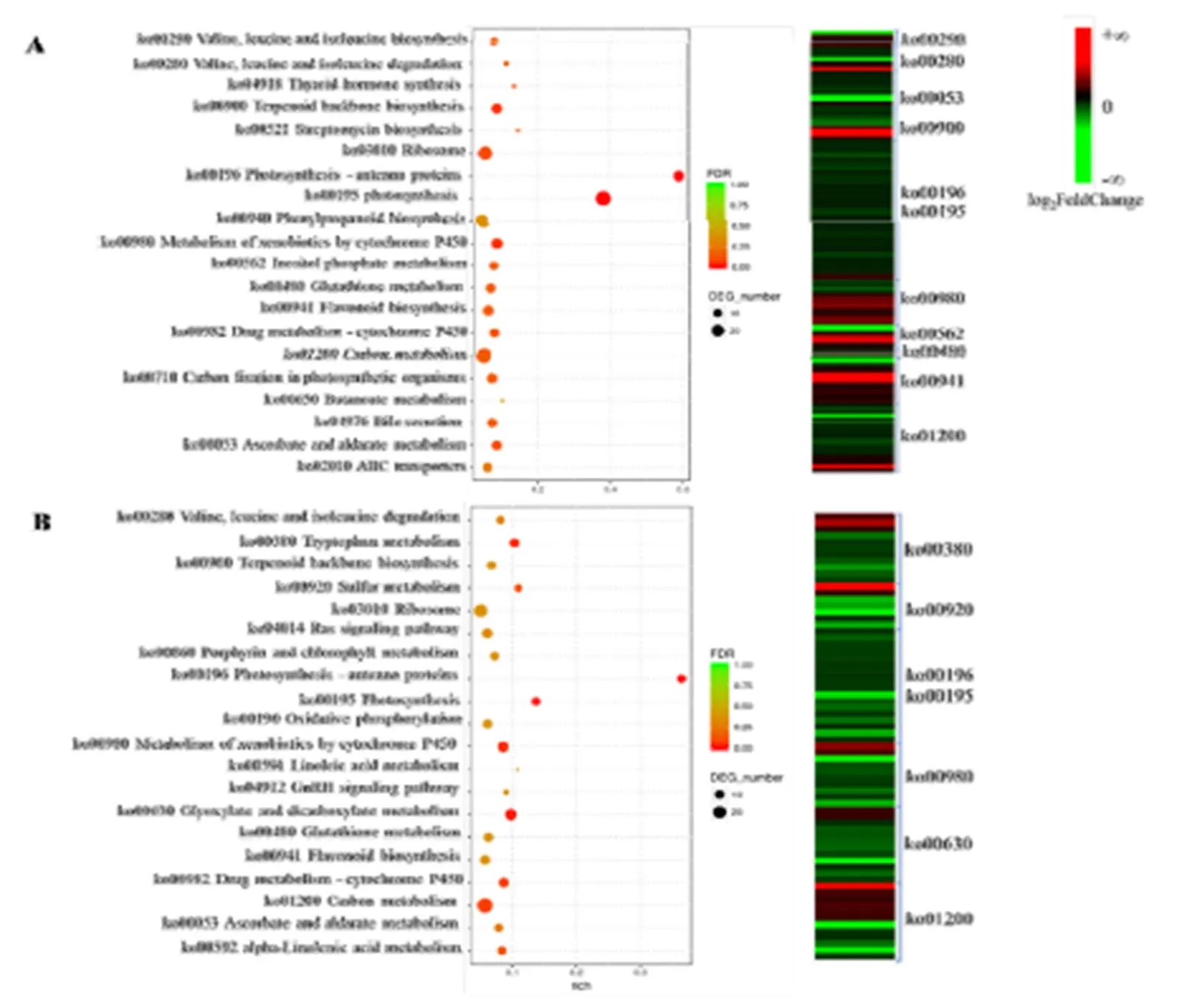
注:A:龙井43;B:中茶126 Note: A: LJ43. B: ZC126
2.5 两个品种共有差异基因的表达分析
根据差异基因在4个样本中的表达趋势,将284个共同差异基因分成3组(图5)。第I组的49个差异基因(图5-I)在两个品种受冻新梢中的表达量都显著高于正常新梢。基因注释结果显示,该组中差异基因的编码蛋白包括在细胞膜信号传导过程起关键作用的膜受体蛋白激酶,与基因转录调控相关的低温诱导的RNA结合蛋白、含CCCH结构域的锌指蛋白、CBF2(C-repeat Binding Factor 2)、乙烯响应转录因子(Ethylene Responsive Factor,ERF)等,类异戊二烯合成途径的关键酶3-羟基-3-甲基戊二酰辅酶A还原酶和异戊二烯合酶,以及参与蛋白质翻译、木质素和纤维素生物合成等生物过程相关蛋白。
第III组包含146个差异基因,它们在两个品种受冻新梢中的表达量显著低于正常新梢(图5-III)。基因注释结果表明,该组差异基因的编码蛋白主要包括叶绿体和光合作用相关蛋白,与细胞物质转运相关的ABC转运蛋白家族、水通道蛋白、肌醇转运蛋白等,参与信号传导的含RING和转运蛋白结构域的E3泛素连接酶,与激素信号传导相关的脱落酸、生长素受体蛋白,病程相关蛋白及其他生物过程相关蛋白。由此推测,膜受体蛋白激酶将外界低温信号传导至细胞内,在肌醇磷酸信号途径的介导下,诱导低温响应相关的CBF、ERF等转录因子的表达。同时冻害损伤植物细胞膜和叶绿体等低温敏感细胞器,抑制细胞膜的物质运输,推测在受冻害的新梢组织中,基于细胞膜完整性的低温响应信号通路被切断,茎尖生长受抑制,导致其无法抵抗倒春寒的冻害。
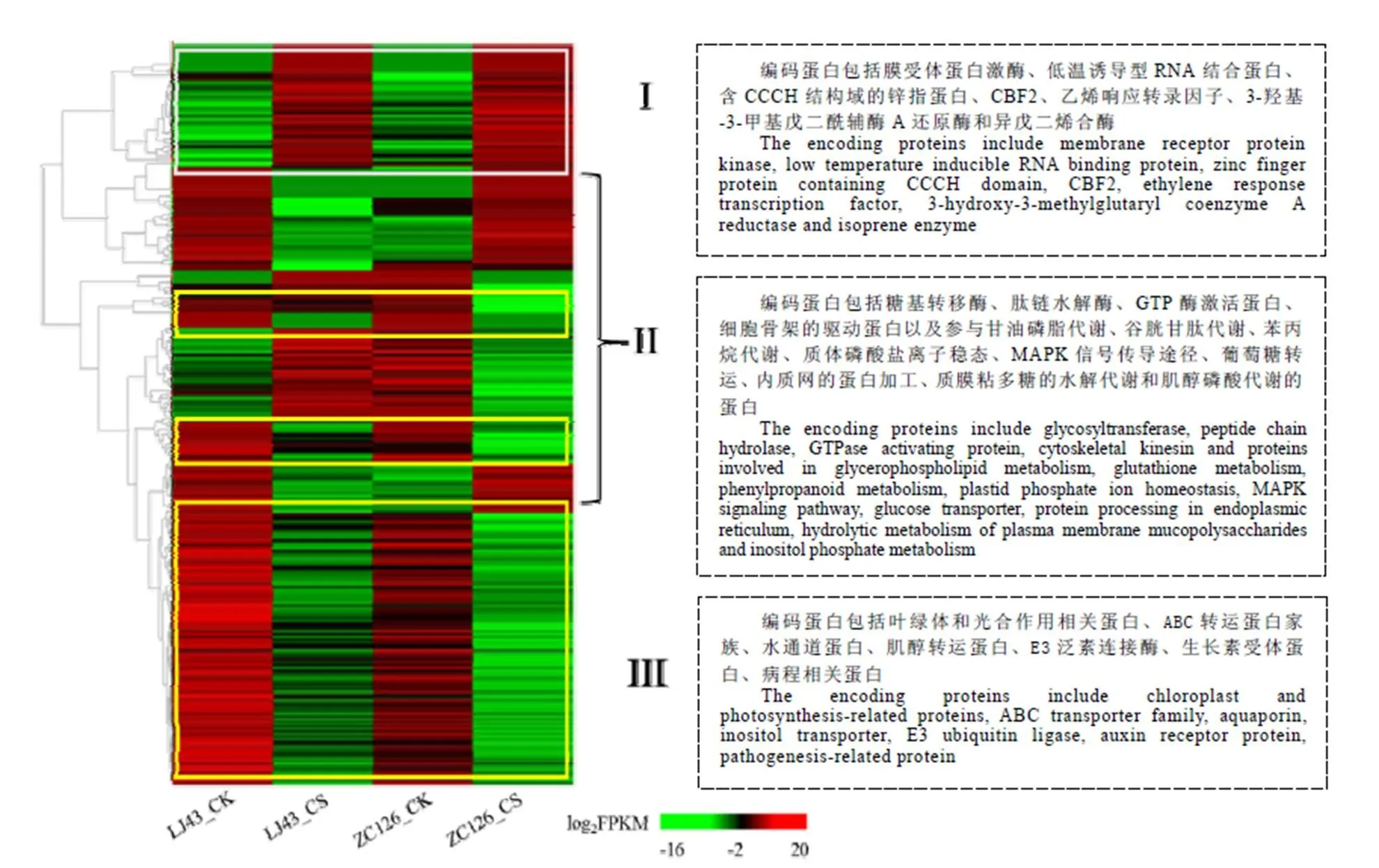
注:第I组基因(白框内)在两个品种受冻新梢中的表达水平均显著高于正常新梢;第II组(无框)基因在两个品种中的表达模式相反;第III组基因(黄框内)在两个品种受冻新梢中的表达水平均显著低于正常新梢
与I组和III组中基因的表达模式不同,第II组中的99个差异基因(图5-II)在两个茶树品种受冻新梢和正常新梢中的表达模式相反,其中在龙井43受冻新梢中高表达,而在中茶126受冻新梢中低表达的差异基因有44个,涉及的功能和代谢途径主要有糖基转移酶、肽链水解酶、甘油磷脂代谢、谷胱甘肽代谢、苯丙烷代谢、质体磷酸盐离子稳态以及MAPK信号传导途径和GTP酶激活蛋白等。在龙井43受冻新梢中低表达,而在中茶126受冻新梢中高表达的差异基因有55个,涉及的功能和代谢途径主要有葡萄糖转运、内质网的蛋白加工、质膜粘多糖的水解代谢和肌醇磷酸代谢、细胞骨架的驱动蛋白组分等。
2.6 实时荧光定量PCR分析
为验证转录组测序结果的可靠性,从转录组数据鉴定到的差异基因中选取了18个可能参与低温响应过程的基因进行实时荧光定量PCR分析。其中、、、、、基因分别编码定位于叶绿体的光吸收蛋白复合体、光系统II亚基、光保护蛋白、原叶绿素酸酯还原酶、ATP合酶γ亚基、叶绿素a/b结合蛋白;、、、基因编码ICE-CBF低温响应途径的关键转录因子;、基因编码细胞膜上重要受体蛋白激酶;基因编码几丁质诱导受体激酶1;基因编码MFC转运蛋白超家族的肌醇转运蛋白;基因编码类异戊二烯合成途径的关键酶;基因编码生长素受体蛋白;基因编码花色素3-O-葡萄糖苷2--木糖基转移酶;基因编码热激蛋白。采用相对定量方法,对这些基因在龙井43和中茶126受冻新梢和正常新梢中的表达差异进行检测。将RT-qPCR得到的基因表达趋势与转录组测序结果进行比较,结果显示,除了有两个基因表达趋势相反外,其他基因的表达趋势基本是一致的(图6),说明转录组数据是可靠的。
3 讨论
低温冻害对植物幼嫩组织的直接危害是损伤细胞生物膜、细胞器,抑制新梢基础代谢和生长发育活动,严重冻害则直接导致幼嫩组织彻底坏死。植物叶绿体对低温极为敏感[17-18],短暂低温处理就会破坏光系统中光能吸收、转运和消耗的动态平衡[19],过剩的光能会对光反应中心造成不可逆失活,并积累氧自由基,进一步损伤叶绿体内部膜组织和其他细胞器,抑制叶绿体色素代谢、光合作用等生物过程。因此,植物受冻害损伤时往往伴随着芽叶的枯焦褐化。本试验在转录水平上鉴定到大量与叶绿体和光合作用相关的差异基因,它们在龙井43和中茶126的受冻新梢中均呈现下调的表达趋势,其中包括编码光反应中心亚基的、等[20],表明冻害造成的组织损伤抑制了叶绿体中相关基因的表达。此外,有研究表明低温可以诱导叶绿体依赖型氨基酸合成途径相关基因的表达[21],本研究也发现叶绿体中支链氨基酸(Ala,Leu,Ile)和其他游离氨基酸相关基因在受冻新梢中的表达量显著高于正常新梢(4~256倍)。而且核编码叶绿体基因的转录受光合作用电子传递和质体信号传导的影响[22-23],因此,我们推测冻害造成的叶绿体结构损伤一方面改变了叶绿体的氧化还原状态、离子转运、信号传导等,通过叶绿体和细胞核的相互作用,影响核编码叶绿体基因的转录;另一方面不完整的叶绿体结构直接抑制了叶绿体基因的转录。另外,低温胁迫下产生的自由基会促使机体启动较强的氧自由基清除反应,以增强植物的抗冻能力[24]。本研究发现,龙井43和中茶126新梢可能启动不同程度的抗氧化反应,具体表现为谷胱甘肽硫转移酶、抗坏血酸代谢途径、类黄酮代谢途径等相关蛋白编码基因在两个品种受冻新梢和正常新梢中的表达差异。
低温信号也会启动植物体内的一系列应答反应,其中转录水平上研究得最为深入的是ICE-CBF(Inducer of CBF Expression-C-Repeat Binding Factor)低温响应信号通路,该信号通路在植物低温响应和冷驯化中起关键作用,是植物中普遍存在的保守机制[25-26]。本研究鉴定到基因在龙井43和中茶126受冻新梢中的表达均高于正常新梢(2.5~11.3倍)。除此之外,热激蛋白、与病程相关蛋白等在许多研究中被证实在低温诱导下大量合成,并直接或间接发挥增强植物抗冻性的作用[27-29],本研究鉴定到的内源几丁质酶、几丁质诱导受体激酶、植物甜蛋白、抗病蛋白等病程相关蛋白以及HSP90等热激蛋白编码基因在两个品种中呈现出不同的表达模式。此外,植物激素信号也常与细胞内其他信号途径相耦联,参与植物的低温响应过程,如脱落酸、赤霉素和水杨酸等激素信号都对CBF转录因子的表达起重要调控作用[30-32]。脱落酸和赤霉素分别属于倍半萜类和二萜类化合物,本研究也鉴定到多个萜类骨架相关代谢通路的差异基因,如萜类骨架的关键酶编码基因和基因分别在两个品种受冻新梢中呈现上调(2.8倍)和下调(80%)的表达趋势,生长素受体蛋白基因则被检测到在两个品种受冻新梢中的表达低于正常新梢。这些结果表明植物通过一系列信号传导将外界低温信号传入细胞核,从而诱导相关基因启动防御机制,但不同品种的信号传导过程却并不一致,其相关机制还有待进一步的研究。
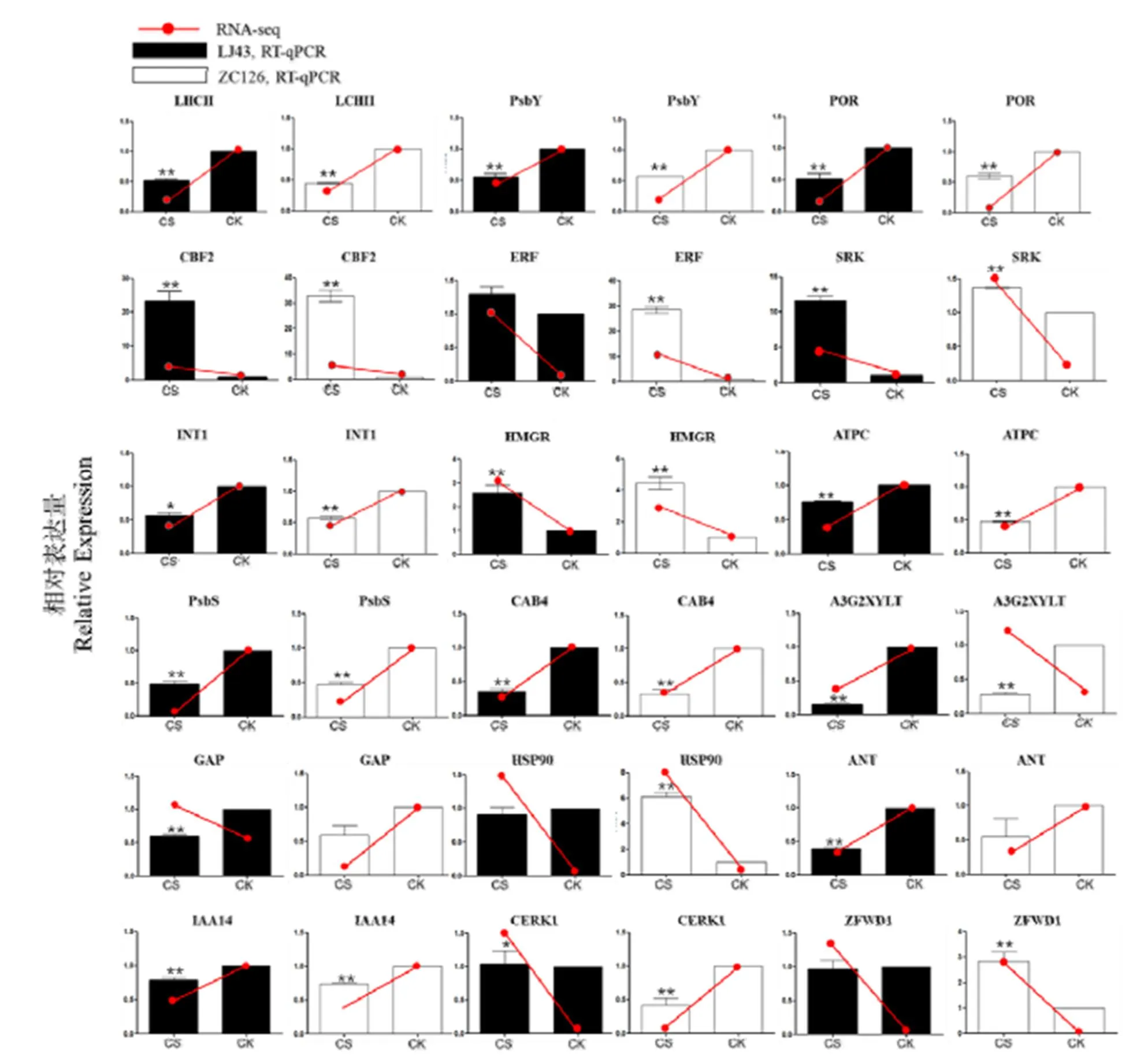
注:黑色条和白色条分别表示基因在龙井43和中茶126受冻新梢(CS)和正常新梢(CK)的相对表达水平,红色趋势线条表示转录组测序得到的该基因在两个品种受冻新梢和正常新梢的表达趋势。“*”代表基因在CS和CK之间的表达差异显著性,*:<0.05,**:<0.01
Note: The black and white bars represent the relative expression of the genes in the frozen shoots (CS) of LJ43 and ZC126, respectively. The red line indicates the expression pattern of the genes in CS and CK obtained from RNA-seq. ‘*’ refers to the significance of difference between CS and CK in each group. *:<0.05, **:<0.01
基因名称及其编码蛋白如下:The genes name and its encoded proteins are as follows.: light-harvesting complex II.: photosystem II core complex proteins.: protochlorophyllide reductase.: AP2 domain CBF protein.: ethylene-responsive transcription factor.: G-type lectin S-receptor-like serine/threonine-protein kinase.: inositol transporter 1.: hydroxymethylglutaryl-CoA reductase (NADPH).: ATP synthase gamma chain.: photosystem II 22 kDa protein.: chlorophyll a/b binding protein 4.: anthocyanidin 3--glucoside 2--glucosyltransferase.: Rho GTPase activating protein 1.: heat shock protein 90kDa.: AP2 domain-containing transcription factor.:indole-3-acetic acid inducible 14.:chitin elicitor receptor kinase 1.: zinc finger CCCH domain-containing protein
图6 实时荧光定量PCR验证
Fig.6 The validation of Real-time quantitative PCR
春季茶树新萌发的新梢细胞壁薄、含水量高、渗透调节能力弱;由于生长代谢旺盛,其具有较强的光合作用和呼吸作用,此时外界短时的霜冻天气极易导致细胞内部组织结构损伤、代谢紊乱,造成新梢的褐化和死亡。本研究以两个茶树品种的倒春寒受冻新梢为研究材料,以相同条件下正常新梢为对照,分别鉴定到1 012个和1 079个差异基因,以及284个共同差异基因。通过GO和KEGG富集分析、基因功能注释,鉴定到大量与新梢基础代谢、低温响应相关的蛋白和代谢通路。发现不同茶树品种对“倒春寒”的响应机制存在差异,相关研究结果可为茶树响应“倒春寒”机制的阐明提供一定的参考。
[1] Wang L, Li X, Zhao Q, et al. Identification of genes induced in response to low-temperature treatment in tea leaves [J]. Plant Molecular Biology Reporter, 2009, 27(3): 257-265.
[2] Wang Y, Jiang C J, Li Y Y, et al. CsICE1 and CsCBF1: two transcription factors involved in cold responses in[J]. Plant Cell Reports, 2012, 31: 27-34.
[3] Zhu X J, Li Q, Hu J, et al. Molecular cloning and characterization of spermine synthesis gene associated with cold tolerance in tea plant () [J]. Applied Biochemistry and Biotechnology, 2015, 177(5): 1055-1068.
[4] Cao H, Wang L, Yue C, et al. Isolation and expression analysis of 18genes implicated in abiotic stress responses in the tea plant () [J]. Plant Physiology and Biochemistry, 2015, 97: 432-442.
[5] 房婉萍, 邹中伟, 侯喜林, 等. 茶树冷胁迫诱导基因的克隆与序列分析[J]. 西北植物学报, 2009, 29(8): 1514-1519.
[6] Wang W D, Wang Y H, Du Y L, et al. Overexpression ofH1 histone gene confers abiotic stress tolerance in transgenic tobacco [J]. Plant Cell Reports, 2012, 33(11): 1829-1841.
[7] Wang Y X, Liu Z W, Wu Z J, et al. Transcriptome-wide identification and expression analysis of thegene family in tea plant [(L.) O. Kuntze] [J]. PLoS One, 2016, 11(11): 1-26.
[8] Yue C, Cao H, Wang L, et al. Molecular cloning and expression analysis of tea plant aquaporin () gene family [J]. Plant Physiology and Biochemistry, 2014, 83: 65-76.
[9] Wang X C, Zhao Q Y, W, Ma C L, et al. Global transcriptome profiles ofduring cold acclimation [J]. BMC Genomics, 2013, 14(1): 415. https://doi.org/10.1186/ 1471-2164-14-415.
[10] Yue C, Cao H L, Wang L, et al. Effects of cold acclimation on sugar metabolism and sugar-related gene expression in tea plant during the winter season [J]. Plant Molecular Biology, 2015, 88(6): 591-608.
[11] 黄玉婷, 钱文俊, 王玉春, 等. 茶树钙调素基因的克隆及其低温胁迫下的表达分析[J]. 植物遗传资源学报, 2016, 17(5): 906-913.
[12] 郝心愿, 岳川, 唐湖, 等. 茶树β-淀粉酶基因的克隆及其响应低温的表达模式[J]. 作物学报, 2017, 43(10): 1417-1425.
[13] 韩文炎, 李鑫, 颜鹏, 等. 茶园“倒春寒”防控技术[J]. 中国茶叶, 2018, 40(2): 9-12.
[14] Hao X Y, Tang H, Wang B, et al. Integrative transcriptional and metabolic analyses provide insights into cold spell response mechanisms in young shoots of the tea plant [J]. Tree Physiology, 2018, 38(11): 1655-1671.
[15] Hao X Y, Wang B, Wang L, et al. Comprehensive transcriptome analysis reveals common and specific genes and pathways involved in cold acclimation and cold stress in tea plant leaves [J]. Scientia Horticulturae, 2018, 240: 354-368.
[16] Wei C L, Yang H, Wang S B, et al. Draft genome sequence ofvar.provides insights into the evolution of the tea genome and tea quality [J]. Proceedings of the National Academy of Sciences, 2018, 115(18): e4151-e4158.
[17] 李庆会, 徐辉, 周琳, 等. 低温胁迫对2个茶树品种叶片叶绿素荧光特性的影响[J]. 植物资源与环境学报, 2015, 24(2): 26-31.
[18] 林郑和, 钟秋生, 游小妹, 等. 低温对不同基因型‘白鸡冠’F1代叶绿素荧光的影响[J]. 茶叶学报, 2018, 59(2): 57-66.
[19] Oquist G, Huner N P. Photosynthesis of overwintering evergreen plants [J]. Annual Review of Plant Biology, 2003, 54(1): 329-355.
[20] Janmohammadi M, Zolla L, Rinalducci S. Low temperature tolerance in plants: changes at the protein level [J]. Phytochemistry, 2015, 117: 76-89.
[21] Janská A, Maršík P, Zelenková S, et al. Cold stress and acclimation-what is important for metabolic adjustment [J]. Plant Biology. 2010, 12(3): 395-405.
[22] Oswald O, Martin T, Dominy PJ, et al. Plastid redox state and sugars: Interactive regulators of nuclear- encoded photosynthetic gene expression [J]. Proceedings of the National Academy of Sciences, 2001, 98(4): 2047-2052.
[23] Ensminger I, Busch F, Huner NPA. Photostasis and cold acclimation: sensing low temperature through photosynthesis [J]. Physiologia Plantarum, 2006, 126(1): 28-44.
[24] Xu J, Li Y, Sun J, et al. Comparative physiological and proteomic response to abrupt low temperature stress between two winter wheat cultivars differing in low temperature tolerance [J]. Plant Biology, 2013, 15(2): 292-303.
[25] Michael F T. Plant cold acclimation: freezing tolerance genes and regulatory mechanisms [J]. Annual Review of Plant Physiology, 1999, 50(1): 571-599.
[26] Miura K, Furumoto T. Cold signaling and cold response in plants [J]. International Journal of Molecular Sciences, 2013, 14(3): 5312-5337.
[27] Agarwal P, Agarwal PK. Pathogenesis related-10 proteins are small, structurally similar but with diverse role in stress signaling [J]. Molecular Biology Reports, 2014, 41(2): 599-611.
[28] Seo P J, Kim M J, Park J Y, et al. Cold activation of a plasma membrane-tethered NAC transcription factor induces a pathogen resistance response in Arabidopsis [J]. Plant Journal, 2010, 61(4): 661-671.
[29] Xu J, Xue C, Xue D, et al. Overexpression of GmHsp90s, a heat shock protein 90 (Hsp90) gene family cloning from Soybean, decrease damage of abiotic stresses in[J]. PLoS One, 2013, 8(7): e69810. https://doi.org/ 10.1371/journal.pone.0069810.
[30] Niu S H, Gao Q, Li Z X, et al. The role of gibberellin in the CBF1-mediated stress-response pathway [J]. Plant Molecular Biology Reporter, 2014, 32(4): 852-863.
[31] Lee H G, Seo P J. The MYB96-HHP module integrates cold and abscisic acid signaling to activate the CBF-COR pathway in Arabidopsis [J]. Plant Journal, 2015, 82(6): 962-977.
[32] Xue X X, Shao H B, Yuan Y M, et al. Biotechnological implications from abscisic acid (ABA) roles in cold stress and leaf senescence as an important signal for improving plant sustainable survival under abiotic-stressed conditions [J]. Critical Reviews in Biotechnology, 2010, 30(3): 222-230.
The Transcriptome Analysis of Different Tea Cultivars in Response to the Spring Cold Spells
WANG Junya1,2, CHEN Wei1,2, LIU Dingding1,2, CHEN Liang1, YAO Mingzhe1, MA Chunlei1,2*
1. Tea Research Institute of the Chinese Academy of Agricultural Sciences, National Center for Tea Improvement, Key Laboratory of Tea Biology and Resource Utilization, Ministry of Agriculture, Hangzhou 310008, China; 2. Graduate School of Chinese Academy of Agriculture Science, Beijing 100081, China
In order to explore the effect of freezing damage caused by spring cold spells on the transcription profiling of young shoots of different tea cultivars, transcriptome analysis of the frozen and unfrozen shoots was performed on tea cultivar‘Longjing 43’ and ‘Zhongcha 126’ during the cold spells. A total of 1 012 and 1 079 differentially expressed genes (DEGs) were identified in two cultivars with 284 DEGs overlapped. Then, eighteen DEGs were selected for Real-time quantitative PCR verification. The results were consistent with the transcriptome sequencing results, indicating that the transcriptome data was reliable. Utilizing the GO and KEGG pathway databases, the enriched pathways of the DEGs were identified, which included photosynthesis, carbon metabolism and cytochrome P450. This indicates that the cold spells cause serious damage to the basal metabolism related to the normal growth and development of young tea shoots and inhibit the expression of related genes. Subsequently, the expression cluster analysis of 284 overlapped DEGs showed that 99 DEGs exhibited the opposite expression patterns in two cultivars. The involved biological processes included MAPK signaling pathway, glutathione and phenylpropanoid metabolism. It was speculated that these DEGs were related to different signal transduction patterns in ‘Longjing 43’ and ‘Zhongcha 126’ in response to low temperature stress.
tea plant, cold spells, transcriptome, differentially expressed genes
S571.1;Q52
A
1000-369X(2019)02-181-12
2019-01-07
2019-02-12
中国农业科学院科技创新工程(CAAS-ASTIP-TRICAAS)、国家茶叶产业技术体系(CARS-19)、国家自然科学基金(31100504、31170624)、浙江省公益技术研究农业项目(2016C32024)、浙江省农业(茶树)新品种选育重大科技专项子课题(2016C02053-5)、中国农业科学院茶叶研究所基本科研业务费(1610212017008、1610212016002)
王君雅,女,硕士研究生,主要从事茶树资源育种与遗传改良研究,wjy_8995@163.com。
malei220@tricaas.com

