血清游离miRNA-132及miRNA-301a水平与妊娠期糖尿病相关性研究
明 艳 张祖艳 胡 莉 夏小文 柯晓琼
湖北省阳新县妇幼保健院妇产科,湖北阳新 435200
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠期发生或首次发现的糖耐量异常,但不排除糖类不耐受在妊娠前已存在的疾病,是妊娠期常见并发症,严重危害母婴健康。近年来,关于GDM的发病机制研究虽已取得较大进展,但仍未完全明确,其中胰岛素抵抗(insulin resistance,IR)是GDM的重要病理机制[1-2]。此外,诸多观点认为炎症和免疫异常是胰岛素抵抗的重要病因,GDM患者血清及胎盘组织白细胞介素1/6(IL-1/6)、肿瘤坏死因子α(TNF-α)、C反应蛋白(CRP)及人白细胞抗原DRB1基因(HLA-DRB1)表达异常[3-6]。微小RNA(micro RNA,miRNA)是一类长度19~24 nt的非编码单链RNA分子,广泛参与多种良、恶性疾病的发生、发展。近年来,相关研究证实多种miRNA参与2型糖尿病和GDM的发生和进展[7-8]。同时,有研究表明,miRNA-132及miRNA-301a作为促炎性调节因子广泛参与炎症、免疫等多种病理生理学进程[9-11],但尚未见其与GDM相关研究。因此,本研究通过分析GDM和正常孕妇血清游离miRNA-132及miRNA-301a的表达差异,分析其与IR的可能关系,探讨miRNA-132及miRNA-301a参与GDM病生理过程及其作为GDM预测和治疗靶标的可能。
1 资料与方法
1.1 一般资料
选取于2017年3月~2018年2月在我院产检并分娩的GDM孕妇30例,作为观察组(GDM组),随机选取同期于我院产检并分娩且无妊娠合并症的正常孕妇30例为对照组。GDM组纳入标准为符合2013年世界卫生组织GDM诊断标准[11]。排除标准:合并免疫系统性疾病、传染性疾病、慢性肝肾功能损伤性疾病、心脏病、孕前有糖尿病史或有糖尿病家族史、既往有高血压或高血脂等代谢性疾病。本研究通过医院医学伦理委员会批准,患者及家属均签署知情同意书。
1.2 方法
1.2.1 实验室检查 受试者于孕24~28周时清晨且空腹8h后抽取肘静脉血,采用全自动电化学发光分析仪(Cobase41)检测血糖相关实验室指标,包括:空腹血糖(FPG)及空腹胰岛素(FINS),检测试剂盒购自德国罗氏公司;采用酶联免疫吸附试验检测血清炎症因子水平,包括:IL-1,IL-6,IL-10,TNF-α及CRP水平,试剂盒购自杭州碧云天公司,酶标仪购自美国RD公司(Phomo型)。胰岛功能采用HOMA模型胰岛素抵抗指数(homeostatic model assessment insulin resistant,HOMA-IR)进行评价,HOMA-IR=FPG×FINS/22.5,剩余血清冻存于-80℃用于miRNA-132及miRNA-301a检测。
1.2.2 血清游离RNA提取 采用Trizol 试剂盒(日本Takara公司)提取总RNA,所有步骤均按试剂盒说明操作:加入Trizol充分混匀后静置,采用苯酚/氯仿去蛋白处理,乙醇沉淀并清洗RNA后加入焦碳酸二乙酯(DEPC)水溶解RNA,利用紫外-可见分光光度计进行纯度检测。
1.2.3 血清游离miRNA检测 取2μg总RNA为模板,采用逆转录试剂盒(日本Takara公司)将RNA逆转录为cDNA,并采用TaqMan miRNA检测试剂盒(日本Takara公司)进行q-PCR,每个检测样本设3个复孔,以U6位内参照。PCR引物均由上海生工生物公司合成,miRNA-132:5'-CCAGCATAACAGTCTACAGCCA-3',5'-TATGGTTGTTCACGACTCCTTCAC-3';miRNA-301a:5′-ACACTCCAGCTGGGCAGTGCAATAGTA TTGTC-3′,5′ -CTCAACTGGTGTCGTGGA-3′ ;U6:5 ′ -GCT-TCG-GCA-GCA-CAT-ATA-CTAAAA-T--3′,5′ -CGC-TTC-ACG-AAT-TTGCGT-GTC-AT-3′。miRNA表达量以2-ΔCt表示,其中ΔCt=CtmiRNA-CtU6。
1.3 观察指标
对比分析两组研究对象年龄,BMI,胰岛素抵抗相关实验室指标FPG和FINS,血清炎症相关因子以及血清游离miRNA-132及miRNA-301a水平,并采用HOMA-IR计算胰岛素抵抗指数。其中FPG和FINS是评判GDM的直接指标,将FPG和FINS数值采用HOMA模型计算可以得到间接反映胰岛素抵抗指数HOMA-IR,其值越大说明胰岛素抵抗越严重。血清炎症因子包括促炎症因子IL-1、IL-6、TNF-α、CRP以及抗炎因子IL-10。
1.4 统计学处理
采用SPSS19.0统计学软件进行数据分析,计量资料以(±s)表示,采用t检验。采用单直线相关性分析方法分析与血清miRNA-301a及miRNA-132水平相关的因素,r值为正数表示成正相关关系,r值为负数表示成负相关关系。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料及实验室指标比较
两组研究对象之间年龄比较差异无统计学意义(P>0.05);GDM组孕妇BMI及HOMA-IR指数均高于对照组,差异有统计学意义(P<0.05);此外,GDM 组孕妇血清中 FPG、FINS、IL-1、IL-6、TNF-α及CRP水平均明显高于对照组,差异有统计学意义(P<0.05),而血清IL-10水平低于对照组孕妇,差异有统计学意义(P<0.05),见表l。
表1 两组对象一般资料及实验室指标比较(±s)
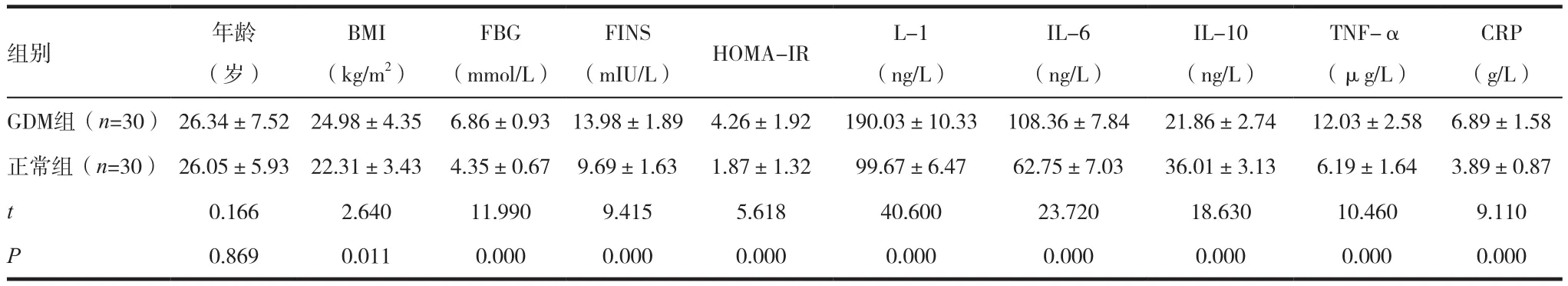
表1 两组对象一般资料及实验室指标比较(±s)
注:BMI:体质指数;FPG:空腹血糖;FINS:空腹胰岛素;HOMA-IR:胰岛素抵抗指数;IL-1:白介素1;IL-6:白介素6;IL-10:白介素10;TNF-α:肿瘤坏死因子α;CRP:C型反应蛋白
组别 年龄(岁)CRP(g/L)GDM组(n=30) 26.34±7.52 24.98±4.35 6.86±0.93 13.98±1.89 4.26±1.92 190.03±10.33 108.36±7.84 21.86±2.74 12.03±2.58 6.89±1.58正常组(n=30) 26.05±5.93 22.31±3.43 4.35±0.67 9.69±1.63 1.87±1.32 99.67±6.47 62.75±7.03 36.01±3.13 6.19±1.64 3.89±0.87 t 0.166 2.640 11.990 9.415 5.618 40.600 23.720 18.630 10.460 9.110 P 0.869 0.011 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000 BMI(kg/m2)FBG(mmol/L) (mIU/L) HOMA-IR L-1(ng/L)FINS IL-6(ng/L)IL-10(ng/L)TNF-α(μg/L)
2.2 两组产妇血清游离miRNA-132及-301a表达水平比较
GDM组孕妇的血清游离miRNA-301a表达水平明显高于正常对照组,差异有统计学意义(P<0.05),而miRNA-132水平虽稍高于正常对照组,但差异无统计学意义(P>0.05)。见表2。
表2 两组产妇血清游离miRNA-132及miRNA-301a表达水平(±s)
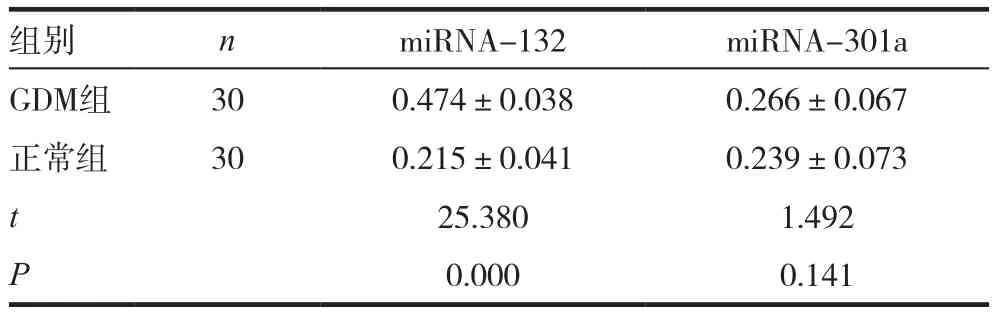
表2 两组产妇血清游离miRNA-132及miRNA-301a表达水平(±s)
组别 n miRNA-132 miRNA-301a GDM组 30 0.474±0.038 0.266±0.067正常组 30 0.215±0.041 0.239±0.073 t 25.380 1.492 P 0.000 0.141
2.3 miRNA-132及miRNA-301a表达相关因素分析
采用单直线相关分析方法分析各观察项目与血清游离miRNA-132及-301a表达水平的相关性,结果表明,血清miRNA-301a水平与年龄、BMI无明显相关性(P>0.05),而与血清FBG、FINS、IL-1、IL-6、TNF-α 及 CRP水平和 HOMA-IR 指数 呈 正 相 关(r=0.2614、0.3538、0.5025、0.3017、0.1947、0.1435、0.5439,均 P < 0.05),与血清 IL-10水平呈负相关(r=-0.1856,P<0.05);而血清游离miRNA-132水平与观察项目均无明显相关性(P> 0.05)。见表3。
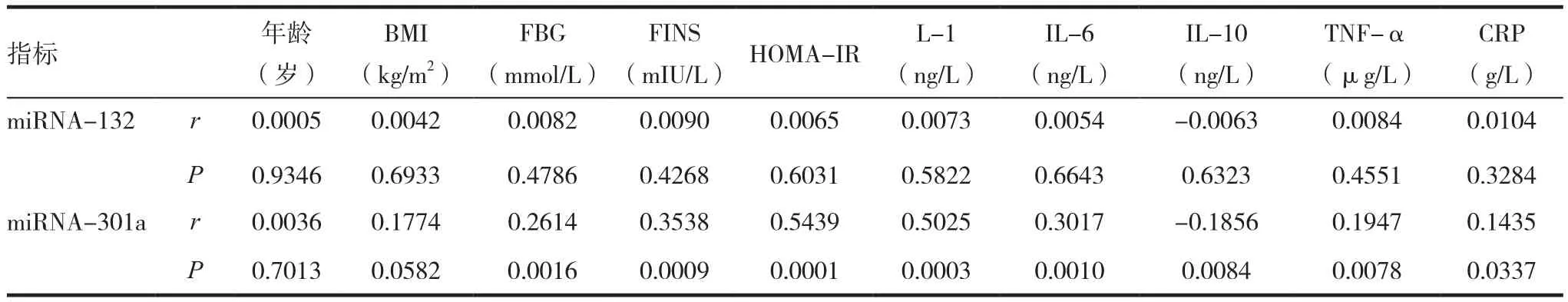
表3 各项目与血清游离miRNA-132及miRNA-301a水平的相关性分析
3 讨论
炎症与妊娠期糖尿病(GDM)的发展密切相关,炎症失调的证据(即促炎和抗炎介质失衡)最早可以在妊娠早期被发现,而后进展为GDM。GDM患者体内促炎和抗炎介质失衡多由自身免疫失调所引起,也是GDM胰岛素抵抗的重要病理机制之一[3]。随着基因检测技术的推广,近年来miRNA在GDM发病中的作用和机制研究逐渐成为GDM研究的热点之一。本研究通过分析GDM和正常孕妇血清游离miRNA-132及miRNA-301a的表达差异,分析其与IR和炎症因子失衡的可能关系,探讨miRNA-132及miRNA-301a水平与GDM之间的可能关系。
在正常妊娠期间,T辅助细胞的平衡从促炎性Th1(其中细胞产生的促炎因子IL-1、IL-2、IL-6、干扰素γ、TNF和CRP等)转变为抗炎性Th2(其中抗炎因子IL-10、IL-4、IL-5和IL-13等占主导地位),它们在母体各器官机能稳定及母胎关系中具有保护作用[3,12]。当体内自身免疫紊乱时,通过导致保护性抗炎因子水平低于促炎因子水平从而导致促炎和抗炎介质失衡,从而引发胰岛β细胞功能紊乱,最终导致胰岛素抵抗。而本研究中也证实GDM组孕妇血清促炎因子水平明显高于正常组,而抗炎因子则明显低于正常对照组,这也与其他相关研究结果一致。
近年来,有学者证实miRNA-132及-301a的表达升高与机体炎症及免疫反应存在联系[9-10],miRNA-132及miRNA-301a升高可引起促炎因子IL-1β、IL-6、IL-8、TNF-α及COX2等水平升高,引起机体抗炎-促炎介质失衡,导致相关器官结构和功能损害,而其作用可能通过NF-κB或STAT3信号通路实现[9,13],且这些通路都与GDM的发生、发展密切相关[14-17]。而抑制miRNA-132及miRNA-301a的表达可明显缓解机体炎症紊乱状态[9,12]。 此 外,miRNA-132 及 miRNA-301a还 与机体免疫调节相关[18-19]。而在本研究中,GDM组孕妇miRNA-301a水平明显增高,同时伴有促炎因子水平升高及抗炎因子水平降低,且血清游离miRNA-301a水平与促炎因子水平及胰岛素抵抗指数呈正相关,而与抗炎因子水平呈负相关,因此我们推测,miRNA301a水平增加引起促炎症因子水平上升,使T辅助细胞的平衡从促炎性Th1向抗炎性Th2转换受阻,导致胰岛β细胞功能损害而发生胰岛素抵抗。此外,miRNA-132主要通过抑制沉默信息调节因子1(silent information regulation 2 homolog 1,SIRT1)发挥促炎作用[20],而GDM患者血清SIRT1水平较正常者升高,且SIRT1对GDM的发生发展具有双重调节作用[21-24],这可能是GDM患者血清miRNA132水平与正常对照组无统计学差异的可能原因,仍有待相关机制研究进行证实。
综上所述,GDM患者机体抗炎-促炎介质失衡,血清游离miRNA-301a水平与GDM发病密切相关,其可能通过引起机体炎症调节紊乱从而导致胰岛素抵抗发生,可作为GDM重要的预测指标和治疗靶点,而血清miRNA132水平与GDM无明显相关性。本研究不足之处在于样本量较小,且只检测了血清游离miRNA水平,因此,本研究实验结论及其具体机制仍有待进一步的大样本及深层次的研究予以证实。

