miR-181a靶向作用CARF基因抑制胰腺癌细胞凋亡
李军建,陈钢,朱千东,余正平
(温州医科大学附属第一医院 肝胆外科,浙江 温州 325015)
胰腺癌的恶性程度高,现有治疗手段未能有突破性进展[1-3]。研究发现,微小RNA(miRNA)在肿瘤的发生发展中发挥重要作用,如白血病、乳腺癌、肝癌、胃癌等领域相继发现相关异常表达的miRNA及其靶基因[4-6]。有研究表明,一些miRNA在胰腺癌中同样存在异常表达[7],但目前为止尚未明确发现其相应的靶基因以及如何影响胰腺癌的发生发展。miR-181a是人类细胞中存在较为广泛的一类miRNA,对维持胸腺细胞分化状态发挥着关键作用[8-9]。胰腺癌miRNA表达谱研究显示,miR-181a在胰腺癌组织中呈现显著高表达,提示miR-181a可能参与调控胰腺癌细胞的增殖凋亡[10]。miRNA数据库靶基因预测提示ADP核糖基化辅助因子(collaborator of ADP-ribosylation factor,CARF)基因是miR-181a可能的作用靶点,该基因可通过多条途径发挥上调p53的作用,而p53通路是胰腺癌发病机制的重要组成部分[11-12]。本研究观察miR-181a与CARF基因的相互作用,探讨两者之间是否存靶向关系及其在胰腺癌的发生发展中的作用。
1 材料和方法
1.1 材料 胰腺癌细胞株(Panc I)、正常胰腺细胞株(CCC-HPE-2)由浙江大学医学院肝胆胰外科重点实验室惠赠;胰腺癌及正常胰腺组织标本均取自于温州医科大学附属第一医院肝胆胰外科临床手术切除标本;双荧光素酶报告基因系统(Dual-LuciferaseReporter Assay System),包括质粒pGL-3/Control、pRL-TK,各种内切酶及连接酶,脂质体转染试剂盒等均购自美国Promega公司。细胞培养基及相关试剂:DMEM培养基、胎牛血清、RPMI1640培养基、100×青链霉素(双抗)溶液等均购自美国Gibico公司。MTT试剂盒购自美国Sigma公司。DNA纯化试剂盒和质粒抽提试剂盒购自美国Qiagen公司,PCR相关引物合成和基因测序均委托上海生工公司协助完成。miR-181a拮抗剂(miR-181a inhibitor)和激动剂(hsa-miR-181a)及空白对照(miRNA Neg-tive Control)委托上海吉玛制药技术有限公司合成。本研究经过本院伦理委员会审核批准。
1.2 方法
1.2.1 miRNA的提取及miRNA-181a的定量检测:采用mirVanaTMmiRNA Isolation Kit提取正常胰腺细胞株CCC-HPE-2和胰腺癌细胞株Panc I(各8个样本),及正常胰腺组织和胰腺癌组织(各20例)中的总RNA(富集miRNA),依照Tiangen试剂盒说明进行反转录合成cDNA。荧光实时定量PCR检测miR-181a,以U6为内参,其引物序列代号MS00007497,hsa-miR-181a引物序列代号MS00003213(均购自美国Ambion公司)。反应条件为95 ℃、30 s预变性,95 ℃、5 s,60 ℃、34 s,40个循环,95 ℃、15 s,60 ℃、1 min,95 ℃、15 s。PCR产物进行凝胶电泳,凝胶成像后做定量分析。
1.2.2 质粒转染及分组:常规培养Panc I细胞,转染前24 h将细胞接种于24孔板[(3~5)×105个细胞/孔],更换孔板中培养基为无血清培养基,当细胞汇集度约80%时开始转染,转染完成4 h后再更换成含胎牛血清的培养基,测定转染效率。分为3组:按照通过Lipofectamine 2000转染miR-181a inhibitor拮抗剂(PMI组),miRNA Negative Control阴性对照(PMNC组)和单纯质粒的空白对照(NC组)。胰腺癌组织标本为C组,正常胰腺组织为N组,CCCHPE-2细胞为CCC-HPE-2组。
1.2.3 MTT法检测细胞增殖能力:将处于对数生长期的3组细胞:NC组、PMNC组、PMI组置于37 ℃、饱和湿度、5% CO2条件下,以每孔细胞数约为5×104的量接种于相应的96孔板。常规培养24、48、72 h后,每孔分别加入20 μL 5 mg/mL MTT试剂,同样条件再孵育4 h,每孔加入100 μL DMSO,利用酶标仪测定490 nm处吸光度值,上述实验分别重复3次。
1.2.4 制备含有CARF 3’-UTR片段的pGL-3转染质粒:采用上游引物P1(5’-ATCATACGCGTTGAATAAACCA CATCAAAGGAAAGG-3’)以及下游引物P2(5’-TGTAAGAT CTTTACGGGCAACATTTTTAAAACC-3’),用PCR法从全基因组DNA中扩增完整的CARF 3’-UTR片段P2,将纯化的PCR产物与TAKARA pMD18-T vector连接。将包含CARF 3’-UTR片段的pGL-3质粒和PMD-18T载体质粒分别进行双酶切反应,然后混匀,离心后37 ℃常温环境下酶切过夜。所得酶切产物在2%琼脂糖凝胶上进行电泳(电压为5 V/cm),电泳完成后将凝胶上的目的片段切下,凝胶DNA回收。所得纯化pGL-3质粒片段(60 ng/μL)和CARF 3’-UTR片段(30 ng/μL)通过T4连接酶连接。
1.2.5 荧光素酶检测miR-181a拮抗剂和激动剂对miR-181a水平的影响:采用Trans Fast脂质体转染试剂盒将质粒转染入胰腺癌细胞Panc I,以不包含CARF 3’-UTR序列的PGL3-control质粒作为阴性对照,单纯脂质体为空白对照,具体分组情况如下:Panc I A:PGL3-control;Panc I B:PGL3-CARF 3’-UTR;Panc I C:PGL3-CARF 3’-UTR+10 nmol/L拮抗剂(miR-181a inhibitor);Panc I D:PGL3-CARF 3’-UTR+10 nmol/L激动剂(hsa-miR-181a);Panc I E:PGL3-CARF 3’-UTR+30 nmol/L激动剂(hsa-miR-181a)。
上述每种处理分别设6个重复孔,通过双荧光素酶报告基因系统,检测各组细胞的荧光素酶活性,结果以相对于内对照质粒pRL-TK的百分比表示。
1.2.6 激动剂及拮抗剂对胰腺癌细胞中miR-181a表达水平的影响:设定3个实验组:PM组细胞(转染10 nmol/L激动剂hsa-miR-181a上调miR-181a水平),PMI组细胞(转染10 nmol/L抑制剂miR-181a inhibitor下调miR-181a水平)和对照组PNC组细胞(未处理),应用实时荧光定量PCR检测转染后各实验组细胞中miR-181a的表达情况,检测方法及条件参照1.2.1。
1.2.7 Western blot检测miR-181a对CARF蛋白表达水平的影响:应用Western blot检测3组采用不同干预手段的细胞内CARF基因的蛋白表达水平:PM组、PMI和PNC组。消化收集上述各组细胞,细胞裂解液提取总蛋白,制胶后总蛋白上样50 mg,电泳跑胶(浓缩胶80 mA、20 min,分离胶120 mA、1 h),结束后取出凝胶,300 mA电转约2 h,转移蛋白至PVDF上,脱脂奶粉封闭转移膜l h后加一抗,4 ℃过夜,TBST漂洗4次,然后加二抗,室温孵育1.5 h,再次TBST洗膜4次,完成后电化学发光显影。
1.3 统计学处理方法 采用SPSS18.0统计学软件进行统计学分析。2组间比较用t检验;3组间不同时间点比较用重复测量方差分析,两两比较用S-N-K法。P<0.05为差异有统计学意义。
2 结果
2.1 胰腺癌中miR-181a的表达水平 C组中的miR-181a的表达量明显高于N组,差异有统计学意义(0.015±0.010 vs. 0.003±0.002,P<0.05)。胰腺癌Panc I细胞中的miR-181a表达水平明显高于CCCHPE-2组,差异有统计学意义(0.016±0.004 vs.0.006±0.002,P<0.05)。
2.2 Panc I细胞质粒转染效率 转染72 h后超过80%的质粒转染细胞表达绿色荧光蛋白,可见绿色荧光,转染效果较佳,见图1。
2.3 拮抗剂miR-181a inhibitor下调胰腺癌细胞的增殖水平 PMNC组各时间点间的细胞生长抑制率差异均无统计学意义(P>0.05);PMI组的Panc I细胞在24、48、72 h等3个不同的时间点生长均受到明显抑制,与PMNC组和NC组比较各时间点差异有统计学意义(P<0.05),见图2。
图1 脂质体转染Panc I细胞后显示绿色荧光(×100)
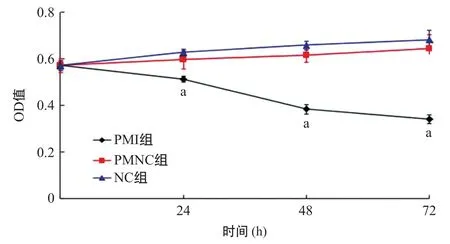
图2 转染后3组各时间点Panc I细胞生长情况比较
2.4 miR-181a对重组质粒PGL3-CARF 3’-UTR荧光素酶活性的影响 Panc I A组细胞转染空白对照质粒PGL3-control后不影响荧光素酶活性而使其正常表达。Panc I B组细胞转染PGL3-CARF3’-UTR与Panc I A组比荧光素酶活性差异无统计学意义(P>0.05)。Panc I C组细胞同时加入拮抗剂miR-181a inhibitor,细胞内miR-181a受抑制,荧光素酶活性差异无统计学意义(P>0.05)。与Panc I A组比,Panc I D加入10 nmol/L激动剂hsa-miR-181a,细胞内miR-181a水平上升,荧光素酶活性明显下降,差异有统计学意义(P<0.05);与Panc I A组比,Panc I E加入30 nmol/L激动剂hsa-miR-181a,细胞内miR-181a水平上升,荧光素酶活性明显下降,差异有统计学意义(P<0.05)。Panc I D与Panc I E 2组转染重组质粒和不同剂量的激动剂hsa-miR-181a,随着激动剂剂量的增加miR-181a也随之上升,荧光素酶活性明显下降,两者呈负相关(r=-0.92,P<0.05)。见图3。
2.5 激动剂及拮抗剂对胰腺癌细胞中miR-181a表达水平的影响 PM组细胞miR-181a表达水平较PNC组显著升高,差异有统计学意义(0.039±0.004 vs.0.015±0.004,P<0.05);而PMI组细胞miR-181a表达水平较PNC组显著降低,差异有统计学意义(0.008±0.002 vs. 0.015±0.004,P<0.05)。
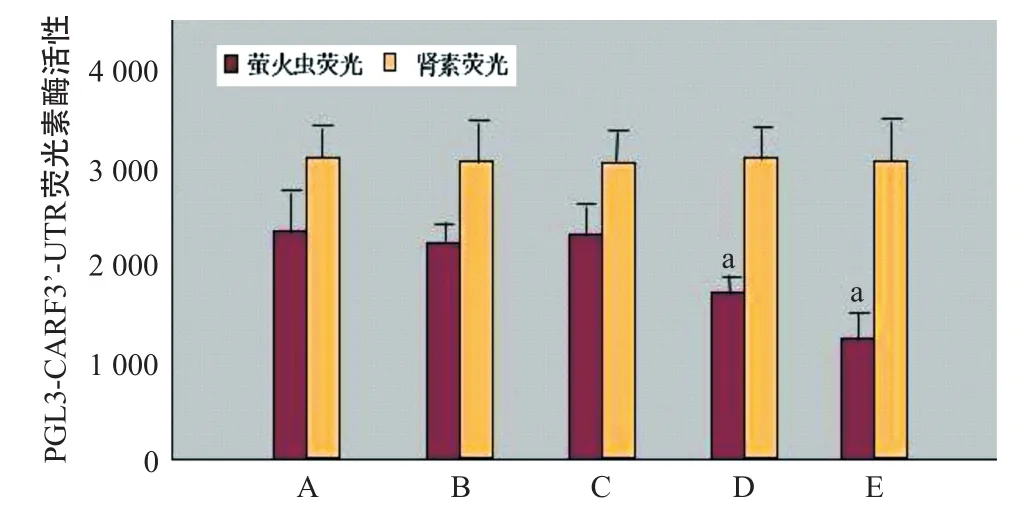
图3 miR-181a对重组质粒PGL3-CARF3’-UTR荧光素酶活性的影响
2.6 miR-181a水平对CARF蛋白表达的影响 与PNC组比,PM组CARF蛋白表达明显减少,差异有统计学意义(P<0.05);与PNC组比,PMI组CARF蛋白表达明显加强,差异有统计学意义(P<0.05),见图4。

图4 miR-181a对CARF蛋白表达水平的影响
3 讨论
本研究证实胰腺癌组织/细胞中miR-181a的表达明显高于正常胰腺组织/细胞;以往研究表明大多数miRNA通过改变肿瘤细胞的增殖凋亡情况,从而影响肿瘤的发生发展[13],结合miR-181a在胰腺癌中的高表达,采用miR-181a的拮抗剂miR-181a inhibitor转染胰腺癌细胞后,肿瘤细胞的增殖活性得到明显抑制。miR-181a inhibitor的序列与miR-181a互补,可以与细胞内成熟miR-181a序列结合,竞争靶点,从而阻断miR-181a下调其靶基因发挥相应功能。MTT结果表明转染miR-181a inhibitor后,胰腺癌细胞增殖能力显著下降,转染后24、48、72 h等3个时间点,PMI组的细胞生长抑制率与对照组相比差异均有统计学意义。
由此考虑miR-181a可能通过靶向作用于某种抑癌基因,抑制其表达,从而发挥提高胰腺癌细胞增殖能力的作用。当胰腺癌细胞中miR-181a水平下调,其相关抑癌基因得到释放并明显抑制肿瘤细胞的增殖。本研究结果证实上述猜想,miR-181a受抑制的PMI组胰腺癌细胞在不同时点其增殖能力均明显下降。组内各时间点的抑制率变化趋势提示PMI组的抑制率与作用时间呈正相关,48 h内抑制效果增加较为显著,但随后趋势有所减缓。由此推测miR-181a inhibitor的拮抗效果随时间的推移持续加强,但增速48 h后有所减缓。这一现象的出现,可能与转染的miR-181a拮抗剂浓度不够,或者胰腺癌细胞本身存在某种代偿机制,抑或miR-181a拮抗剂的转染存在一定的时效性,难以长期稳定地在细胞中发挥作用有关,有待于进一步深入探讨。
双荧光素酶报告基因系统的作用原理是:构建一个将靶启动子的特定片段插入到荧光素酶表达序列前方的报告基因质粒,将要检测的转录因子表达质粒与报告基因质粒共转染相关的细胞系,如果此转录因子能够激活靶启动子,则荧光素酶基因就会表达,荧光素酶的表达量与转录因子的作用强度成正比。加入特定的荧光素酶底物,荧光素酶与底物反应产生荧光,通过检测荧光的强度可以测定荧光素酶的活性,从而判断转录因子是否能与此靶启动子片段有作用[14]。将CARF基因3’-UTR片段克隆在荧光素酶报告基因的下游,若该片段序列内确实存在miR-181a的作用靶点,两者结合可降低荧光素酶活性,否则荧光素酶活性将不受影响。而作为内对照的海马肾荧光报告质粒pRL-TK不受上述反应的影响,始终能够稳定表达。在生物信息学靶基因预测的基础上,采用双荧光素酶报告基因技术证实CARF基因3’-UTR是否存在miR-181a的作用靶点。本研究中转染空白对照质粒PGL3-control的Panc I A组细胞不影响荧光素酶活性。Panc I B组细胞转染PGL3-CARF3’-UTR后,因Panc I胰腺癌细胞本身存在miR-181a表达,其与质粒相互作用后导致荧光素酶活性有所下降。当Panc I C组细胞加入拮抗剂miR-181a inhibitor,因细胞本身的miR-181a被抑制,荧光素酶活性明显上升;Panc I D与Panc I E两组细胞加入激动剂hsa-miR-181a,提高了胰腺癌细胞中的miR-181a水平,荧光素酶活性随之受到明显抑制。上述研究结果表明miR-181a和CARF基因确实存在靶向关系,即CARF基因3’-UTR片段中包含miR-181a的作用靶点。接着还通过研究miR-181a对CARF蛋白表达水平的调控情况,进一步证实上述靶向关系。通过转染miR-181a激动剂和拮抗剂改变胰腺癌细胞中miR-181a的水平,Western blot检测相应细胞组CARF蛋白表达水平的变化,实验结果显示细胞中miR-181a的水平与CARF蛋白表达水平呈显著负相关。
本研究在明确miR-181a在胰腺癌中存在显著高表达的基础上预测了miR-181a和CARF的靶向关系,在获得miR-181a与CARF基因相关性的初步证据的前提下,提出“miR-181a-CARF-p53-胰腺癌”调控途径的猜想,并从多个角度对该假设进行验证。随着miRNA重要性的逐步体现,通过外源性干预措施改变恶性肿瘤细胞中各种miRNA水平,影响其相关靶基因的表达情况,从而抑制肿瘤的发生发展应该被考虑作为一个比较有前景的治疗策略[15-17]。能否利用miR-181a和CARF的靶向关系寻找治疗胰腺癌的新途径,还有待于通过动物体内实验等相关研究进一步验证。

