中华圆田螺肉抗氧化肽的分离纯化及小鼠体内外活性研究
吴明泽 王 笑 胡祥昊 马青琳 李亚男 董丹华 高 鹏 代 龙
(山东中医药大学国家中医药管理局中药制剂三级实验室,山东 济南 250355)
中华圆田螺俗名田螺、香螺,属软体动物门腹足纲田螺科圆田螺属[1],广泛分布于稻田、湖泊、沼泽、河流、小溪等处,是淡水螺中较大型的食用螺[2]。田螺肉丰腴红腻,味道鲜美,营养丰富,每100 g内含蛋白质18.2 g、脂肪0.6 g,还有磷、钙、铁、VB以及丰富的VA等,是典型的高蛋白、低脂肪的天然保健食品[2]。郑汉丰等[3]研究表明,中华圆田螺肉富含人体必需的8种氨基酸,必需氨基酸占总氨基酸的比例均在35%左右,与WHO/FAO模式推荐的模式(35.38%)接近。
氧化应激是指机体内产生过多活性氧簇(ROS)自由基,超出机体清除能力,导致体内氧化系统与抗氧化系统失衡[4]。而体内氧化还原状态失衡与慢性代谢性疾病,如心脑血管疾病、糖尿病、类风湿性关节炎和癌症发生、发展等[5-6]有关。目前,中华圆田螺资源开发集中在普通食品及饲料行业,杨丽丽等[1]已发现中华圆田螺抗菌肽对人体肺腺癌细胞A549细胞的生长抑制作用,但对其他生物活性尤其是抗氧化活性的研究开发尚未见报道。
试验拟在前期研究的基础上,通过碱性蛋白酶、胰蛋白酶进行双酶酶解制备中华圆田螺肽,采用超滤、大孔树脂、葡聚糖凝胶色谱和半制备液相色谱对其进行分离纯化,以1,1-二苯基-2-苦基肼(DPPH)自由基清除率、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基清除率、铁离子还原能力(FRAP)、氧化自由基吸收能力(ORAC)为指标,进行活性追踪,制备获得活性较高的抗氧化肽,并通过小鼠体内抗氧化酶及MDA增加值的测定验证其体内抗氧化活性。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
中华圆田螺:山东省济宁市微山湖田螺养殖场;
胰蛋白酶、碱性蛋白酶:1.0×105U/g,上海源叶生物科技有限公司;
昆明种封闭群小白鼠:动物合格证号SCXK(鲁)2017-0011,雌雄各半,济南朋悦实验动物繁育有限公司;
谷胱甘肽过氧化物酶(GSH-PX)试剂盒、总超氧化物歧化酶(T-SOD)Elisa试剂盒、微量丙二醛(MDA)测定试剂盒(TBA法)、总抗氧化能力(T-AOC)测试盒、过氧化氢酶(CAT)试剂盒:武汉纯度生物科技有限公司;
偶氮二异丁脒盐酸盐(AAPH):美国Secoma公司;
荧光素钠(Fluorescein 2Na)、ABTS、DPPH:美国Sigma公司;
2,4,6-三吡啶基三嗪(TPTZ)、还原型谷胱甘肽、水溶性VE:北京Solarbio公司;
超滤管:1 000,3 000 Da,美国Millipore公司;
葡聚糖凝:Sephadex G-10型,北京Solarbio公司;
大孔树脂:DA201-C型,上海源叶生物科技有限公司。
1.1.2 仪器设备
电脑自动部分收集器:BS-110型,上海精科实业公司;
高速组织捣碎机:JJ-2型,上海谷宁实业有限公司;
膜分离设备:1812型,杭州瑞纳膜工程有限公司;
精密增力电动搅拌器:JJ-1型,江苏省金坛市宏华仪器厂;
冷冻干燥机:FD-1A-50型,北京博医康实验仪器有限公司;
半制备液相色谱系统:LC-20A型,日本岛津株式会社;
紫外—可见分光光度计:UV-1800型,日本岛津株式会社;
分析天平:XS105型,瑞士Mettler Toledo公司;
高速冷冻离心机:GL-21M型,湖南湘仪离心机仪器有限公司。
1.2 试验方法
1.2.1 田螺肉酶解液的制备 取田螺在水中滴加3滴香油养殖3 d,80 ℃水煮田螺15 min,充分洗净后,挑出田螺肉,置于冰箱冷冻保存备用。称取田螺肉1 kg,加水5 000 mL 匀浆,85 ℃加热15 min,冷却,采用胰蛋白酶、碱性蛋白酶酶解,酶解条件为pH 9、酶解温度55 ℃、每种酶的酶用量3 000 U/g,酶解时间3 h,酶解结束后,酶解液在85 ℃下加热10 min,5 000 r/min离心5 min,收集上清液冻干以获得酶解产物,使用前将其冷冻在-20 ℃ 下保存。
1.2.2 田螺肉中抗氧化肽的分离纯化
(1)超滤分段:取酶解液冻干粉,用水复溶,通过1 000,3 000 Da超滤膜分段为<1 000,1 000~3 000,>3 000 Da 3个部分,将冻干粉配制成1,2 mg/mL 溶液,测定各部位的DPPH自由基清除率、ABTS自由基清除率、铁离子还原能力(FRAP)、氧自由基吸收能力(ORAC),筛选出活性最强的部位进行下一步分离纯化。
(2)大孔树脂分离纯化:取超滤后体外活性最强的部位冻干粉用水复溶,浓度为10 mg/mL,将处理好的DA201-C大孔树脂装柱(16 mm×190 mm),样品上柱。大孔树脂柱分别用3 BV的去离子水、50%乙醇、75%乙醇洗脱,洗脱流速为1 mL/min,收集各洗脱部位,浓缩冻干后配制为1,2 mg/mL溶液,测定其DPPH自由基清除率、ABTS自由基清除率、铁离子还原力(FRAP)、氧自由基吸收能力(ORAC),筛选出活性最强的部位进行下一步分离纯化。
(3)凝胶过滤色谱的分离纯化:去大孔树脂纯化后活性最强的部位冻干粉用水复溶,浓度为25 mg/mL,将处理好的Sephadex G10装柱(20 mm×100 mm),样品上柱。先用去离子水平衡色谱柱,然后进行洗脱,洗脱溶剂为去离子水,洗脱流速为1 mL/min,2 mL收集一支EP管,在280 nm下检测其吸光度,收集各洗脱峰,浓缩并冻干制备成1,2 mg/mL溶液,测定其DPPH自由基清除率、ABTS自由基清除率、铁离子还原能力(FRAP)、氧自由基吸收能力(ORAC),选择活性最强的部位进行下一步的分离。
(4)半制备液相色谱的分离纯化样品:凝胶过滤色谱所得最强活性部位冻干粉,用水复溶,过0.22 μm的微孔滤膜,制备样品,进半制备液相。参考王少平等[7]的色谱条件进行半制备液相色谱分离纯化,收集各洗脱峰,冻干后制备为1 mg/mL溶液,检测其肽含量、DPPH自由基清除率、ABTS自由基清除率、铁离子还原力(FRAP)、氧自由基吸收能力(ORAC)确定活性最强的部位。
1.2.3 肽纯度检测 将半制备液相色谱分离获得的活性最强部位,过0.45 μm滤膜后,利用分析型高效液相色谱仪检测其纯度。检测条件为:BAX-ZOR300SB-C18柱(150 mm×6 mm,5 μm),流动相A:0.1% 三氟乙酸(TFA);流动相B:乙腈+0.1% TFA;梯度洗脱:0~50 min,5% B~50% B;50~65 min,50% B~95% B;流速:1 mL/min;检测波长:280 nm;进样量:10 μL。
1.2.4 田螺肽的活性检测
(1)DPPH自由基清除率的测定:根据Samad等[8]的测定方法,将2 mL 0.1 mmol/L DPPH溶液(溶剂为无水乙醇)和2 mL待测溶液混匀。在室温暗处静置30 min后,测量其在519 nm处的吸光度At。测定混有蒸馏水的待测溶液的吸光度Ar以及DPPH溶液的吸光度A0。DPPH自由基清除率c根据式(1)计算。
(1)
(2)ABTS自由基清除率的测定:参照Dauthal等[9]用ABTS和过硫酸钾制备自由基溶液,以2.45 mmol/L的终浓度稀释在水中,并且在黑暗中放置16 h以允许自由基生长,稀释溶液以在734 nm处达到约0.7的吸光度Ao,将0.96 mL ABTS+自由基溶液与0.04 mL各样品混合,734 nm处反应3 min后测量吸光度Ai,使用去离子水作为空白。ABTS自由基清除率d根据式(2)计算。
(2)
(3)铁离子还原能力的测定:参照郭晓青等[10]的方法并加以改进。在反应管中加入100 μL待测液,再加入2.4 mL FRAP工作液,37 ℃水浴10 min,于593 nm 处测定吸光度。以0.1~1.6 mmol/L的FeSO4标准液替代样品绘制标准曲线。以1.0 mmol/L的FeSO4为标准,样品抗氧化活性以达到同样吸光度值为一个FRAP值,计算结果。
(4)ORAC的测定:参照戴慧卿等[11]的方法,将供试品荧光衰减曲线下的保护面积代入Trolox方程,得到供试品的ORAC,结果用Trolox浓度表示。
(5)肽含量的测定:在反应管中加入1 mL待测液,再加入1 mL碱性铜试剂和4 mL福林酚试剂,55 ℃下反应5 min,冰水浴10 min,于650 nm处测定吸光度。以0.0~0.2 mg/mL牛血清白蛋白的标准液替代样品绘制标准曲线,利用标准曲线计算结果。
(3)
式中:
w——肽含量,%;
c——待测液浓度(根据标准曲线计算),mg/mL;
V——待测液体积,mL;
m——待测物质量,mg。
1.2.5 田螺肽的体内抗氧化活性检测
(1)小鼠饲养及训练条件:小鼠按照体重随机分组,共5组,1个空白组、3个试验组和1个阳性对照组。日常自由饮食,灌胃饲养40 d,运动前1.5 h灌胃,空白组灌胃双蒸水,试验组灌胃中华圆田螺抗氧化肽,阳性对照组灌胃谷胱甘肽,饲喂量为小鼠体重的3%。每日游泳训练1次,不负重,每次30 min,水温(30±2)℃。
(2)血清、组织匀浆的制备及指标检测:参照文献[12]。
1.3 统计分析
采用SPSS 22.0软件进行显著性差异分析,方法为Duncan multiple,P<0.05为差异显著。采用Origin 2017b进行作图[13]。
2 结果与分析
2.1 田螺肽的分离纯化
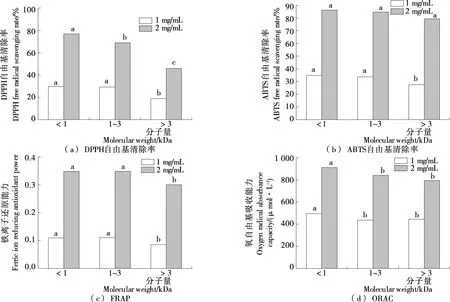
2.1.1 超滤 如图1所示,各项指标随样品浓度的增加而增大。在浓度为2 mg/mL时,<1 kDa部位的DPPH自由基清除率为76.81%,显著高于其他两个部位(P<0.05);两个浓度下,<1 kDa部位的ORAC均显著高于另外两个部位(P<0.05),<1 kDa和1~3 kDa部位的ABTS自由基清除率和FRAP相当且均高于>3 kDa部位的。分子量较小的<1 kDa部位具有良好的捕捉DPPH、ABTS自由基电子的能力及还原物质的能力。
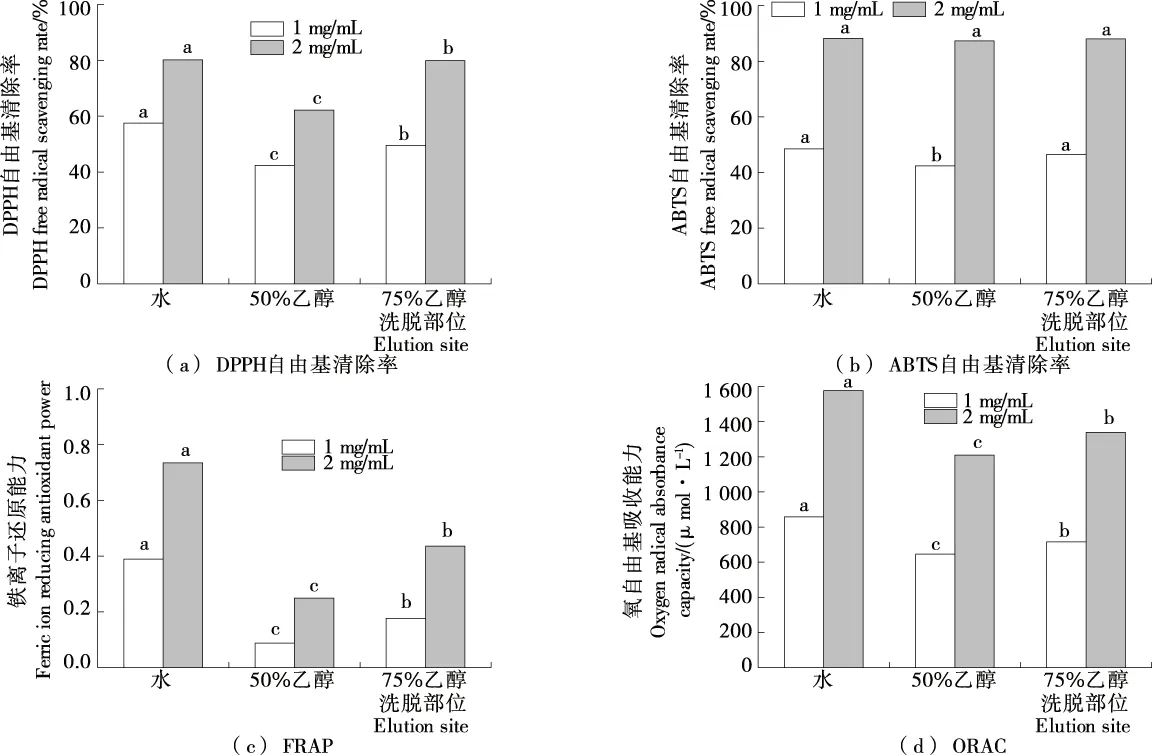
2.1.2 大孔树脂分离纯化 将<1 kDa部位经DA201-C大孔树脂分离为水、50%乙醇、75%乙醇洗脱部位。由图2 可知,各指标均随样品浓度增大而增大,在1,2 mg/mL 下水洗脱部位的DPPH自由基清除率分别为57.23%,80.14%,FRAP分别为0.387,0.734,ORAC分别为854.23,1 576.76 μmol/L,均显著高于其他两个部位的(P<0.05);ABTS自由基清除率分别为48.27%,88.23%,与75%乙醇部位的相当。以上表明,经大孔树脂分离的极性较大的<1 kDa水部位具有较强的抗氧化能力。
2.1.3 凝胶过滤色谱分离纯化 由图3可以看出,水洗脱部位经Sephadex G-10分离后被分成了3个部位。
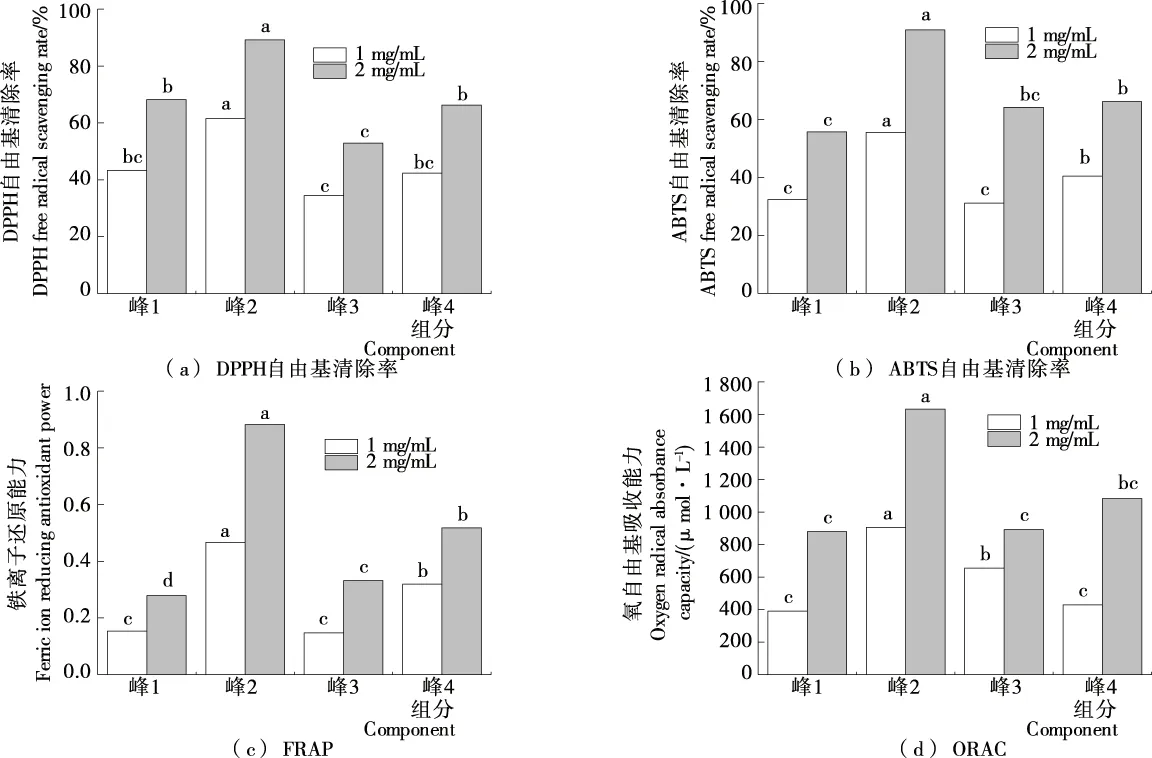
由图4可以看出,3个部位的各项指标随着样品浓度增大而增大。峰2的DPPH自由基清除率、ABTS自由基清除率、FRAP、ORAC在1,2 mg/mL时都为最大,分别为61.28%,89.21%;55.29%,90.87%;0.409,0.816;902.67,1 632.45 μmol/L,均显著高于其他部位的(P<0.05)。结果表明峰2部位具有较强的抗氧化能力。
同一浓度小写字母不同表示差异显著(P<0.05)
同一浓度小写字母不同表示差异显著(P<0.05)
2.1.4 半制备液相色谱纯化 由图5可知,凝胶过滤色谱得到的2号峰经过半制备液相色谱分离纯化后被分成了4个部位。
由图6可知,在酶解液浓度1 mg/mL时,峰2的DPPH自由基清除率和ABTS自由基清除率最强分别为60.42%,54.96%;ORAC也最高,为932.58 μmol/L,且均显著高于其他组(P<0.05);FRAP低于峰3,为0.378。以谷胱甘肽为阳性对照,1 mg/mL谷胱甘肽溶液的DPPH自由基清除率为65.29%,ABTS自由基清除率为62.09%,FRAP为0.599,ORAC为937.37 μmol/L。峰2的DPPH自由基清除率和ABTS自由基清除率略低于谷胱甘肽,ORAC与谷胱甘肽相当。ORAC法是基于氢原子转移的反应,目前氢原子转移反应被认为是自由基氧化反应的主要机制[14],因此,峰2为抗氧化活性最强的部位。
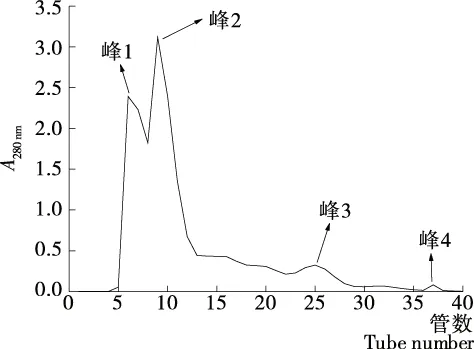
图3 1 kDa部位凝胶过滤色谱图
同一浓度小写字母不同表示差异显著(P<0.05)
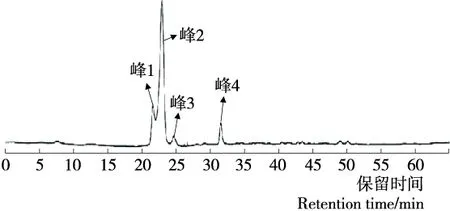
图5 半制备液相色谱分离色谱图
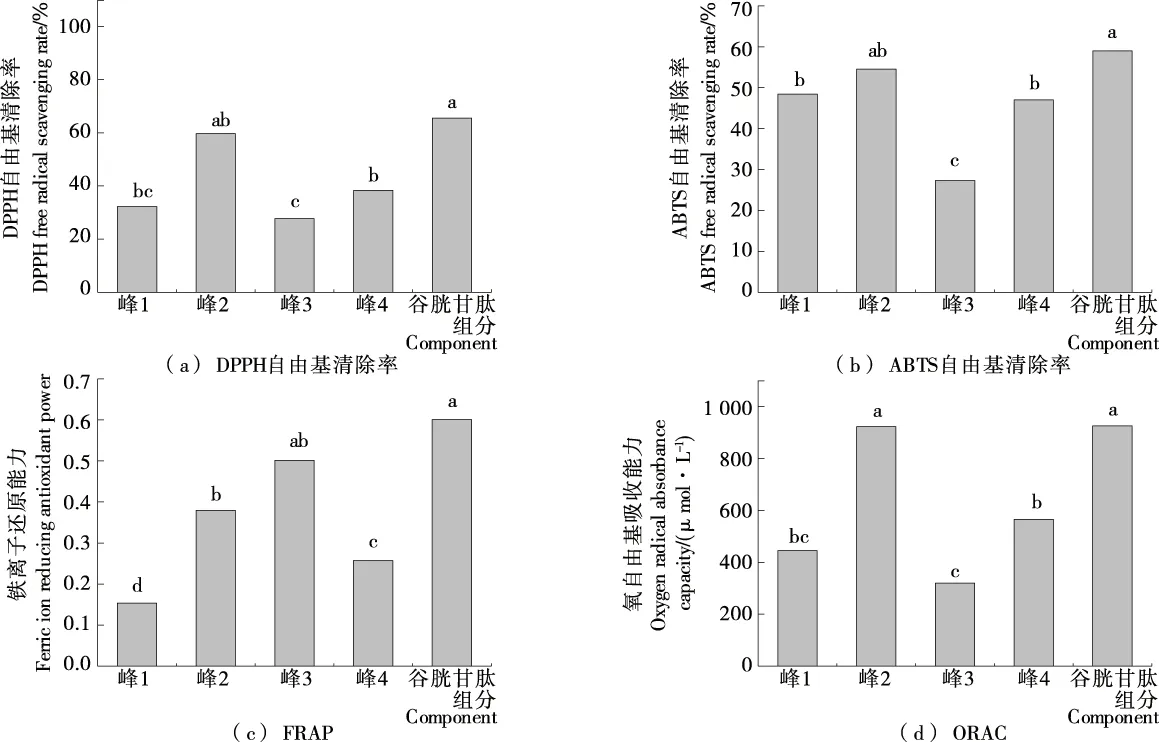
小写字母不同表示差异显著(P<0.05)
2.2 抗氧化肽纯度
所得肽段经肽含量测定为(78.65±2.02)%,如图7所示,半制备液相色谱所得2号峰主要为1个大峰,通过归一化法计算得到峰面积占比达到90%以上,说明通过分离纯化最终得到一个纯度较高的抗氧化肽片段[15]。
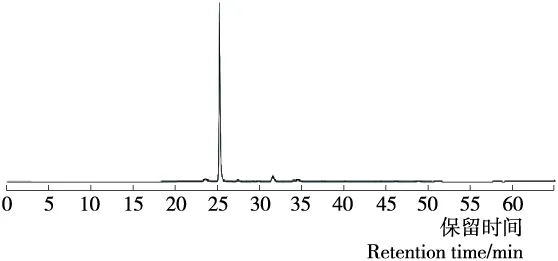
图7 分析液相色谱图
2.3 抗氧化肽的体内抗氧化活性
由图8可知,试验组小鼠的血清中过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化酶(GSH-PX)、总抗氧化能力(T-AOC)的活力与空白组相比均增大,且差异显著(P<0.05),除GSH-PX外,试验组与谷胱甘肽阳性对照组无显著差异(P>0.05),表明各种抗氧化酶在体内均发挥了与谷胱甘肽相当的抑制自由基的作用。试验组的MDA生成量明显低于对照组,且与谷胱甘肽相当,以上表明中华圆田螺抗氧化肽具有显著的体内抗氧化活性。
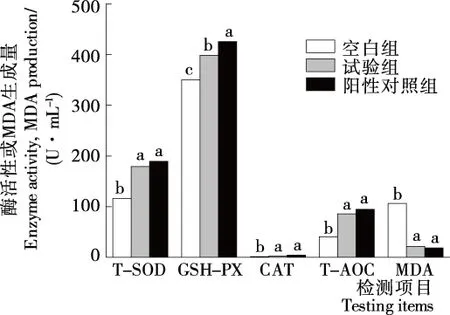
同一项目小写字母不同表示差异显著(P<0.05)
3 结论
对中华圆田螺肉碱性蛋白酶、胰蛋白酶双酶酶解液进行分离纯化,经超滤、大孔树脂、凝胶过滤色谱和半制备液相色谱分离后,获得了一个纯度和体外抗氧化活性均较高的肽段。试验对中华圆田螺肽中抗氧化活性肽进行了研究,据多项研究表示,抗氧化活性与多种氨基酸的作用息息相关,如亮氨酸等疏水性氨基酸[16],而中华圆田螺中有含量较高的亮氨酸[17],此外,多种氨基酸构成的小肽比氨基酸活性更强,可能与机体更高的相容性、易吸收及氨基酸的相互作用有关[18]。但试验针对中华圆田螺分离纯化所得抗氧活性肽未进行肽序测定及接下来的活性研究,对于体内活性测定的指标较为简单,还需进一步研究。

