高温处理对牛肉脂肪酸及脂肪氧化的影响
柯海瑞 康怀彬,2 程伟伟,2 蔡超奇
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.食品加工与安全国家级实验教学示范中心,河南 洛阳 471023)
目前,高温肉制品仍是市场主要的熟肉制品。高温肉制品是指加热介质温度高于100 ℃(通常为115~121 ℃),中心温度高于115 ℃并恒定适当时间的肉制品[1]。而肉制品热处理过程中脂肪发生的一系列氧化及水解反应都直接影响肉制品嫩度、多汁性以及风味[2]。
李洪军等[3]研究发现,加工时间对猪肉脂肪酸组成和风味变化有一定影响,而加工方式则对脂肪含量有影响。周慧敏等[4]研究发现100 ℃以上的高温对乳化肠脂肪酸比例破坏严重,并可显著促进脂肪氧化。刘梦等[5]研究发现高温干燥、低温熟制对牛肉干脂肪氧化的影响较小,且在此条件下处理得到的牛肉干UFA、MUFA和PUFA含量均达到最高,SFA含量最低,牛肉干营养价值损失最小。王瑞花等[6]研究发现烹制后猪肉脂肪氧化程度加大,SFA和UFA含量有所下降,UFA/SFA比值上升,营养价值和食用价值也有所上升。
目前,国内外对肉制品脂肪氧化的研究多集中在加工处理过程中压力大小的影响,而100 ℃以上热处理对牛肉肌内脂肪影响的研究较少[7]。试验拟研究不同高温处理对牛肉脂肪酸及脂肪氧化的影响,以期为牛肉加工过程中热处理温度、时间的控制提供理论依据。
1 材料与方法
1.1 材料与试剂
牛背最长肌(排酸处理后):秦川公牛(2~3岁),重庆恒都农业开发有限公司;
硫代硫酸钠标准溶液:分析纯,北京北方伟业计量技术研究院;
乙二胺四乙酸(EDTA):分析纯,天津市永大化学试剂有限公司;
硫代巴比妥酸、三氟化硼:分析纯,上海源叶生物科技有限公司;
冰乙酸、碘化钾、无水硫酸钠、可溶性淀粉、重铬酸钾、三氯甲烷、石油醚、三氯乙酸、甲醇、异丙醇、氯化钠、乙酸、乙醚、盐酸、氢氧化钠:分析纯,天津市德恩化学试剂有限公司;
37种脂肪酸甲酯混合标准品、十九烷酸:色谱纯,美国Sigma公司;
正己烷、2,2-二甲氧基丙烷:色谱纯,上海阿拉丁生化科技有限公司;
色谱柱:SP-2560毛细管柱(100 m×0.25 mm×0.2 μm),美国 Sigma 公司。
1.2 仪器与设备
高速分散均质机:FJ-200型,上海标本模型厂;
高压蒸汽灭菌锅:TYAIB型,宁波久兴医疗器械有限公司;
紫外—可见分光光度计:T6新世纪型,北京普析通用仪器有限公司;
旋转蒸发器:RE-52AA型,上海亚荣生化仪器厂;
干式氮吹仪:YY-N100型,上海允延仪器有限公司;
分析天平:ATY124型,日本岛津有限公司;
高速多功能粉碎机:RHP-100型,浙江荣浩工贸有限公司;
气相色谱仪:7890A型,美国Aglient公司。
1.3 方法
1.3.1 牛肉的修正及高温处理 生鲜牛背最长肌去除表面及夹层脂肪和筋膜组织,切割成5 cm×5 cm×1 cm肉块,用蒸煮袋进行真空包装,放入高压蒸汽灭菌锅中进行高温处理。根据张莉莉[8]的处理方法修改如下:高温处理条件为压力0.12 MPa,当中心温度达到(110±1),(115±1),(121±1)℃后分别保持5,10,15,20 min,处理后的样品静置冷却后存放在4 ℃冷藏室待测。
1.3.2 过氧化值(POV)的测定 按GB 5009.227—2016执行。
1.3.3 硫代巴比妥酸值(TBARS)的测定 参考Marianne等[9]的方法并修改如下:称取20 g牛肉样品,切块,用粉碎机粉碎,用含0.05 g乙二胺四乙酸的7.5 g/100 mL 三氯乙酸溶液50 mL浸没,匀浆30~60 s,静置6 h充分浸提,过滤,取10 mL滤液,加入同体积0.02 mol/L 的TBA水溶液,90 ℃水浴40 min;取出冷却至室温,继续加入10 mL三氯甲烷摇匀,静置分层后,取上层有色液体分别在532,600 nm处测定吸光度。按式(1)计算TBARS值。
(1)
式中:
C——TBARS值,mg/100 g;
A1——上层液体在532 nm处的吸光度;
A2——上层液体在600 nm处的吸光度;
Y532——丙二醛在532 nm处的毫摩尔消光系数,115;
M——丙二醛相对分子质量,72.6。
1.3.4 脂肪酸的测定 参考GB 5009.168—2016并进行修改。
(1)肌内脂肪的提取:根据Folch等[10]的方法,略作修改。准确称量100 g牛肉样品,真空密封高温处理后,粉碎机粉碎,加入200 mL三氯甲烷—甲醇溶液(2∶1,体积比),8 000 r/min均质;静置5 h,过滤,留取滤液,滤渣继续加入100 mL三氯甲烷—甲醇溶液,重复上述步骤,合并滤液,加入约60 mL生理盐水,振荡摇匀;静置5 h,去除上层溶液,用加有无水硫酸钠的滤纸过滤下层有机溶剂,将过滤后的下层液体移入烧瓶中,45 ℃下旋转蒸发,待其浓缩成黏稠油状液体后转移至10 mL离心管中进行氮吹直至恒重,得到固体提取物。
(2)皂化:称取0.2 g脂肪提取物于20 mL离心管中,准确加入1 mL十九烷酸内标物和6 mL质量分数2%的氢氧化钠—甲醇溶液,60 ℃水浴30 min。
(3)甲酯化:皂化后的溶液加入5 mL质量分数15%三氟化硼甲醇溶液,60 ℃水浴15 min。
(4)脂肪酸甲酯的提取:冷却至室温,加入2 mL正己烷,震荡2 min,再加入1 mL饱和氯化钠水溶液和2 mL 蒸馏水剧烈震荡,待静置分层后,吸取上层正己烷溶液至10 mL试管中,加入1~2 g无水硫酸钠,振摇1 min,静置5 min,过滤,滤液经0.25 μm滤膜再次过滤到进样瓶中,待测定。
1.4 数据处理与分析
每次试验做3次平行,结果用(均值±标准差)表示,测定结果采用DPS软件进行数据分析,采用Origin 9.1软件作图。
2 结果与分析
2.1 对牛肉脂肪POV值的影响
由图1可知,牛肉POV值随加热时间的延长而显著上升(P<0.05)。其中,121 ℃下处理10 min时,POV值出现小幅度下降,可能是随着热处理时间的延长,脂肪二级氧化速率进一步增大,氢过氧化物的氧化分解加快,导致POV值下降[11]。110,115 ℃下处理10 min时,POV值无明显下降,一方面可能是随着加热时间的延长,脂肪初级氧化速率进一步增大,与二级氧化达到了动态平衡,氢过氧化物含量持续积累[12],另一方面在高温处理后期,牛肉汁液流失严重,牛肉水分含量下降导致金属离子表面水化层消失且无法进行美拉德反应产生抗氧化物质,从而进一步加速脂肪氧化[13-15]。
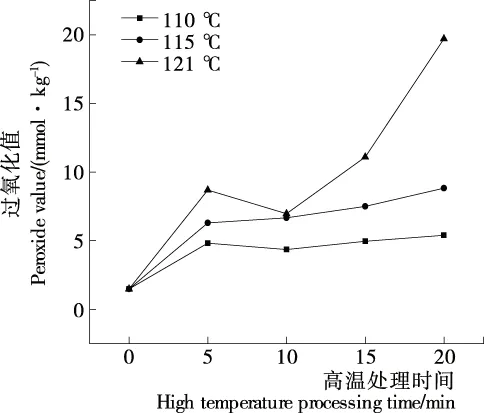
图1 不同高温处理条件对牛肉肌内脂肪POV值的影响
Figure 1 Effect of different high temperature treatment conditions on intramuscular fat peroxide value of beef
2.2 对牛肉脂肪TBARS值的影响
由图2可知,牛肉肌内脂肪TBARS值随加热时间的延长而显著上升(P<0.05)。其中,115 ℃下处理15 min时,TBARS值出现小幅度下降,可能是以丙二醇为代表的二级氧化产物与氨基反应,或与氨基酸、糖原结合导致TBARS值下降[16-17],也有可能是丙二醛进一步氧化成醇、醛、羧酸等挥发性化合物[18]。不同加热时间牛肉样品TBARS值虽有波动,但整体均随处理温度的升高而增大,与马汉军等[19]的研究结论一致。121 ℃下处理牛肉样品中,次级氧化产物积累严重,TBARS值均高于其他温度(110,115 ℃)下的(P<0.05),且随处理时间的延长呈明显上升趋势(P<0.05),表明传统商业无菌要求的热处理温度(121 ℃)处理下的牛肉样品脂肪氧化速率较快,需及时进行时间控制。

图2 不同高温处理条件对牛肉肌内脂肪TBARS值的影响
Figure 2 Effects of different high temperature treatment conditions on TBARS value of beef intramuscular fat
2.3 对牛肉脂肪酸的影响
2.3.1 饱和脂肪酸 由表1可知,110,115 ℃处理下,长链脂肪酸(LCFA)含量均随加热时间的延长而显著上升(P<0.05);121 ℃下处理15,20 min时,除月桂酸(C12:0)缓慢上升外(P>0.05),其他几种LCFA均出现了一定程度的下降,其中C16:0、C17:0、C18:0、C20:0下降不显著(P>0.05),可能是不饱和脂肪酸不断氧化补充所致。未进行高温处理时,棕榈酸(C16:0)、硬脂酸(C18:0)含量分别为24.58,20.13 g/100 g脂肪,都有一定的降低血清胆固醇功能,且均在121 ℃下处理10 min时达到最大含量;肉豆蔻酸(C14:0)是人体主要SFA,其含量与血清胆固醇有一定相关性,在115 ℃下处理20 min时含量达到最大;丁酸(C4:0)、己酸(C6:0)、辛酸(C8:0)和癸酸(C10:0)含量在121 ℃ 下处理15,20 min时出现明显上升(P<0.05),可能是由于高温对作用对象产生大分子化合物解聚作用,使肌内脂肪中一些LCFA断裂成为短链脂肪酸(SCFA)和中链脂肪酸(MCFA),从而影响食物中脂肪酸的组成[20]。丁酸属于SCFA的一种,在人体内有调节肠道菌群、抗炎症、免疫抑制和提供能量等重要的生理功能[21]。己酸、辛酸和癸酸作用于微生物,抑制病原菌活性,对人体健康有一定的益处[22]。
2.3.2 单不饱和脂肪酸 由表2可知,除油酸(C18:1c)外,MUFA含量随高温处理程度的加深而显著下降(P<0.05),可能是由于超过100 ℃高温使MUFA中的双键加氢形成SFA[23]。此外,油酸含量随热处理时间的延长先上升后下降(P<0.05),在110,115,121 ℃下分别处理15,10,5 min达到该温度下的最大值,其中110 ℃下处理15 min时的含量最高,为33.62 g/100 g脂肪,主要是因为热处理初期C18:2n6、C18:3n3、C18:3n6转化成油酸的速率大于油酸进一步加氢转化成硬脂酸的速率[24];110 ℃下处理15 min后,随着热处理程度的加深,油酸氧化分解速率进一步加大,使得油酸含量下降。油酸是肉中主要的脂肪酸,占MUFA的85%以上[25],其不仅能很好地改善牛肉风味[26],还有预防动脉硬化的生理功能;其效果与亚油酸相似[27],同时对于其他脂肪酸的吸收也有一定的促进作用[28]。
2.3.3 多不饱和脂肪酸 由表3可知,PUFA含量随高温处理程度的加深而显著下降(P<0.05),其中C20:3n3、花生四烯酸、EPA、DHA 4种功能性脂肪酸随热处理程度的加深逐渐全部氧化降解;PUFA含量受热处理温度和时间的影响均有明显变化(P<0.05)。
2.3.4 脂肪酸组成及比例 由表4可知,SFA含量在110,115 ℃下处理时显著上升(P<0.05),在121 ℃下因受棕榈酸和硬脂酸这两种主要SFA的影响整体先上升(0~15 min)后下降(20 min);UFA、PUFA含量整体下降(P<0.05),在121 ℃下处理20 min时的含量达到最低,可能是由于PUFA结构中不稳定的双键含量较高,高温下进行PUFA的加氢反应,导致MUFA和SFA含量上升;MUFA含量在110 ℃下处理15 min时达到最高(37.92 g/100 g脂肪),主要是因为此时PUFA转化成MUFA的速率大于MUFA氧化分解的速率。
SFA含量并非越少越好,其与人体的生理功能有很多潜在的关联。Wood等[29]提出用PUFA和SFA的比率(P/S)来衡量脂肪酸营养价值,认为P/S为0.40或稍高于0.40较好,Enser等[30]则建议P/S应高于0.45,而肉类的自然比例多在0.1左右[31]。试验中生鲜牛背最长肌中的P/S为0.35,接近推荐值,热处理后牛肉样品中P/S进一步减小;此外,n-6∶n-3 也是衡量肉品脂肪酸比例营养的另一个重要指标[32],中国营养学会提出n-6∶n-3的值4∶1~6∶1为最佳[33],试验中n-6∶n-3普遍过高,因此在肉制品脂肪酸平衡方面仍需要不断研究改善。
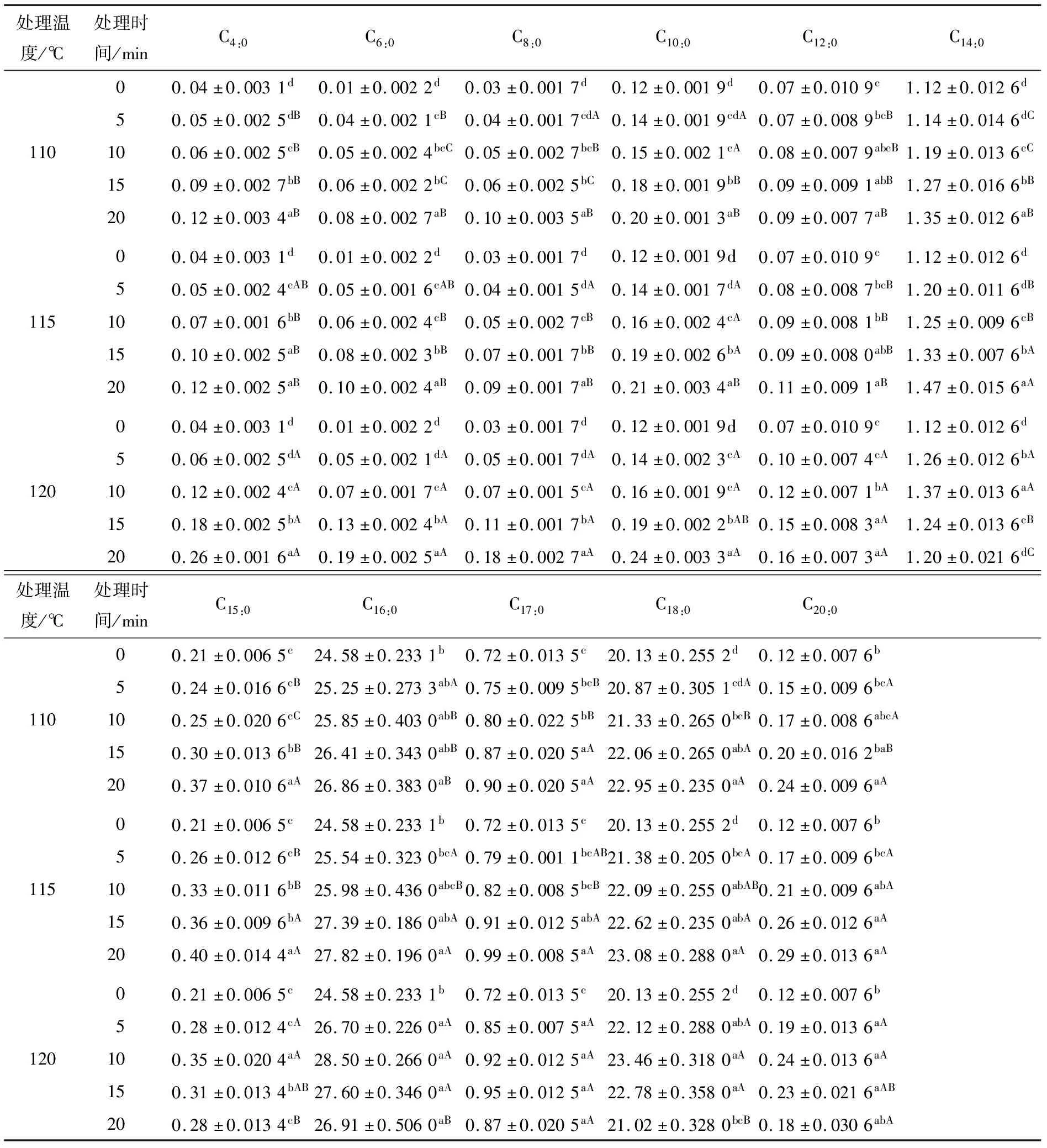
表1 不同高温处理对牛肉主要饱和脂肪酸含量的影响†
† 小写字母不同表示同一温度组内差异显著(P<0.05),大写字母不同表示不同温度组间差异显著(P<0.05)。

表2 不同高温处理对牛肉主要单不饱和脂肪酸含量的影响†
† 小写字母不同表示同一温度组内差异显著(P<0.05),大写字母不同表示不同温度组间差异显著(P<0.05)。
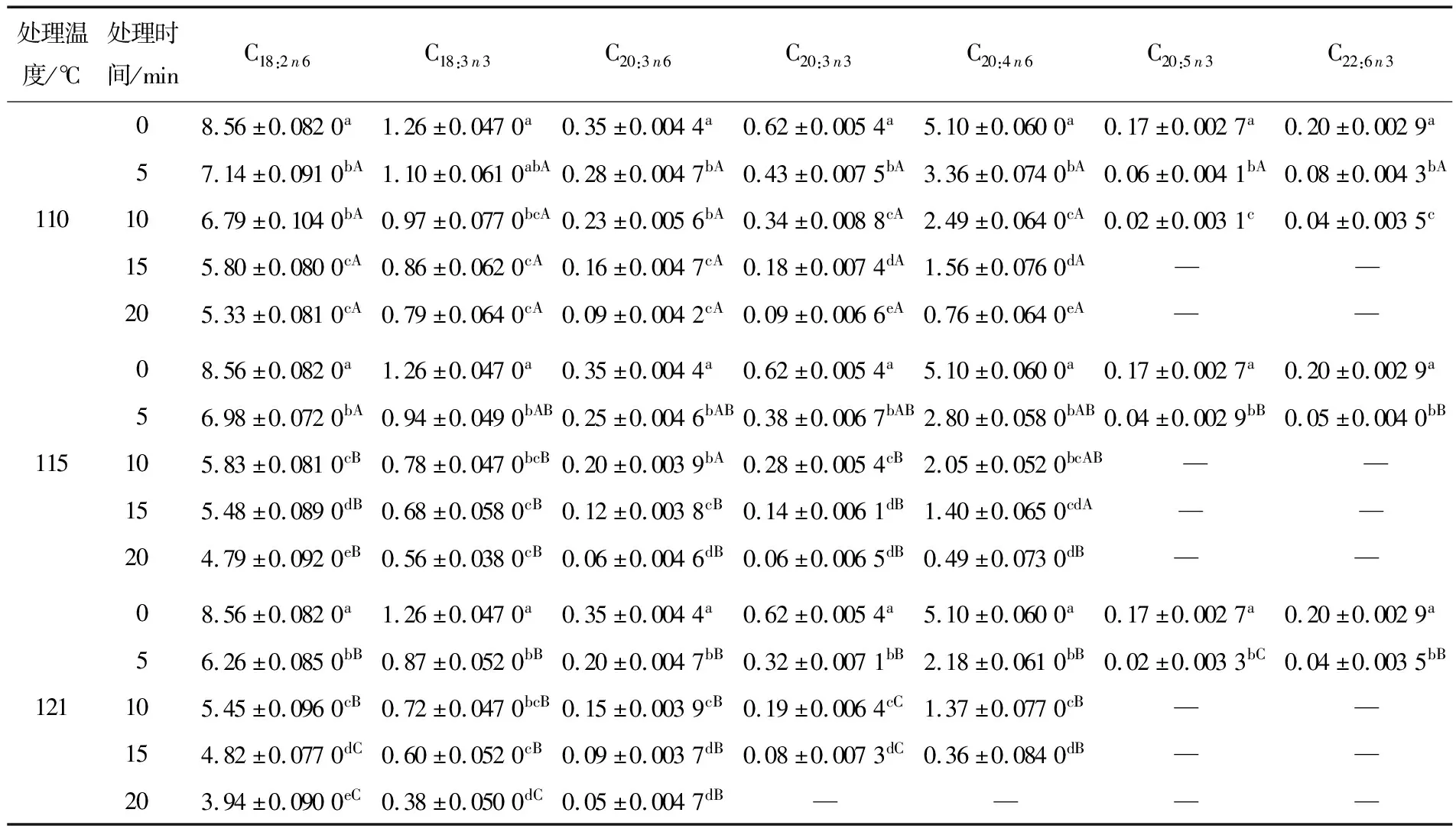
表3 不同高温处理对牛肉主要多不饱和脂肪酸含量的影响†
† 小写字母不同表示同一温度组内差异显著(P<0.05),大写字母不同表示不同温度组间差异显著(P<0.05),—表示未检测。

表4 不同高温处理对牛肉脂肪酸组成及比例的影响†
† 小写字母不同表示同一温度组内差异显著(P<0.05),大写字母不同表示不同温度组间差异显著(P<0.05)。
3 结论
研究发现牛肉肌内脂肪氧化程度随热处理程度的加深显著上升,且121 ℃高温处理时,肌内脂肪氧化速度较其他温度处理组显著上升。热处理温度和处理时间对UFA含量均有显著影响,但高温处理时间对SFA影响显著、高温处理温度对SFA影响不显著。长链饱和脂肪酸在高温热处理条件下可能出现断裂或降解,生成有抗癌、降血脂功能的短链脂肪酸或中链脂肪酸。后续可将牛肉全程置于氮气环境下进行高温处理,通过分析牛背最长肌挥发性风味物质的变化,研究脂肪酸氧化降解与挥发性风味物质产生的作用机理。

