过表达Nurr1人羊膜间充质干细胞对帕金森病大鼠黑质纹状体的保护作用研究
陈 琳,甘 露,周红艳,梁江红
帕金森病(Parkinson’s disease,PD)是当前临床常见的中枢神经系统疾病,目前临床上针对该病主要的治疗方法包括手术、药物以及基因治疗等[1]。随着干细胞技术的成熟和发展,干细胞移植治疗有望成为PD治疗的重要手段[2]。人羊膜间充质干细胞 (human amnion-derived mesenchymalstem cells, hAD-MSCs) 具有多向分化潜能,体外扩增能力强,移植后细胞能存活,可分化为神经元样细胞[3]。核相关受体因子1(nuclear receptor related factor 1,Nurr1)基因是属于核受体超家族的转录因子,主要表达于中枢神经系统,在中脑黑质海马、小脑、下丘脑后部等均呈现高表达[4]。该研究将hAD-MSCs移植和Nurr1基因结合起来进行研究,探讨过表达Nurr1 人羊膜间充质干细胞对PD大鼠黑质纹状体的保护作用。
1 材料与方法
1.1细胞鉴定人羊膜间充质干细胞hAD-MSCs购自北京裕恒丰科技有限公司,将hAD-MSCs经0.05%胰蛋白酶消化后,使用1% BSA调整细胞浓度在1×106/ml加入荧光标记抗体(CD29-PE、CD44-PE、CD-34-PE)于150 μl细胞悬液避光孵育0.5 h,随后加入2 ml含1 g/L叠氮化钠(NaN3)的PBS,振荡混匀后,1 000 r/min离心5 min,弃上清并加入10 g/L多聚甲醛200 μl混匀,5 min内流式细胞仪上机检测,使用Cell Quest软件分析。
1.2细胞转染在国家生物技术中心(National Center for Biotechnology Information,NCBI)的Gene库查阅大鼠Nurr 1基因(别名:Nr4a2,Gene ID:54278)并获取其编码序列。真核表达载体(pcDNA3.1-Nurr1)及阴性对照载体(pcDNA3.1-Negative control)均由美国赛默飞世尔公司完成。质粒小量制备试剂盒(PLN350-1KT,美国Sigma公司)提取pcDNA3.1-Nurr1载体。使用lipofectamine试剂盒(11668019,美国Invitrogen公司)将上述载体转染至传代后的hAD-MSCs,转染后24 h加入新霉素使培养基终浓度为300 μg/ml。
1.3细胞移植及分组20只雄性PD模型Sprague-Dawley大鼠及10只雄性正常Sprague-Dawley大鼠购自北京瑞金特生物科技有限公司,质量在180~220 g。饲养环境:温度20~25 ℃,湿度50%~60%;光照12 h,黑暗12 h。20只PD大鼠随机分为阴性对照组和Nurr1组,每组各10只。适应性喂养1周后,腹腔注射3%戊巴比妥钠(50 mg/kg)麻醉后,用微量注射器将含有约2×105个hAD-MSCs(含pcDNA3.1-N urr1或pcDNA3.1-Negative control质粒)的DMEM 5 μl移植到Nurr1组小鼠右侧纹状体,阴性对照组转染阴性对照质粒。另选10只正常Sprague-Dawley大鼠作为生理盐水组,于相同部位注射等量的生理盐水。
1.4旋转实验三组大鼠分别在分组后第4、8、12天上午9点在直径为40 cm的不锈钢盆中观察记录大鼠的旋转次数与持续时间。
1.5qRT-PCR总RNA提取试剂盒购自美国Promega公司,大鼠黑质纹状体总RNA提取依照试剂盒说明书进行,以cDNA为模板,采用miScript SYBR Green PCR Kit(218073,德国QIAGEN公司)进行实时荧光定量PCR,PCR反应序列见表1。利用2-ΔΔCt法检测大鼠黑质纹状体中各基因mRNA表达水平。2-ΔCt计算目的基因相对表达量,每个实验均重复3次,其中ΔCt为目的基因和内参照基因Ct值的差值。

表1 qRT-PCR引物
1.6Westernblot所有抗体购自英国Abcam公司。提取细胞总蛋白并依据BCA试剂盒说明书对蛋白进行定量。取20 μl总蛋白并电泳、转膜并且封闭后在 37 ℃下轻摇2 h后分别加入一抗Nurr1、多巴胺转运体(dopamine transporter,DAT)、α-突触共核蛋白(α synuclein,α-syn)进行孵育。于4 ℃轻摇过夜后,用TBST洗膜3次,每次5 min,以β-actin作为对照。洗膜结束后加入二抗IgG于37 ℃下孵育1.5 h后用TBST洗膜3次,每次5 min。ECL显影,曝光,用Quantity One软件进行半定量分析,实验均重复3次。
1.7免疫组化取-80 ℃冰箱保存的黑质纹状体于4%多聚甲醛常规灌注固定,置于20% 蔗糖溶液(4 ℃)中过夜,蜡块制作切片,脱腊。切片滴加2滴3% H2O2室温孵育10 min,PBS洗涤3次,每次3 min;随后滴加一抗酪氨酸羟化酶(tyrosine hydroxylase,TH)室温孵育2 h,PBS洗涤5次,每次3 min;滴加辣根过氧化物酶标IgG室温孵育30 min,PBS洗涤5次,每次3 min。50 μl DAB于25 ℃显色5 min,随后苏木精复染,0.1%盐酸分化,自来水冲洗,酒精脱水干燥,二甲苯透明,中性树胶封固,晾干后高倍镜下观察,统计阳性染色面积率。
1.8HE染色将黑质纹状体切片使用二甲苯脱腊20 min,梯度浓度酒精(100%、95%、80%、75%)脱水1 min,蒸馏水洗2 min,苏木精染色10 min,蒸馏水冲洗反蓝,盐酸乙醇分化30 s,50 ℃温水浸泡5 min,伊红染色30 s后蒸馏水洗去背景红色。随后70%和90%酒精脱水各10 min,二甲苯透明,中性树胶封片,高倍镜下观察组织形态。
1.9Tunel染色制备好的黑质纹状体切片二甲苯浸洗2次,每次5 min,梯度酒精脱水(100%、95%、80%、75%)各3 min,PBS洗涤3次,每次5 min;20 μg/ml不含DNase的蛋白酶K工作液处理组织15~30 min,PBS洗涤3次,每次5 min,烘干;玻片滴加50 μl Tunel反应液于37 ℃反应60 min,PBS洗涤3次,每次5 min,50 μl DAB于25 ℃显色10 min, PBS洗涤3次,每次5 min。苏木精复染,自来水冲洗3次,每次5 min。梯度酒精脱水,二甲苯透明,中性树胶封固。光学显微镜下观察,计算细胞凋亡率。
1.10统计学处理采用SPSS 21.0软件进行统计分析,两组间数据分析使用T检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1细胞鉴定结果流式细胞仪检测含有表面抗原CD29、CD44和CD34的hAD-MSCs数目:hAD-MSCs中高表达CD29和CD44但几乎不表达CD34。见图1。
2.2过表达Nurr1的hAD-MSCs移植改善PD大鼠旋转行为对各组大鼠进行旋转实验:与生理盐水组各时间段相比,其余组大鼠在各时间段旋转次数及持续时间显著减少。与阴性对照组相比,Nurr1组旋转次数和持续时间在移植后第4天无显著差异,但在第8天和第12天上述指标显著减少(P<0.05)。见表2、3。
2.3Nurr1过表达上调黑质纹状体DAT但下调α-synqRT-PCR和Western blot检测结果:与生理盐水组相比,其余组大鼠Nurr1、DAT mRNA及蛋白表达均降低,但α-syn表达上调。与阴性对照组相比, Nurr1组Nurr1和DAT表达上调但α-syn表达下调(P<0.05)。见图2。
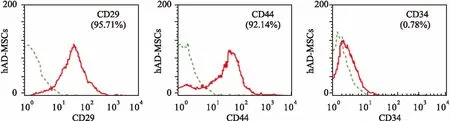
图1 CD29、CD44和CD34在hAD-MSCs中表达
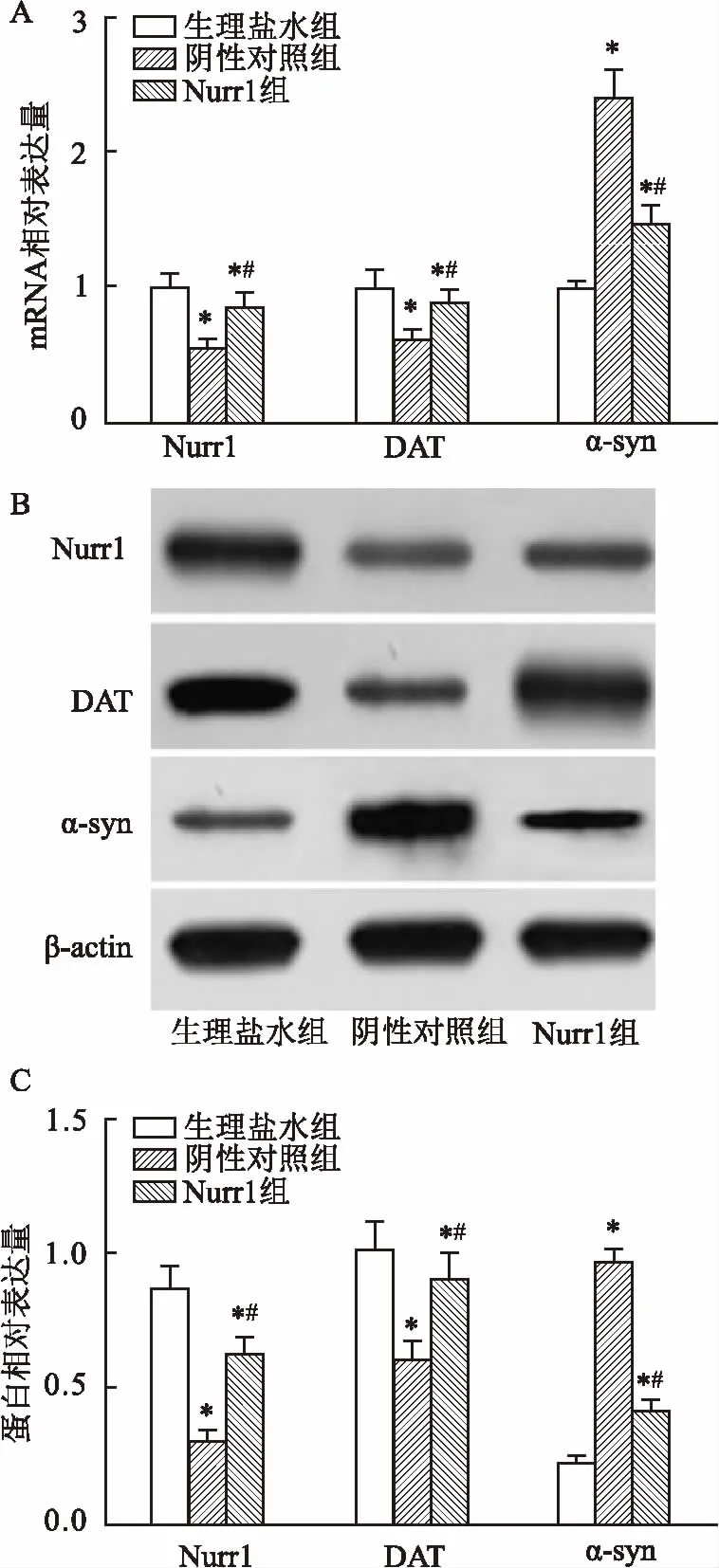
图2 大鼠黑质纹状体Nurr1、DAT和α-syn的表达
2.4Nurr1过表达上调黑质纹状体TH表达免疫组化检测结果:TH存在于黑质纹状体组织的胞质与胞核,其阳性细胞胞体较大,多神经元突起。与生理盐水组相比,其余组大鼠TH表达显著降低。与阴性对照组相比,过表达Nurr1能促进TH上调。见图3。
2.5Nurr1过表达有助于改善黑质纹状体病理形态HE染色观察各组大鼠黑质纹状体病理特征:生理盐水组及神经元数目较密,排列整齐有序,间质清晰;阴性对照组神经元排列紊乱、数目减少、胞体轮廓模糊,胞质肿胀,部分空泡变性或皱缩坏死。但Nurr1组上述情况较为改善。见图4。
2.6Nurr1过表达减少黑质纹状体细胞凋亡Tunel染色检测各组大鼠黑质纹状体细胞凋亡情况:与生理盐水组相比,其余组细胞凋亡率显著升高。与阴性对照组相比,过表达Nurr1能减少黑质纹状体细胞凋亡。见图5。
3 讨论
PD作为老年中枢神经系统疾病,主要是由于中脑黑质多巴胺(dopamine, DA)能神经元变性死亡进而导致黑质纹状体中DA含量显著减少而引起的[5]。目前常见的手术和药物治疗仅仅能够起到缓解PD症状的作用,难以有效延缓病程、改善脑内DA含量并且保护DA能神经元[6]。基因治疗以及干细胞移植方法的出现为该病的治疗提供了良好的方法。
动物实验研究[7]证实hAD-MSCs能改善PD模型动物的症状,但因涉及复杂的重编程技术,且存在诱导效率低,其实际应用还有较大障碍。基因治疗主要是通过基因或病毒载体转染于病变部位进而实现治疗的目的[8]。有研究[9]证实将外源性的TH基因导入PD模型大鼠纹状体内可增加脑内DA的水平。Nurr1基因在中脑DA能神经元的发育过程中具有重要意义,Nurr1基因缺乏能够导致大鼠脑黑质DA能神经元显著降低[10]。有研究[11]将Nurr1基因修饰的细胞移植于PD大鼠脑中发现大鼠纹状体内DA含量显著升高,但进一步研究却发现仅仅是Nurr1基因难以对大鼠DA水平及其症状进行长期改善。本研究将hAD-MSCs移植和Nurr1基因结合起来进行研究,显示过表达Nurr1 人羊膜间充质干细胞对PD大鼠黑质纹状体具有明显保护作用。

表2 各组大鼠旋转次数
与生理盐水组比较:*P<0.05;与阴性对照组比较:#P<0.05
表3 各组大鼠旋转持续时间
与生理盐水组比较:*P<0.05;与阴性对照组比较:#P<0.05
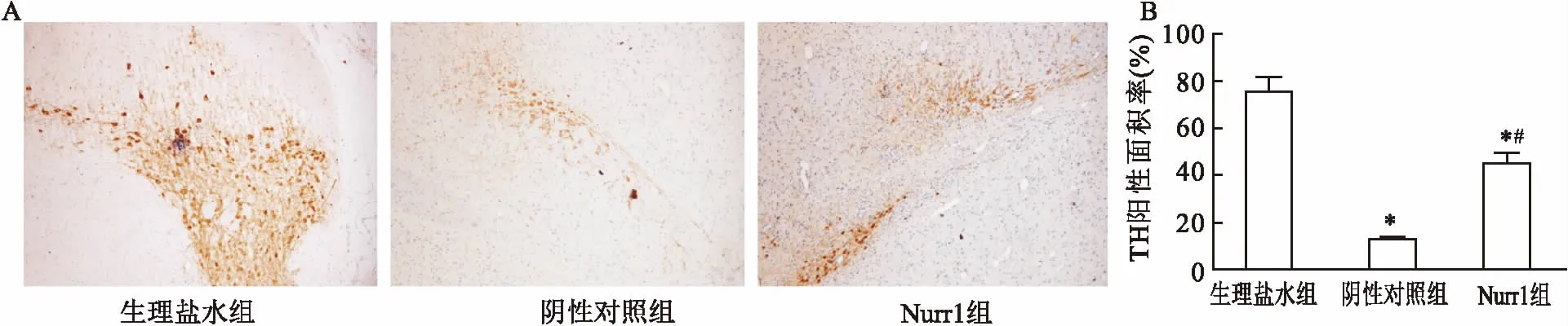
图3 免疫组化检测大鼠黑质纹状体TH表达 × 400
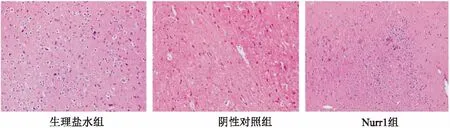
图4 HE染色观察大鼠黑质纹状体病理情况 × 200
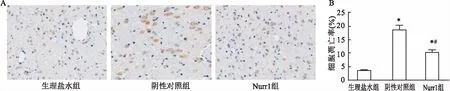
图5 Tunel染色检测大鼠黑质纹状体细胞凋亡 × 400
本实验流式细胞仪检测含有表面抗原CD29、CD44和CD34的HAMSCs数目显示,HAMSCs中高表达CD29和CD44等间充质干细胞标志,但几乎不表达作为造血干细胞标志的CD34。进一步证实了HAMSCs具有干细胞特性。尚玉攀 等[12]在研究中也证实了这一点。对各组大鼠进行旋转实验发现Nurr1组相对于阴性对照组来说其在第8天和第12天时各时间段旋转次数及持续时间显著减少。证实过表达Nurr1的HAMSCs移植能够改善PD大鼠旋转行为。中脑黑质DA能神经元丢失进而引起的DAT水平降低是导致PD发病的重要原因,研究[13]证实,PD、阿尔茨海默病以及多系统萎缩等疾病的发病与突触核蛋白表达异常存在密切关联,也被称为突触核蛋白病。α-syn作为路易小体的重要组成,其异常表达是引起以上疾病发病的重要原因[14]。而本研究表明,Nurr1过表达能够上调黑质纹状体DAT,同时促进α-syn水平的下调,这也进一步证实了其在改善PD中的重要作用。TH是人脑内关键DA递质通路,在DA的合成中起着重要作用[15]。免疫组化结果显示,过表达Nurr1能够显著促进TH的上调,减轻对于大鼠黑质纹状体DA能神经元的损伤。HE染色和Tunel染色结果进一步证实,Nurr1过表达能够显著改善大鼠黑质纹状体病理形态、减少其细胞凋亡情况。
本研究首次将Nurr1过表达人羊膜间充质干细胞用于PD大鼠的治疗,结果显示,该方法能够显著改善大鼠病理症状,提高黑质纹状体DAT及TH含量,对于PD的治疗提供了新的思路。今后本研究会深入关注Nurr1过表达人羊膜间充质干细胞对于大鼠黑质纹状体保护作用的具体机制。

