白藜芦醇通过Nrf2/ARE信号通路降低AA大鼠脾脏中氧化应激反应
瞿子庭,胡永涛,杨孝娟,殷曈昕,朱皓晨,陈思娴,曹 威,王高远,陈晓宇
类风湿性关节炎(rheumatoid arthritis,RA)是一种以多发性,对称性和增生性滑膜炎为特征的自身免疫病。其病理特征是炎性细胞浸润、滑膜细胞增生和血管翳形成[1]。佐剂性关节炎(adjuvant arthritis,AA)大鼠模型是RA药物治疗研究的理想动物模型[2]。除侵犯关节外,RA患者可发生脾肿大,脾脏中辅助T细胞亚群平衡失调,文献[3]报道AA大鼠脾脏存在病理学损伤。白藜芦醇(resveratrol,Res)主要存在于葡萄、花生和虎杖中,具有抗炎、抗感染和抗肿瘤的作用[4]。氧化应激与RA的发生发展密切相关,α-硫辛酸是已被证实的具有显著抗氧化应激和减轻炎症作用的药物[5]。而Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)-核因子NF-E2相关因子(nuclear factor erythroid 2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant responsive element,ARE)信号通路是氧化应激反应的关键通路,Nrf2是该通路中的关键蛋白,具有多种生物学效应,如维持氧化和抗氧化的平衡以及抑制细胞凋亡等,但Nrf2持续激活会使组织受到更严重的氧化应激损伤[6]。该研究旨在探讨Res能否通过Keap1-Nrf2/ARE通路调节AA大鼠脾脏组织氧化应激水平,缓解AA大鼠疾病的发展进程。
1 材料与方法
1.1实验材料
1.1.1实验动物 清洁级雄性SD大鼠50只,体质量(180±20)g,由安徽医科大学实验动物中心提供,饲养于光照12 h/黑暗12 h,室温(25±2)℃,通风良好并可自由摄食饮水。
1.1.2实验试剂与仪器 Res、弗氏完全佐剂(FCA)购自美国Sigma公司;丙二醛(malondialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒购自上海碧云天有限公司;Keap1、Nrf2、锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD)等多克隆抗体购自美国Santa Cruz Biotechnology公司;RM2235切片机购自德国Leica公司;高速离心机购自美国SHELLAB公司。
1.2实验方法
1.2.1实验动物分组及标本收集 随机将50只SD大鼠均分为5组:对照组、模型组、Res低剂量组[5 mg/(kg·d)]、Res高剂量组[100 mg/(kg·d)]和阳性药α-硫辛酸治疗组[100 mg/(kg·d)]。喂食1周后,对照组大鼠皮下注射0.1 ml生理盐水至左足趾,其余大鼠注射0.1 ml FCA以诱发炎症,建立AA大鼠模型。12 d后,对照组和模型组给予等体积0.5%羧甲基纤维素钠,Res处理组给予相应剂量药物灌胃;阳性药组给予α-硫辛酸灌胃。每4 d称重1次并根据大鼠体重调整用药剂量,连续给予灌药12 d后处死大鼠,取大鼠脾脏转移至液氮中冷藏备用。另取脾脏固定在4%多聚甲醛中供病理学检查。
1.2.2整体模型建立以及关节炎指数和肿胀程度测定 造模后,每3 d用排水法测定大鼠左踝关节致炎前后容积变化并监测各组大鼠继发侧关节炎指数,病理评分分为4个等级:0分:正常;1分:踝关节红斑和轻微肿胀;2分:踝关节或手掌红斑,轻微肿胀;3分:踝关节或手掌红斑及中度肿胀;4分:踝关节严重肿胀,评分最高12分。
1.2.3HE染色及病理学损伤检测 取出固定的脾脏组织,脱水,包埋并切片,制备组织厚度为4 μm的切片。取各组切片经脱蜡、苏木精-伊红(HE)染色、封片处理后,镜下观察病理学损伤。
1.2.4组织匀浆氧化应激指标的检测 从液氮中冷冻的各组脾组织取样,制成组织匀浆。以14 000 r/min离心15 min并取上清液,根据试剂盒说明书检测MDA含量和SOD活力单位。
1.2.5免疫荧光检测大鼠脾脏中Nrf2蛋白的表达 取出固定的脾脏组织,脱水,包埋并切片,制备组织厚度为4 μm的切片。抗原修复液修复,3% H2O2灭活内源性过氧化物酶,封闭液封闭60 min,滴加Nrf2(1 ∶100)多克隆抗体,4 ℃孵育过夜。第2天,取出复温,用PBS冲洗3次,加入荧光二抗,在黑暗条件下孵育30 min,细胞用DAPI染色5~10 min并在荧光显微镜下拍照。
1.2.6Western blot法检测蛋白的表达 取冻存的脾脏组织,提取组织蛋白。根据BCA试剂盒测定各组的蛋白质含量,调整蛋白质浓度并加入上样缓冲液。SDS-PAGE电泳分离90 min;200 mA恒流2 h转至PVDF膜上。5%脱脂奶粉封闭1 h,PBST洗去封闭液,加入Nrf2、Keap1、MnSOD等一抗(1 ∶300),4 ℃孵育过夜。用PBST在摇床上洗涤后,将膜放入通用二抗中并在室温下在摇床上温育1 h。ECL显色并使用Image J软件进行分析。

2 结果
2.1大鼠AA模型的建立整体实验结果显示:相比对照组,模型组大鼠足趾肿胀程度明显增加,而Res处理组足趾肿胀程度减轻;关节炎评分结果显示:注射FCA 3 d后,大鼠足趾肿胀度即有明显升高,且随着造模时间延长,大鼠继发侧足趾肿胀度和关节炎指数均逐渐升高。第12天,模型组大鼠继发侧足趾肿胀度和关节炎指数与对照组比较差异有统计学意义(t=6.885,P<0.01;t=19.96,P<0.01)。上述结果表明AA大鼠模型建立成功。Res处理后的大鼠足趾肿胀度和关节炎指数降低,且随给药时间的延长逐渐降低。见图1。
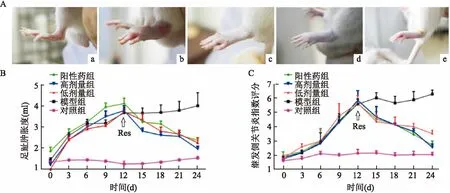
图1 SD大鼠AA关节炎模型的建立
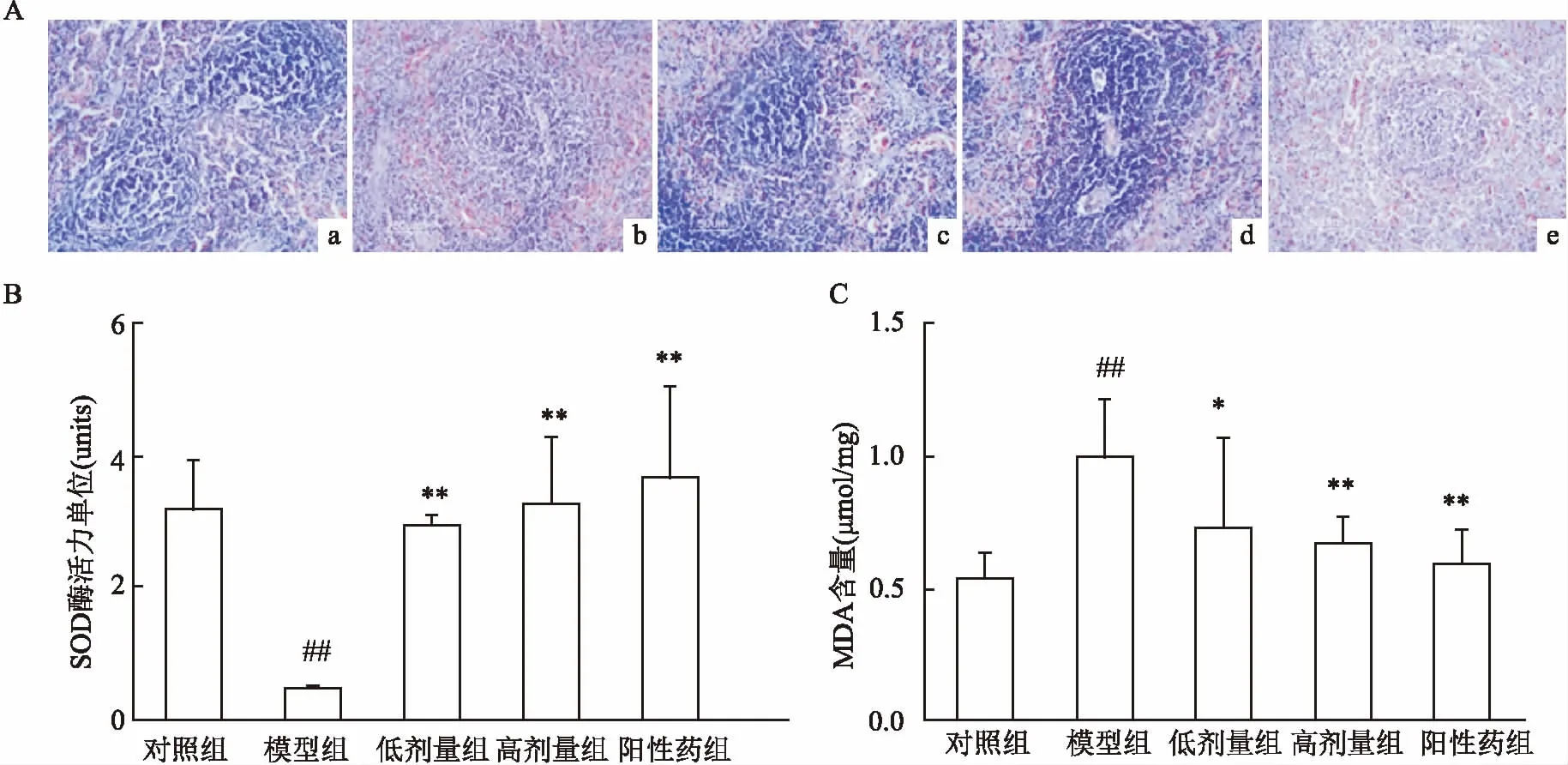
图2 AA大鼠脾脏损伤及氧化应激变化
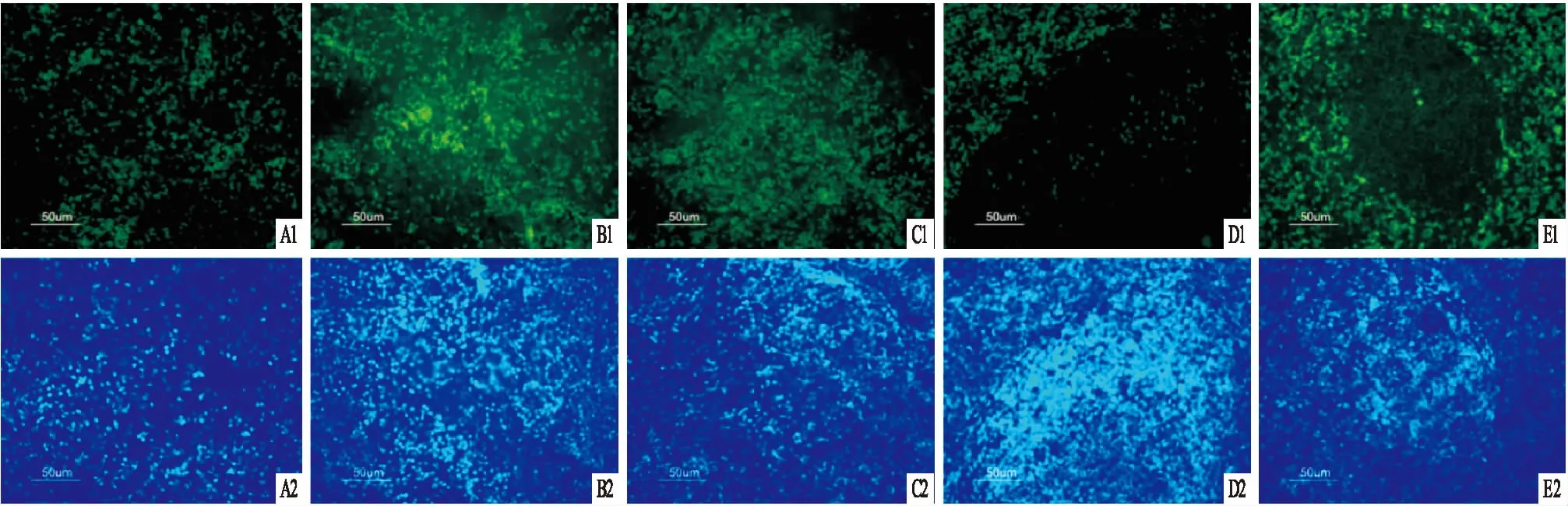
图3 大鼠脾脏中Nrf2蛋白的表达 免疫荧光×400
2.2AA大鼠脾脏组织存在损伤与氧化应激脾脏HE染色显示对照组脾脏组织形态较为清晰,可见白髓及红髓区。相比对照组,模型组脾组织结构模糊,红髓髓窦扩张,存在淤血,红髓髓索变窄。相比模型组,Res处理组脾脏形态结构有明显改善,红髓、白髓分界较清晰,红髓区可见少量淤血,生发中心较明显,细胞分布均匀。阳性药物治疗组效果更好。氧化应激指标检测显示,相比对照组,模型组大鼠脾脏匀浆中MDA含量明显增加(t=6.394,P<0.01),SOD酶的活力单位明显降低(t=5.044,P<0.01);相比模型组,Res和阳性药组大鼠脾脏MDA含量显著降低 (t=2.218,P<0.05;t=4.513,P<0.01;t=5.333,P<0.01),SOD酶的活力单位显著增高(t=26.210,P<0.01;t=3.600,P<0.01;t=3.103,P<0.01),但药物处理组间SOD酶的活力单位没有随药物浓度的增加而降低,各组数据差异无统计学意义(F=0.414,P>0.05)。见图2。
2.3免疫荧光检测大鼠脾脏中Nrf2蛋白表达情况免疫荧光结果显示,对照组大鼠脾脏Nrf2蛋白表达较少,模型组大鼠脾脏Nrf2 蛋白表达显著增加;相比模型组,Res和阳性药组Nrf2蛋白表达减少。在Res和阳性药组,相比于周围红髓,脾组织的淋巴小结Nrf2蛋白表达较弱,而红髓处免疫荧光明显增强,见图3。
2.4Westernblot测定大鼠脾脏中氧化应激相关蛋白Western blot结果显示,模型组脾脏相比对照组,其蛋白Nrf2(t=7.159,P<0.01)和MnSOD(t=6.850,P<0.01)的表达增加,Keap1(t=16.670,P<0.01)表达降低。灰度比值半定量分析表明,相比模型组大鼠,Res高剂量组脾脏组织中Keap1(t=10.240,P<0.01)、MnSOD(t=6.217,P<0.01)、Nrf2(t=12.660,P<0.01)差异有统计学意义,各浓度Res处理组间表达差异无统计学意义,相比模型组,阳性药组Nrf2表达降低,也呈下降趋势,Keap1、MnSOD表达增加。见图4。
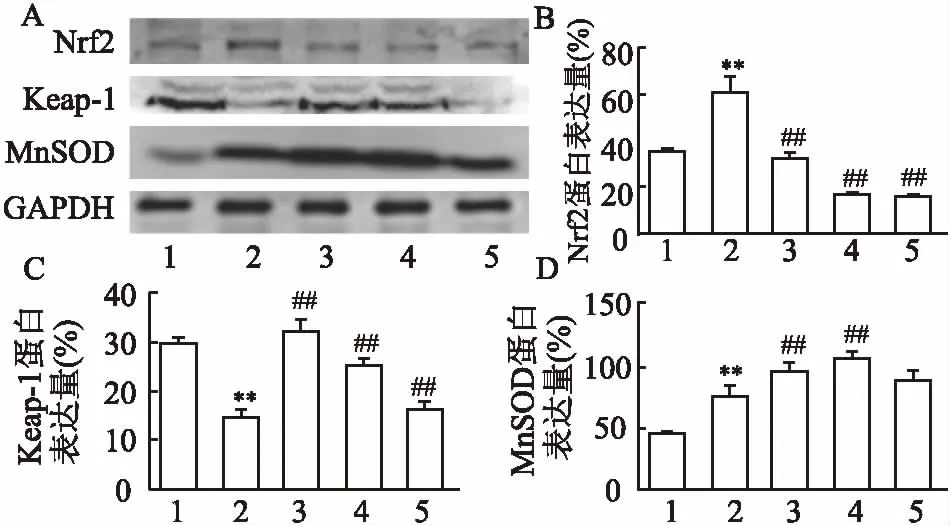
图4 Western blot测定大鼠脾脏组织匀浆
3 讨论
本研究采用FCA制备AA模型,FCA诱导炎症后的病理变化与RA较为相近[7]。研究[8]表明,AA大鼠滑膜呈现炎细胞浸润,关节部位表现为关节囊肿胀或粘连,病理学表现为滑膜细胞异常增生,血管翳形成及软骨和骨破坏。本研究AA大鼠在致炎后的7~12 d出现关节肿胀程度升高,炎症进一步发展,踝关节肿胀程度及关节炎指数证明AA模型建立成功,HE染色结果表明Res能够减轻脾脏的病理损伤。此外,RA可逐渐累及其他组织脏器,如心、肝、脾等,表现为多系统、多脏器受损。
Res是虎杖的一种提取物,具有抗炎和抗脂质过氧化等生物学作用[9]。本研究在AA大鼠基础上观察脾脏的病变特点。脾脏损伤主要表现为脾组织结构模糊、红髓髓窦扩张淤血等。相比模型组,Res和阳性药组脾组织的病理学变化减轻,大鼠脾脏组织匀浆检测中,MDA含量的降低和SOD活力单位的升高表明大鼠脾脏的抗氧化应激增强,证实了Res的调节作用。
Keap1-Nrf2/ARE通路是氧化应激反应中的关键通路,其中Nrf2为机体降低活性氧、减轻氧化应激重要转录因子,Keap1是调节Nrf2活性的细胞抗氧化途径的调节蛋白。正常情况下Nrf2在胞质中与抑制因子Keap1结合,处于失活状态,无法进入细胞核发挥转录活性,当受到ROS刺激时,Keap1构象改变后与Nrf2 解离[10]。激活的Nrf2进入细胞核并与小Maf蛋白形成异源二聚体,其与ARE结合并促进下游靶基因的表达,介导一系列抗氧化应激酶的产生,如MnSOD、血红素氧合酶1(HO-1)等,提高机体抗氧化能力[11]。在氧化还原平衡恢复后Nrf2返回胞质中,经泛素-蛋白酶体途径降解或通过负反馈调节使其消耗后维持正常水平[12]。已有研究[8]表明RA患者体内存在氧化应激,但关于Keap1-Nrf2/ARE通路在RA发生发展中影响的研究尚少。
Western blot结果显示,AA大鼠脾脏组织中Nrf2和MnSOD的表达显著增加,处于高氧化应激状态,Keap1-Nrf2/ARE通路异常激活。相比对照组,模型组脾脏组织Keap1蛋白表达明显减少,对Nrf2的抑制能力减弱。Nrf2和MnSOD表达增加,表明脾脏处于氧化应激状态,过度激活 Keap1- Nrf2/ARE通路会加重脾脏中的氧化应激。给予Res处理后,Nrf2蛋白表达减少,呈下降趋势,Keap1和MnSOD表达增加,Keap1大量表达导致从Keap1解离的Nrf2减少,进而抑制Keap1-Nrf2/ARE通路过度激活,起到对脾脏组织的保护作用[13]。而有研究[14]则表明,Res可上调Nrf2的表达。本研究免疫荧光结果显示,相比对照组,模型组大鼠脾脏中Nrf2蛋白表达明显增加,表明模型组脾脏组织存在Nrf2过度激活。相比模型组,Res和阳性药组Nrf2蛋白表达减弱,氧化应激程度减轻。值得关注的是,在Res和阳性药组中,相比于周围红髓,白髓淋巴小结Nrf2蛋白表达明显较弱,提示和红髓相比,白髓氧化应激程度较轻。白髓主要由B淋巴细胞组成,而红髓主要含有大量T淋巴细胞,Th细胞的免疫功能障碍在RA发病机制中起重要作用,B淋巴细胞通过递呈抗原、产生自身抗体和分泌细胞因子等与RA发生发展密切相关[15]。免疫荧光结果提示Res可能通过调节淋巴细胞及相关因子的表达来减轻AA大鼠脾脏损伤。
综上所述,AA大鼠存在脾脏功能的受损,Res可减轻AA大鼠病理损伤,同时改善其脾脏功能,其机制可能与调节Keap1-Nrf2/ARE信号通路异常激活,下调MDA水平,上调抗氧化蛋白MnSOD表达有关。此外,Res通过何种方式来降低Nrf2的表达,此方式通过影响哪些物质降低Nrf2的表达,Res对RA的调节与淋巴细胞及相关细胞因子存在何种关系,这些问题都有待进一步研究。

