结肠癌组织中microRNA表达谱的变化
郑俊俊,毛玉娣,汪朝靓,殷 实,王 华
在全球癌症相关死亡原因中,结肠癌排第四位[1],结肠癌形成是一个复杂缓慢的过程,甚至可达20年之久。随着早期诊断技术不断发展,在过去的20年中,虽然结肠癌的死亡率已明显下降,但是发生率仍居高不下[2],并且缺乏新的治疗手段。研究[3-4]表明,20%~30%的结肠癌患者具有遗传突变,其中基因APC和TP53在癌前病变或腺瘤的形成中发挥着重要作用,而非编码基因目前在人类疾病与肿瘤中的作用受到广泛关注,其中微小RNA(microRNA,miRNA)或其涉及的信号通路,可为结肠癌的诊治和预防提供新的靶点和策略。miRNA是指长度为21~23个核苷酸的内生性非编码小分子单链RNA,主要通过调节转录因子在转录及转后水平调节基因的表达,在生理病理学过程中发挥着广泛的作用[5]。该文应用高通量基因芯片技术,研究结肠癌中miRNA表达谱的变化,并且通过生物信息学分析基因间的相互作用及所涉及的生物过程和信号通路。
1 材料与方法
1.1病例资料临床标本均来自安徽医科大学附属安徽省立医院内镜中心,所有患者签署知情同意书,项目实施由安徽医科大学附属省立医院伦理委员会批准。包括5例结肠癌组织和5例癌旁正常组织,癌旁组织选取距肿瘤边缘至少大于5 cm,并且无肿瘤细胞浸润,标本的诊断均符合病理学诊断标准,每对结肠癌组织和癌旁正常组织来源同一名患者。临床标本的采集来自于47~73(61±12.1)岁的男性患者,所有的结肠癌患者为初诊未接受任何治疗包括手术及放化疗。电子结肠镜下夹取标本后立即放入RNA later溶液(美国Thermo Fisher公司)中,防止RNA降解,4 ℃过夜,-20 ℃过度后储存于-80 ℃冰箱中。
1.2总RNA的提取临床标本中总RNA的提取使用TRIzol试剂(美国Invitrogen公司),对总RNA使用mirVanaTMmiRNA Isolation Kit(AM1561,美国ABI公司)进行纯化。琼脂糖凝胶电泳用来检测RNA完整性。分光光度法(Nanodrop 2000,Thermo Scientific公司)用来检测RNA的纯度与总量,要求A260/280≥1.80并且总量≥1 μg。
1.3使用基因芯片检测基因表达的变化提取的总RNA先孵育加尾,然后使用FlashTag标记试剂盒(美国Genisphere 公司)进行生物素标记miRNA,与 Affymetrix miRNA4.0芯片进行杂交,然后进行基因芯片清洗染色和扫描,最后使用AGCC软件(affymetrix® geneChip® command console® software)将芯片的荧光扫描图像保存成.DAT文件以待分析。此步由北京博奥生物有限公司辅助完成。
1.4靶基因的预测miRNA靶基因预测基于miRWalk2.0 (http://mirwalk.umm.uni-heidelberg.de) 网站,此网站给出了12种miRNA靶基因预测程序的预测结果,程序分别为miRWalk、miRDB4.0、DIANA-microTv4.0、miRanda-rel2010、mirBridge、 miRmap、miRNAMap、PicTar2、PITA、RNA22v2、RNAhybrid2.1和Targetscan6.2。结果选择至少被6种软件预测到的基因。
1.5GO富集和KEGG信号通路分析GO(gene ontology)富集分析可以整合生物信息学数据库中大量的资源,主要包括生物过程、分子功能、细胞组分三个独立的体系。KEGG (kyoto encyclopedia of genes and genomes) 信号通路和GO分析用来探索靶基因参与的生物学过程和涉及的信号通路。Cytoscape V3.2.1软件用来解读差异性基因相关的信号通路及功能,显著性的检验水准为α=0.05。
1.6统计学处理Agilent Feature Extraction软件用于处理基因芯片扫描图得到原始数据,GeneSpring 软件将原始数据进行归一化分析并以Excel格式输出数据。利用SAM(significance analysis of microarray)R程序包分析差异基因,差异基因的筛选标准是:P<0.05 且变化倍数(fold change,FC)≥2或≤0.5;GraphPad Prism 6 软件用于图形展示。
2 结果
2.1结肠癌中miRNA表达谱的变化本研究收集了5例结肠癌组织和5例癌旁正常结肠组织使用高通量基因芯片技术进行基因检测。结果显示,与正常癌旁组织相比,在结肠癌组织中高表达的miRNA有22个;相反,在结肠癌组织中低表达的miRNA有51个(筛选标准:FC>2且校正后P<0.05为差异有统计学意义)。同时,火山图和散点图可更加清析直观的显示差异性表达的miRNA的数量,见图1。散点图直观显示差异性表达的miRNA的数量;火山图以FC的log2为横轴,以校正后P值 的lg值负数为纵轴,分析全部检测miRNA的差异。两图中红色标记的miRNA有22个,表示在结肠癌中上调。绿色标记的miRNA有51个,表示在结肠癌下调。黑色标记的miRNA表示变化无统计学意义。
2.2结肠癌组织中变化最显著的miRNA通过Affymetrix miRNA4.0芯片筛选,在结肠癌组织中异常表达的miRNA共有73个,其中变化最为显著的miRNA,如在结肠癌组织高表达的hsa-miR-183-5p、hsa-miR-1247-5p、hsa-miR-552-3p、hsa-miR-7-5p、hsa-miR-224-5p、hsa-miR-183-3p、hsa-miR-182-5p等,结肠癌组织低表达的如hsa-miR-99a-5p、hsa-miR-133a-3p、hsa-miR-139-5p、hsa-miR-1、hsa-miR-143-5p、hsa-miR-149-5p、hsa-miR-30a-3p、hsa-mir-139等,部分miRNA的表达信息见表1。此外,为了整体展示miRNA基因表达谱的变化,Circos图以基因位置为基础展示差异基因的差异程度,见图2,图中红色表示上调差异基因,绿色表示下调差异基因,图中柱的长度表示差异基因的倍数,柱越长表示差异倍数越大。
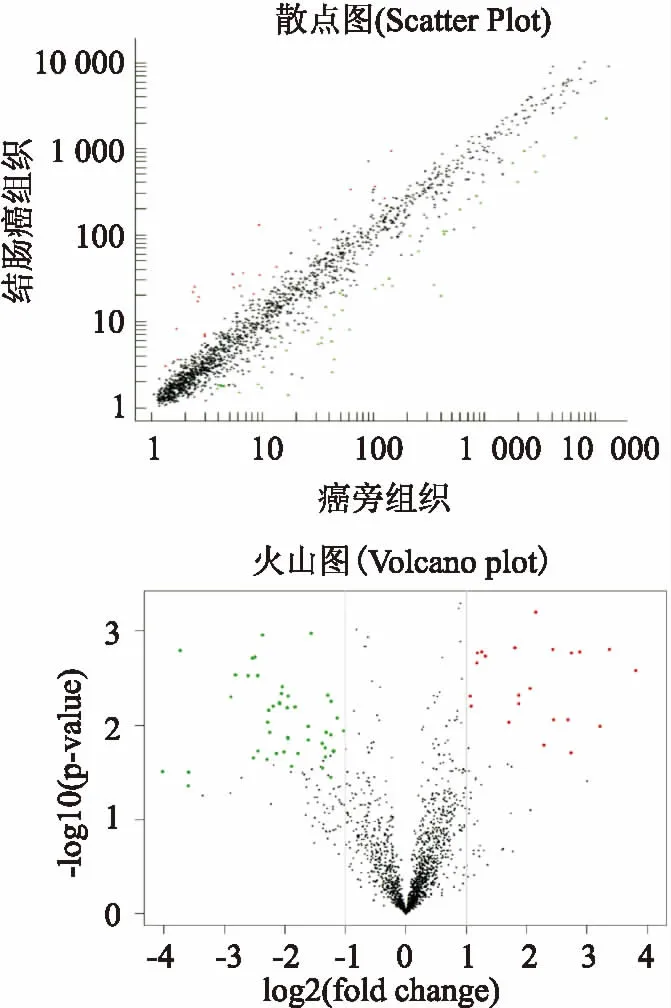
图1 全部检测基因散点图和火山图差异比较
2.3靶基因预测分析基于miRWalk2.0网站,本次研究对差异性表达的miRNA进行靶基因预测分析。结果表明,筛选出的miRNAs可调节多种结肠癌相关基因,如miR-622可调节转化生长因子-β(transforming growth factor-β,TGF-β)、TP53、KARS、WNT、SMAD4等靶基因的表达,miR-125b-5p可调节信号传导及转录激活因子3(signal transducer and activators of transcription 3,STAT3)、TP53、APC的表达;而APC同时是miR-125b-5p、miR-30a-5p、miR-149-5p、 miR-18a-5p、 miR-182-5p、miR-422a的靶基因,同样,WNT2/3受miR -1、miR-183-5p、 miR -7-5p的共同调节。所以,异常表达的miRNA与靶基因组成基因网络图,见图3,展示了部分异常表达miRNA与靶基因的关系。
2.4靶基因GO富集分析本次研究对这些基因进行了GO富集分析,GO富集分析是生物信息学研究中非常重要的工具。以P<0.001为检验标准,本研究共筛选出817个富集的生物过程及每个生物过程中所包含的差异性表达的基因。其中前30个富集的生物学过程包括细胞通讯调控、生物过程的正向调节、蛋白质修饰过程、高分子代谢过程的调控、结构形态改变等生物学过程。见图4。直观的显示靶基因与富集的生物过程的关联程度。

表1 结肠癌中异常表达的miRNA
2.5靶基因涉及的KEGG信号通路分析本次研究对靶基因进行了KEGG信号通路分析。结果显示,在KEGG PATHWAY数据库中,共筛选出127条信号通路(以P<0.05为检验标准),如Wnt信号通路、癌症相关KEGG通路、翻译后蛋白质修饰、FGFR信号通路、RAS信号通路、ERBB4信号转导、TP53转录调控、PI3K-Akt信号通路、Hippo通路等。 Pathway富集分析气泡图见图5(图中所示气泡大小表示靶基因注释到此功能条目的基因数目,颜色对应富集分析结果中P值)。Top图见图6,总结了前30个差异性最为显著的信号通路。
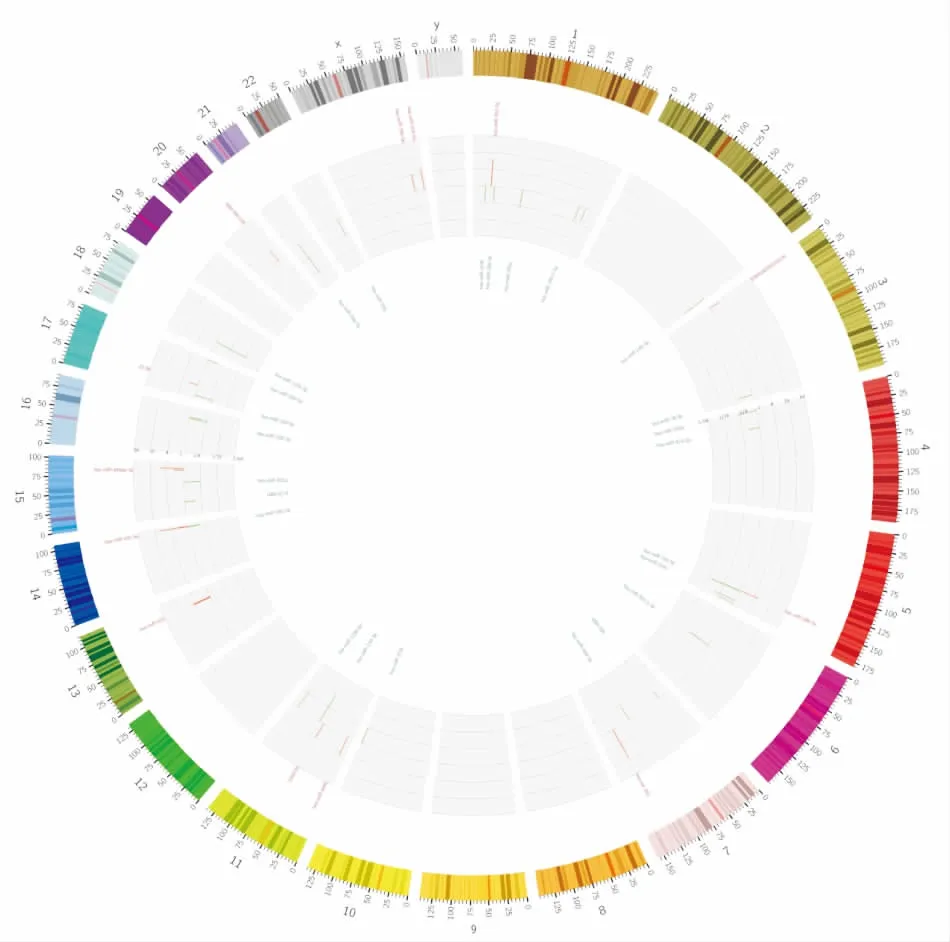
图2 Circos图
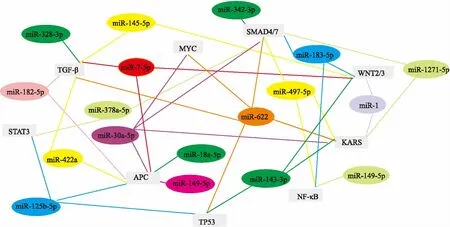
图3 miRNA与靶基因网络图
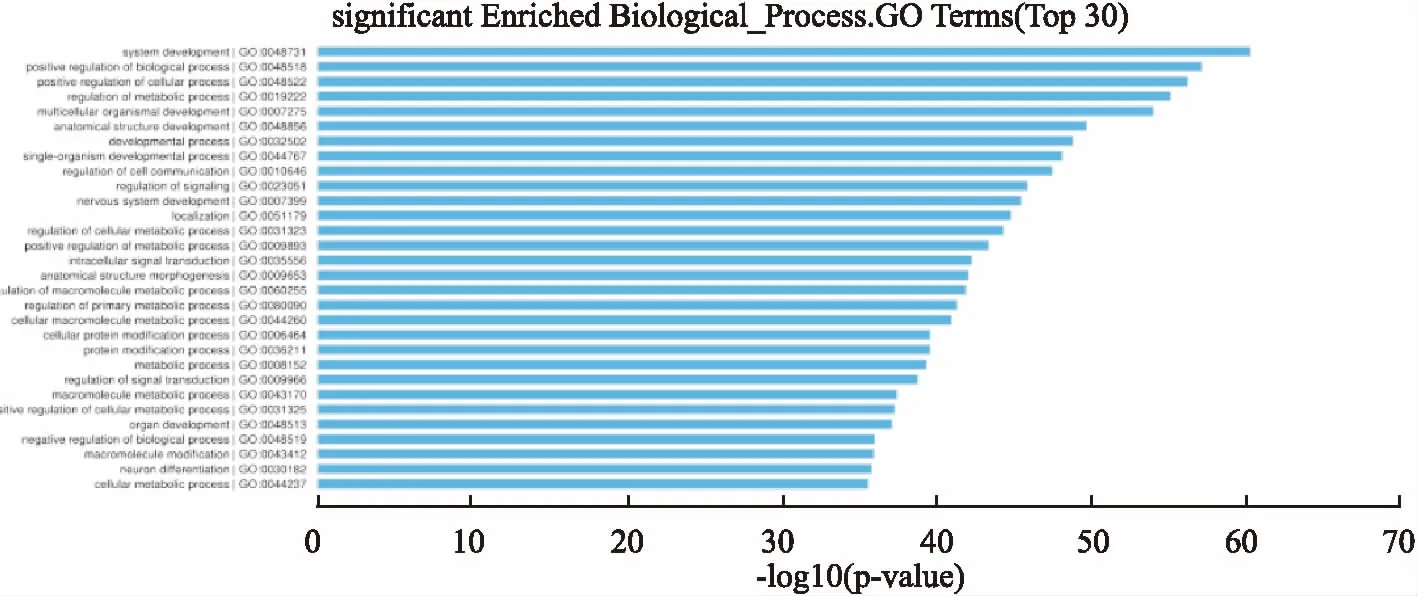
图4 GO分析显示差异性表达的基因富集最显著的前30个生物过程
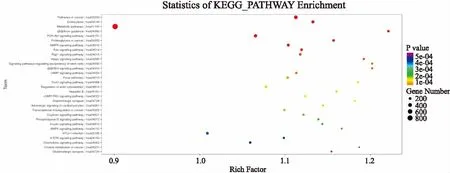
图5 Pathway富集分析气泡图
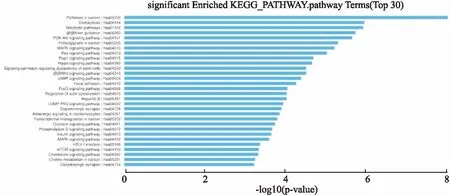
图6 靶基因富集最明显的30条信号通路
3 讨论
在我国,结肠癌的发病率逐年增加。2015年,我国结肠癌发病率由70年代的12/10万上升到56/10万,年均增长率为4.2%,明显高于国际水平。结肠癌通常需手术切除肿瘤组织、化疗和靶向治疗,目前新的靶向药物主要是针对肿瘤血管生成的内皮生长因子(vascular endothelial growth factor,VEGF)及受体(vascular endothelial growth factor receptor,VEGFR)或表皮生长因子受体(epidermal growth factor receptor,EGFR)等[6],但效果欠佳,约40%的病例对EGFR抑制剂产生耐药[7],故寻找新的治疗靶点至关重要。
结肠癌的发生与KRAS、BRAF、TP53、APC等基因突变有重要的关系。近年来,miRNA与结肠癌常见突变基因的相互作用备受关注,并且在结肠的发生发展过程、临床特征以及耐药等方面中发挥重要作用。例如,在结肠癌组织中高表达的hsa-miR-183-5p和低表达的hsa-miR-125b-5p[8-9]等。本研究共筛选出73个差异性表达的miRNA并对其进行总结。其中具有抑癌作用的miR-1已被证明参与到多种肿瘤中[10],本研究表明其在结肠癌组织中低表达,靶基因预测结果显示其可调节WNT3以及KRAS基因,后两者被证明可与miRNA相互作用参与结肠癌的发生[11]。这些基因在结肠癌中的表达情况与本研究基因芯片检测的结果一致,说明它们在结肠癌的生物学过程中发挥重要作用。
此外,本次研究仍发现了一些在结肠癌中未见报道的miRNA基因。基因芯片结果显示在结肠癌组织中高表达的hsa-miR-183-3p、hsa-miR-224-5p均未见有关报道,在结肠癌组织中低表达的miR-99a-5p在其他肿瘤中的作用已被报道[12],并且可作为胃癌生物学标志物[13],但在结肠癌中尚未见报道,本研究靶基因预测发现其可能是通过调控发挥抑癌作用。这些肿瘤相关基因为结肠癌的发病分子机制的研究指出新的方向。
miRNA通过调控编码基因的表达发挥作用,故对差异性表达的miRNA进行靶基因预测至关重要。结果显示差异性表达的miRNA可调控多种与结肠癌相关的蛋白编码基因。例如,Wnt信号转导失调和APC基因突变失活是大肠癌最常见的分子机制,约发生在75%的大肠癌中[14],靶基因分析显示miR-1、-125b-5p、-30a-5p、-7-5p、-183-5p以APC或WNT为作用靶点。此外多项报道表明在结肠癌TGF-β和促癌基因(proto-oncogene,MYC)可与miRNA相互作用[15],本研究显示miR-622可同时调控TGF-β、MYC基因,这值得引起关注。
另外,本研究针对靶基因所表示的生理意义进行了生物信息学分析。许多miRNA充当Wnt通路的调节因子在信号级联的多个水平上对其进行调控,如miR-34a/b/c 可直接作用和抑制Wnt信号通路的效应分子,包括WNT1、WNT3、LRP6、β-catenin等,从而抑制WNT信号通路。本研究提供了在结肠癌中宏观miRNA表达谱的变化,将为今后的研究提供重要的参考依据。并且这些差异性表达的miRNA可能与结肠癌的发病机制和临床特征相关,但是仍然需要更多的样本和实验进一步验证。
总之,本次研究在结肠癌筛选出73个差异性表达的miRNA,并描述了其所调控的靶基因、富集的生物过程和信号通路。这将对探讨结肠癌发病机制,寻找早期诊断和预后标志物,扩展治疗策略提供新的视野。

