叶底珠抑菌活性内生真菌的筛选及鉴定
赵名君,李俊南,曹 森,孙总政,高 天,杜 文,,孙景宽,于 江,伊梦洁,陈万浩
(1.滨州学院 生物与环境工程学院,山东省黄河三角洲野生植物资源开发利用工程技术研究中心,山东 滨州 256600;2.滨州学院 山东省黄河三角洲生态环境重点实验室,山东 滨州 256600;3.贵阳中医学院 基础医学院,贵州 贵阳 550000)
叶底珠(Securinegasuffruticosa(Pall.) Rehd)为大戟科叶底珠属植物,别名一叶荻、狗杏条、黄恨子、懒汉菜等[1]。叶底珠高茎丛生,多分枝,是能够在干旱荒漠区生长,耐干旱贫瘠的一种重要固沙灌木[2]。叶底珠富含一叶萩型生物碱类化合物、黄酮、芦丁、鞣质、酚类化合物及多种氨基酸等有效化学成分[3-4]。叶底珠通常根部入药,具有活血舒筋、健脾益肾、祛风活血等功效,用于治疗风湿腰痛、四肢麻木和小儿疳积等疾病[2,5],对神经衰弱、面部神经麻痹、小儿麻痹后遗症、眩晕、耳聋、神经衰弱、嗜睡症、阳痿、急性肝损伤等疾病也有一定的疗效[4,6-10]。叶底珠具有很好的开发与应用价值,市场的需求量高。为了保护野生资源,寻找能产生叶底珠活性物质和药理活性相似的内生真菌是一个值得研究的方法。
植物内生真菌是指存在于植物体内,但不引起植物病害的一类真菌[11]。内生真菌与宿主植物具有非常复杂的关系,它能够产生促进植物生长的营养和激素,也能够产生帮助宿主抵御病害的物质,还能够产生众多的药用活性组分以及多种具有生物活性的产物等[11-12]。内生真菌分布广泛,种类丰富,据统计真菌的新型天然产物约一半来源于内生真菌[13],其中包括大量的具有抗菌活性的天然化合物[14-15]。目前,对叶底珠内生真菌抗真菌细菌活性的研究国内外尚未见报道。本课题组采集了叶底珠,对其根部、茎部和叶部的内生真菌进行了分离纯化,此外利用8种病原菌为指示剂,对其抗菌活性进行了初步研究,并结合形态学和分子生物学手段,对具有抑菌活性的内生真菌的分类地位进行了鉴定,为进一步寻找抗菌活性成分奠定基础。
1 材料与方法
1.1 材料与试剂
供试叶底珠Securinegasuffruticosa(Pall.) Rehd 健康植株采自黄河三角洲贝壳堤岛,经滨州学院夏江宝教授鉴定。供试病原菌:金黄色葡萄球菌Staphyloccocusaureus,大肠埃希菌Escherichiacoli, 铜绿假单胞菌Pseudomonasaeruginosa,粪肠球菌Enterococcusfaecalis,白色念珠菌Candidaalbicans,小麦赤霉病菌Fusariumgraminerum,立枯丝核菌Rhizoctoniasolani,辣椒炭疽病菌Colletotrichumcapsici由滨州学院生物制药教研室和贵州大学生化营养研究所提供。DNA 提取试剂盒、2×Pfu PCR 预混液、DNA-Marker、引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGA TATGC-3') 购于生工生物工程(上海)股份有限公司。其余试剂均为分析纯。
1.2 内生真菌分离与纯化
采集新鲜健康的叶底珠完整植株,用无菌水冲洗干净,置于滤纸上自然风干,去腐叶。分别将叶底珠的根、茎、叶等切成约0.5 cm的小段,置于无菌的培养皿中。按下列程序进行表面消毒[15]:75%乙醇漂洗约3 min,无菌水冲洗5次,0.1%升汞消毒约3 min,无菌水冲洗5次,用无菌滤纸吸取多余水分,无菌刀片将材料切成0.2 cm×0.2 cm 的小块段。将上述组织块分别置于加有青霉素和链霉素的PDA培养基中,每皿3块,26 ℃恒温培养,同时将上述经表面灭菌的材料不做任何处理直接种植于PDA 培养基中,26 ℃培养,检查表面消毒是否彻底。培养3~10 d后及时采用尖端菌丝挑取法,挑取形态不同的菌丝或菌落移种到新鲜PDA培养基上进行纯化,纯化后转接到斜面上保存备用。
1.3 抑菌实验
挑取经活化的内生真菌菌丝或孢子接种于PDA 液体培养基中,于26 ℃、120 r/min 培养7 d;5 000 r/min 离心20 min,收集菌丝体和发酵液。菌丝体先经超声破碎,再把经95%乙醇浸提24 h后减压浓缩成醇浸膏,用适量无菌水45 ℃温浸,充分混匀制成菌体待测溶液。发酵液未经浓缩直接进行抑菌实验。采用滤纸片扩散法:将约 1×108cfu/mL指示细菌菌液(或真菌的孢子)涂布于牛肉膏蛋白胨平板(或PDA培养基,白色念珠菌采用沙氏培养基),在适当位置贴上己灭菌的滤纸片(Φ=6 mm),然后分别吸取发酵液和菌体待测溶液20 μL 置于滤纸片上,无菌水做对照,每个样品重复3 次。细菌在37 ℃培养16~24 h,白色念珠菌在28 ℃培养36~48 h,其他真菌在28 ℃恒温培养96~108h, 观察菌体生长情况,并测量抑菌圈直径。
1.4 内生真菌的鉴定
形态鉴定:用接种针挑取少量菌丝点植在查氏培养基的平板的中心位置,然后于28 ℃ 培养7或14 d进行观察。观察菌落颜色、大小、菌落纹饰、质地、边缘;分生孢子形态及大小[16]。
分子鉴定:取内生真菌发酵后离心,取菌丝冷冻干燥。取100mg 菌丝于2 mL EP 管内按照DNA 提取试剂盒说明书的步骤采用CTAB 法提取内生真菌DNA。按照25μL体系,加入12.5μL 2×Pfu PCR Mix,0.5μL ITS1,0.5μL ITS4,1.5μL DNA, 10μL超纯水。以ITS1 和ITS4 进行PCR 反应,95 ℃、5 min,95℃、45 s,52 ℃、30 s,72 ℃、3 min,35 个循环,72 ℃、15 min 扩增ITS1-5.8S rDNA-ITS2 序列。对PCR 反应产物利用1%的凝胶于120 V 电泳30 min,根据Marker 判断是否存在400~800 bp 大小片段。对于成功扩增目的片段的样品送交生工生物工程(上海)股份有限公司进行电泳切胶纯化测序。根据测序结果,在GenBank 数据库中进行BLAST 比对,搜索同源序列。尽量选取有代表性菌株序列作进一步的分析。首先采用Clustal X 1.81 将序列对齐,利用MEGA 5.2 软件进行系统发育分析,并以自展法进行检测,共循环1 000次,构建邻接树。将菌株D11和G11的ITS 序列提交至GenBank 数据库,登录号为 MG548565,MG548557。
采用分离率(isolation rate,IR)定量描述叶底珠内生真菌各菌株在叶底珠组织中的丰富度、分布偏好性、组成结构。分离率是分离获得的菌株数与分离的组织块数的比率,以百分率表示[17]。
2 结果与分析
2.1 叶底珠内生真菌的分离与培养
采用组织块法从3株叶底珠的根、茎和叶中共分离得到21、12、8株内生真菌(表1),分离率分别为58.33%、48.00%、47.13%,平均分离率为47.98%。可见叶底珠根部内生真菌的数量明显多于叶部内生真菌,表明内生真菌的分布具有组织偏好性。此外,空白对照培养基上未长出菌落,说明无环境污染,并且接触表面消毒后材料表面的培养基上也无菌落长出,说明消毒完全,表明所得菌株为来自植物体内真菌。

表1 叶底珠的根茎叶组织内生真菌分离菌株数和分离率Table 1 Isolation rate of endophytic fungi from roots,stems and leaves of S.suffruticosa species or varieties
通过在PDA培养基上培养7天后,观察各内生真菌的菌落形态和显微结构可以看出,叶底珠的内生真菌在生长速度、菌落形态和显微结构上存在较多差异,具有较为丰富的形态多样性,表明分离到菌株的多样性和其分类地位的不同。而且产色素方面也存在较多差异,有产乳白色、深褐色、紫红色、棕黄色等,而部分真菌仅为白色。有部分真菌观察生长有孢子囊和孢子,大部分真菌未观察到孢子,可能为不产孢真菌,可能与培养条件有关。
2.2 叶底珠内生真菌抗菌活性

表2 叶底珠内生真菌对的抗菌活性Table 2 Antimicrobial activity of fungal endophytes isolated from S.suffruticosa
用分离到的41株内生真菌进行抑菌试验,其中有2株菌G1和D1的菌体待测溶液和发酵液对白色念珠菌的抑菌效果都比较明显,抑菌圈直径达到15 mm以上。又进一步将G1和D1的菌体待测溶液和发酵液,以金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌、粪肠球菌,小麦赤霉病菌、立枯丝核菌和辣椒炭疽病菌作为指示菌,进行抗菌活性测定,结果显示内生真菌对多种指示菌具有明显抑制作用,表现出显著的抑菌广泛性,而且菌体待测溶液的效果好于发酵液,内生真菌G2和D1对细菌的抑制效果好于真菌。由表2可见,内生真菌菌株G11对金黄色葡萄球菌、粪肠球菌和小麦赤霉病菌的抑菌圈直径大于20 mm,菌株D11对大肠埃希菌和小麦赤霉病菌的抑菌圈直径大于20 mm,表现出相对较强的抑制活性,值得进一步研究。
判断标准:抑菌圈直径<10 mm为低敏,10~14 mm 为中敏,15~19 mm 为高敏,>20 mm 为极敏[18]。
2.3 内生真菌的鉴定
菌株G11分离自叶底珠的根。查氏固体培养基上菌落椭圆形,周围为白色菌丝,边缘整齐,背面呈浅黄色;菌丝有隔;查氏培养基上未见产孢结构。菌株D11分离自叶底珠的叶。查氏培养基培养菌落近圆形,颜色先由白色变成棕黄色,边缘不整齐,背面呈黄色;菌丝有隔;孢子呈圆形或椭圆形,棕黑色;有刚毛结构。
再采用Mega 5.2软件,用Neighbor-Joining(NJ) 法建立系统发育树的分析观察表明,通过分离筛选得到的菌株G11,与GenBank上下载的多株球毛壳菌Chaetomiumglobosum能很好地聚在一个进化分枝中,见图1,并有99%的支持率,结合培养特征,确定其为毛壳属的球毛壳菌Chaetomiumglobosum。菌株D11与GenBank上下载的多株枝细枝孢菌Cladosporiumramotenellum能很好地聚在一个进化分枝中,见图1,并有100%的支持率,结合培养特征,确定其为枝孢属的枝细枝孢菌Cladosporiumramotenellum。
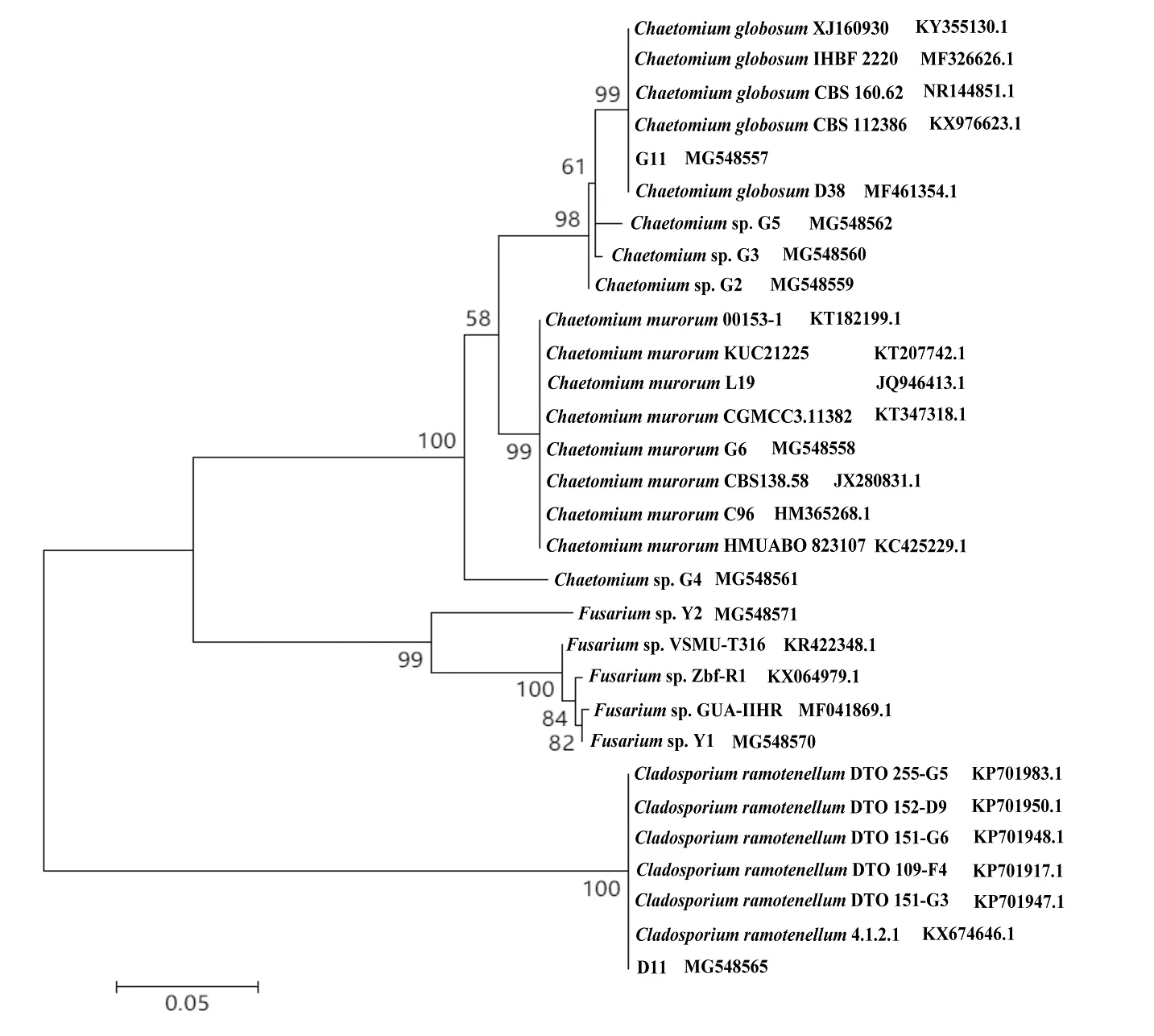
图1 系统发育树
3 讨论
内生真菌广泛存在于植物体内,其种类和数量与宿主植物种类、部位、生长状况,自然环境等密切相关。内生真菌对寄主具有一定的偏好性,寄主植物种类是决定内生真菌种群结构的重要因素之一,如座囊菌纲的格孢菌目是草本植物中较为普遍的内生真菌[19-20]。
本研究表明,从叶底珠根茎叶组织中分离获得了41株内生真菌,并具有多种的形态和活性特征,可见其内生真菌的数量多种类非常丰富。本课题组还研究发现叶底珠内生真菌中,毛壳属Chaetomium是叶底珠的优势属(未发表),而且在根、茎、叶中均有分布。毛壳属的菌株是常见的植物内生真菌,在枣树[21]和枸杞[22]等植物的内生真菌中也发现了毛壳属是优势属,在银杏[23]、温郁金[24]、玉米[25]甚至深海沉积物样品[26]中,都分离到过毛壳属的菌株,部分毛壳属的菌株还具有多种活性成分,常作为生防菌对植物病原菌具有很好的防治效果。传统药用植物白茅Imperatacylindrical中分离获得的一株内生菌球毛壳菌C.globosum能产生结构新颖和药理活性显著的化学成[27]。在侧柏内生真菌球毛壳菌C.globosumZH-32 的次生代谢物中分离鉴定出球毛壳菌素A,发现其对多种病原细菌及农业上危害严重的植物病原真菌具有强烈的抑制作用[28]。发现药用植物三七的内生菌C.globosum的代谢产物能抑制植物病原菌生长,具有抗氧化活性,还可以抑制乙酰胆碱酯酶[29]。枝孢属Cladosporium的菌株也是广泛存在于植物中的内生真菌,在越南槐、月季、康乃馨、玫瑰、山茶花和凤凰木中是优势菌群[30-31],在角果木[32]、山苍子[33]、蒜头果[34]等植物中都有发现,研究还发现角果木内生真菌C.cladosporioidesJG-12的活性代谢产物能抗菌,抑制乙酰胆碱酯酶活性以及抑制全齿复活线虫活性[32]。
本实验分离到41株内生真菌,其中21株来自根部,其中具有最佳抑菌活性的2 株菌株分别是Chaetomium属和Cladosporium属的真菌,而且对多种指示菌具有抑制作用,表现出广泛的抑菌性,所以内生真菌ChaetomiumglobosumG11和CladosporiumramotenellumD11的活性代谢产物有待分析、分离,将在新型抗菌、抗肿瘤、治疗神经衰弱药物的筛选方面具有较好的研究价值。内生真菌与植物长期共生,在一定程度上影响植物的生长发育,本研究发现内生真菌对植物病原真菌也具有一定的作用效果,表明内生真菌在提高药用植物培养繁殖,进行规模化生产上,具有良好的开发应用前景。

