电化学方法检测生乳中氯离子
,,,,,
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
氯化钠俗称食盐,无色立方结晶或细小结晶粉末,是一种生活中常用的调味品,过量摄入会造成人体细胞钾元素丢失和组织积水[1]。在牛奶中,掺杂氯化钠主要因为氯化钠是高密度物质,可以掩盖掺水后的理化改变,从而达到校正乳汁读数,增加比重效果[2-3]。生乳是乳制品质量控制的源头,其质量和安全直接影响乳制品的后续加工[4-5],掺盐生乳流入到乳品生产中,不仅影响乳制品的口感还会对人身体健康造成损害[6]。因此,为保证最终生产产品的质量,应对进厂生乳盐含量进行严格监控[7-9]。
国内外通常以氯离子含量为指标衡量生乳中食盐含量,氯离子常用测定方法是滴定法。GB5009.44-2016通过硝酸银和铬酸钾对牛乳酸提液进行滴定,以硝酸银的消耗量对牛乳中氯离子定量检测。但是,沉淀滴定法存在人为误差,且操作时间较长。除国标法外,徐茂蓉等[10]建立了一种毛细管电泳法测定牛乳中的氯离子含量,该方法分离效率高、分析速度快、样品用量少,弥补了毛细管电泳法测定牛乳中氯离子含量的空白。但是毛细管直径较细,易损坏,每次进样前和实验过程中均需要用各种试剂进行冲洗,操作繁杂,并且检测结果容易受到pH影响,对人员操作要求较高;黄丽等[11]利用在线渗析——离子色谱法检测了牛乳中的阴离子,该方法样品操作简单,准确度高。但是,离子色谱检测设备较昂贵,不易普及。因此,迫切需要建立一种快速、准确、操作简单、经济的检测方法。
电化学以其反应速度快、灵敏度高、成本低廉、适合在线监测等优点在食品安全检测领域发挥着越来越重要的作用[12-14]。银和氯离子有很强的反应活性,可以无需修饰利用电极自身的性质提高工作电极的针对性和灵敏性,降低了检测成本[15-17]。因此,本文以银电极为研究电极,采用循环伏安法对生乳氯离子进行检测,分析氯离子对银电极的电化学反应影响,以此为基础,建立了一种无需修饰工作电极即可检测氯离子含量的方法。
1 材料与方法
1.1 材料与仪器
生乳 由江西阳光乳业股份有限公司长山现代有机牧场提供,经GB5009.44-2016银量法测定氯离子含量为0.03 mol/L;氯化钠(AR) 天津市永大化学试剂有限公司;硫酸钠(AR)、氯化钾(AR) 天津风船化学试剂科技有限公司;糊精、葡萄糖 武汉远成共创科技有限公司;三氯乙酸(AR) 天津市大茂化学试剂厂;无水乙醇(AR) 上海振兴化工一厂;γ-Al2O3粉末、银电极、铂片电极 上海仙仁仪器仪表有限公司;Ag/AgCl参比电极 上海仪电科学仪器股份有限公司。
PHS-3C pH计 上海雷磁有限公司;CHI440C 电化学石英晶体微天平 上海辰华有限公司;TCL-15B高速离心机 上海安亭科学仪器厂;KQ-2200DP超声波清洗器 昆山市超声清洗仪器有限公司。
1.2 实验方法
1.2.1 电极预处理 银电极,在0.1 mol/L KCl溶液中采用双电位阶跃法(-0.6 V阶跃到+0.8 V,+0.8 V阶跃到-0.6 V),进行2次氧化还原处理,而后把电极用超纯水冲洗干净,氮气吹干备用。
1.2.2 测试方法 在室温条件下,以银电极为工作电极,铂片电极为辅助电极,Ag/AgCl电极为参比电极组装成测定回路,置于待测液中,对待测液进行循环伏安法扫描。循环伏安法初始条件:电位范围-0.65~0.4 V,扫描圈数20,扫描速率0.1 V/s,静置时间1 min。
1.2.3 氯离子存在下银电极电化学反应
1.2.3.1 氯离子测试液的制备 以1.0 mol/L的硫酸钠溶液作为电解质底液,向该电解质底液中加入氯化钠,分别制备了0.02、0.06、0.08、0.10、0.12 mol/L氯离子测试液;使用稀硫酸和稀氢氧化钠调节0.02 mol/L氯离子测试液的pH,制备了pH为3.8、4.6、5.4、6.2、7.0的0.02 mol/L氯离子测试液。所有溶液测试前均需通入超纯氮气除氧。
1.2.3.2 氯离子存在对银电极电化学信号的影响 以电位范围-0.65~0.40 V,扫描圈数20,扫描速率0.1 V/s,对加入0.02 mol/L氯化钠前后的硫酸钠溶液(1.0 mol/L)进行循环伏安扫描,研究氯离子存在对银电极电化学信号的影响。
1.2.3.3 扫描速率对银电极电化学信号的影响 固定电位范围-0.65~0.40 V,扫描圈数20,以不同扫描速率(0.01、0.1、0.2、0.3、0.4、0.5 V/s),对浓度为0.02 mol/L的氯离子测试液(电解质为1.0 mol/L的硫酸钠溶液)进行循环伏安法扫描,探讨扫描速率对银电极电化学反应的影响[18]。
对于准可逆反应参与反应的电子数n,可根据能特斯定律-氧化峰电位与还原峰电位之差,通过不同扫描速度的电位之差取平均值求得,遵循关系式:
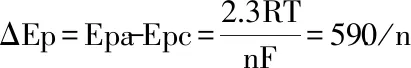
式(1)
式中:R是标准气体常数(8.314 J·K-1·mol-1),T是开尔文温度,n为电子转移数,F是法拉第常数(96487 C/mol),ΔEp是氧化还原峰的电位差。
1.2.3.4 pH对银电极电化学信号的影响 在初始参数下,对pH分别为3.8、4.6、5.4、6.2、7.0,浓度为0.02 mol/L的氯离子测试液进行循环伏安法扫描,探讨pH对银电极的电化学反应的影响[18]。
1.2.3.5 氯离子浓度对银电极电化学信号影响 在初始参数下,对浓度分别为0.02、0.06、0.08、0.10、0.12 mol/L的氯离子测试液进行循环伏安法扫描,探讨氯离子浓度对银电极的电化学反应的影响[18]。
1.2.4 掺盐乳样品中氯离子浓度的测定
1.2.4.1 掺盐乳样品的制备 实验前将冷藏保存的生乳放置至室温。在生乳中掺杂氯化钠,分别制备氯离子浓度为0.03、0.05、0.09、0.13、0.17、0.20 mol/L的掺杂乳样品。
取20 mL掺杂奶样品放入45 mL离心管中,并加入10 mL 10%的三氯乙酸溶液,同时用振荡器混匀1 min,促使蛋白质凝固。随后在10000 r/min条件下离心10 min去除脂肪和蛋白质,获取清澈液后加入1.0 mol/L Na2SO4,通入超纯氮气除氧后备用[18]。
1.2.4.2 掺盐乳中氯离子浓度的测定 以电位范围-0.65~0.40 V,扫描圈数20,扫描速率0.2 V/s,对1.2.4.1中的所有样品,逐一进行循环伏安法扫描,据此收集银电极在不同浓度氯化钠乳中的电化学信号。
1.2.4.3 线性范围及检出限 将1.2.4.2中各个样本的氧化、还原峰电流值进行线性回归分析,结合3Sb/m计算检出限[18]。
1.2.5 抗干扰实验 在0.02 mol/L氯离子测试液中加入20 g/L的糊精、20 g/L葡萄糖进行干扰试验。以电位范围-0.65~0.40 V,扫描圈数20,扫描速率0.0.2 V/s,对各个样本进行循环扫描,据此收集加入其它高密度物质后银电极的电化学信号。
1.2.6 实际生乳样品中氯离子浓度的测定 准确称取5份相同的生乳样品,用本文方法测定氯离子含量后,分别向生乳中加入0.015、0.030、0.045、0.060、0.075 mol/L氯化钠。再次使用本文方法测量掺杂乳,从而获得实际样品的回收率;并且使用GB5009.44-2016银量法测量掺杂乳,比较GB5009.44-2016银量法与本方法有无明显差异。每组试验重复5次,取平均值。
1.3 数据处理
将石英晶体微天平中的原始数据导入origin 8.0专业作图软件中绘制图形;通过SPSS 19(SPSS Inc.,Chicago,IL)对数据显著性差异进行分析。
2 结果与分析
2.1 氯离子对银电极电化学反应的影响
2.1.1 氯离子存在对银电极电化学信号的影响 在-0.65~0.40 V电位范围内,对加入氯离子前后的硫酸钠溶液进行循环伏安扫描,研究氯离子对银电极电化学反应的影响。角图(图1)为银电极在1.0 mol/L硫酸钠空白溶液的循环伏安扫描曲线,氧化还原峰电位分别为0.238、0.094 V(vs.Ag/AgCl),此反应对应着银电极自身的氧化还原[19-20]。当向空白溶液加入0.02 mol/L氯化钠后,在0.145、-0.037 V(vs.Ag/AgCl)左右出现了较大的氧化还原峰,且峰电流比1.0 mol/L硫酸钠溶液中引发的增大20倍,说明银电极在氯离子存在下发生了剧烈的电化学反应。

图1 银电极在0.02 mol/L氯离子测试液循环伏安图Fig.1 Cyclic voltammograms of silver electrode in the test solution with 0.02 mol/L chloride ions注:角图表示1.0 mol/L硫酸钠溶液的循环伏安图。
2.1.2 扫描速率对银电极电化学信号的影响 以不同的扫描速率于-0.65~0.40 V电位范围对0.02 mol/L氯离子测试液进行循环伏安法扫描,结果表明,氧化还原峰电流在0.01~0.5 V/s的扫描速率范围内随扫描速率呈现线性关系,线性方程为:Ipc(μA)=81.37v+188.53,R2=0.994;Ipa(μA)=-23.64v-81.31,R2=0.990。因此可认为银在电极表面的反应受动力学控制,同时可知此反应为准可逆过程。当改变扫描速率时,氧化峰电位正移,说明更难于被氧化,而还原峰电位负移,说明在电极表面的反应更难于被还原。将氧化峰电位与还原峰电位之差代入式(1),可得转移电子数约为1。
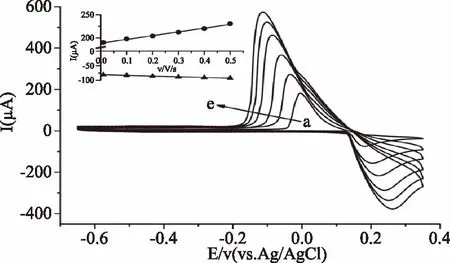
图2 银电极在不同扫描速率下循环伏安图Fig.2 Cyclic voltammograms of silver electrode at different scan rates注:a~e扫描速率分别为0.01、0.1、0.2、0.3、0.4、0.5 V/s;角图为峰电流与扫描速率的关系曲线图。
2.1.3 pH对银电极电化学信号的影响 在-0.65~0.40 V电位范围对不同pH条件下的0.02 mol/L 氯离子测试液进行循环伏安法扫描,发现氯离子测试液的pH在3.8~7.0上的范围变化时,银电极的氧化还原峰电位没有随pH呈现移动现象,说明该反应没有质子参与反应,pH对此电化学反应无影响。
2.1.4 氯离子浓度对银电极电化学信号的影响 在-0.65~0.40 V电位范围对不同浓度氯离子测试液进行循环伏安测定。当氯离子浓度增加时,氧化还原峰电流均提高,氧化峰电位仍然在0.145 V附近,而还原峰电位则产生了负移,说明当氯化钠浓度越高时,银在电极表面的还原反应更难于被还原,可逆性变差。
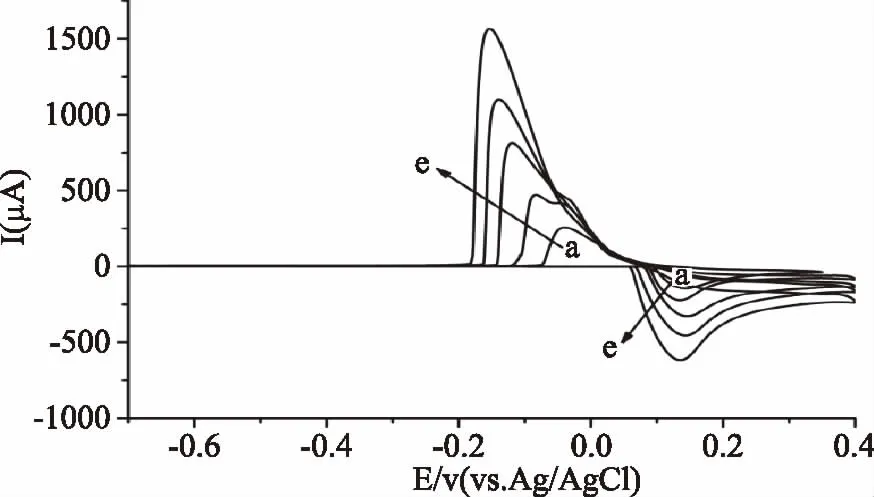
图3 在不同浓度氯化钠中银电极的循环伏安图Fig.3 Cyclic voltammograms of silver electrode in the test solution with different concentrations of chlorine ion注:a~e分别为0.02、0.06、0.08、0.10、0.12 mol/L的氯化钠测试液。
2.1.5 氯离子存在下银电极的反应机理 上述实验的结果表明,银在氯离子测试液中电化学反应为准可逆过程,且反应的电子数约为1,因此初步判断以硫酸钠为电解质,在较低浓度氯离子溶液中,银电极表面上的反应过程为:正向扫描时,Ag失去了电子被氧化后,与溶液中的氯离子结合生成氯化银沉淀;而负向扫描时,氯化银发生了还原反应。所以阳极反应可表示为:Ag+Cl-→AgCl↓+e-;阴极反应可表示为:AgCl+e-→Ag+Cl-[21]。
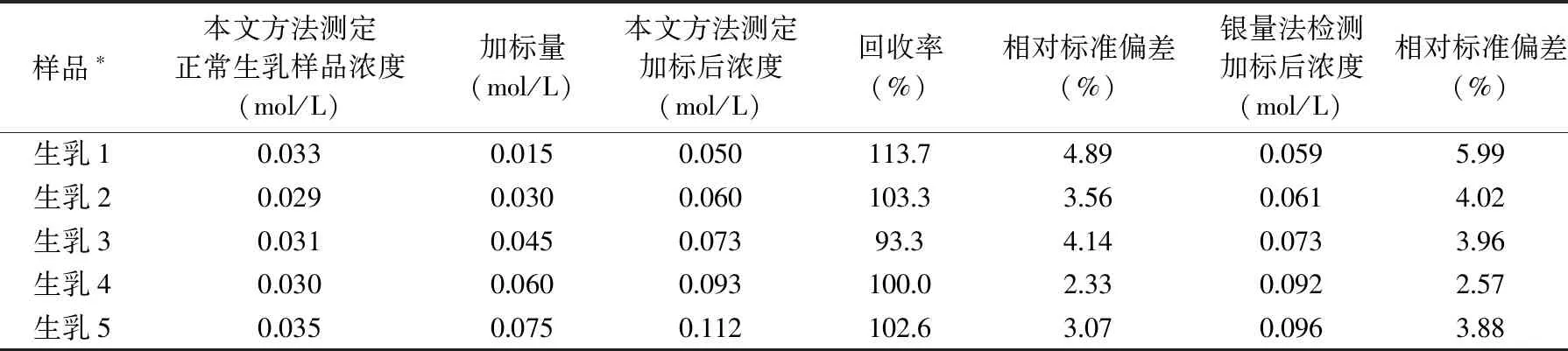
表2 生鲜乳样品中氯离子的加标回收率测定结果及与其他方法结果显著性比较(n=5)Table 2 Recovery rates of chloride ions in raw milk samples and significant comparison results of another method(n=5)
然而,当增大氯离子浓度时,氧化还原峰电流均提高,氧化峰电位仍然在0.145 V附近,而还原峰电位则产生了负移,说明当氯化钠浓度较高时,银在电极表面的还原反应更难于被还原,可逆性变差。
2.2 生乳中氯离子浓度的测定结果
2.2.1 掺盐乳中氯离子的浓度 将银电极依次对1.2.3中样品进行循环伏安扫描。结果显示,银电极出现一对与测试液中相似的氧化还原峰。氧化峰电位并无明显变化,但是还原峰电位随着氯离子的浓度增加而负移,并且氧化、还原峰电流均与氯离子浓度呈线性关系,因此可根据此现象来进行氯离子的定性和定量检测分析。
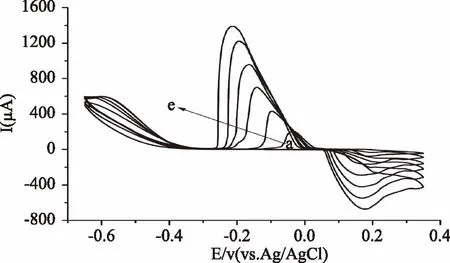
图4 银电极在含不同氯离子浓度生乳提取液中循环伏安图Fig.4 Cyclic voltammograms of the silver electrode in raw milk extracts with different concentrations of chloride ion注:a~e为在乳中氯化钠浓度分别为 0.03、0.05、0.09、0.13、0.17、0.21 mol/L。
2.2.2 线性范围与检出限 生乳氯离子浓度范围为0.03~0.21 mol/L时,氧化峰、还原峰电流与氯离子浓度呈线性关系,线性方程为Ipa(μA)=-3729.5 C(mol/L)+21.462,R2=0.990,Ipc(μA)=6068.3 C(mol/L)+94.686,R2=0.990;此实验方法对乳样品中氯离子的检出限为0.001 mol/L。
2.3 抗干扰试验结果
在含0.02 mol/L氯化钠的硫酸钠溶液中分别加入其它高密度物质(20 g/L的糊精、20 g/L葡萄糖)进行干扰试验,每组试验重复三次,结果如表1所示,峰电流值的大小无明显差异,说明这些高密度物质对氯离子的检测均无干扰。
表1 抗干扰试验结果Table 1 Results of the anti-interference test
2.4 实际样品测定结果
采用本文方法对5个生乳样本进行加标回收率的测定,每组试验重复6次。本文方法回收率平均值为102.58%,且相对标准偏差的稳定性较好,这表明所提出的方法对于快速检测生鲜乳中的氯离子具有可行性。另外,通过配对t检验判断本文方法和GB5009.44-2016 银量法有无显著差异性,两种方法的平均值和标准差分别为0.0014、0.009,计算得到的t值为0.345,小于临界t值2.776,p值为0.747,大于0.05的显著水平,表明本文方法和GB5009.44-2016银量法没有显著差异。
3 结论
以银电极为研究电极,银氯化银电极为参比电极,铂片电极为辅助电极构成三电极检测系统,在含氯化钠溶液的测试液中,利用电化学循环伏安法探索了氯离子存在下银电极的电化学反应。电位正向扫描时,Ag失去了电子被氧化,与溶液中的氯离子结合生成氯化银沉淀;而负向扫描时,氯化银发生了还原反应。基于此反应,建立了一种快速、方便测定生乳中氯离子的方法。此方法检出限为0.001 mol/L,回收率和相对标准偏差分别在93.3%~113.7%和2.33%~4.89%,与GB5009.44-2016银量法比较无明显差异。

