蒸制中华绒螯蟹可食部位在冷藏过程中腥味变化分析
, , , ,,*
(1.上海海洋大学食品学院,上海 201306) (2.江西农业大学食品科学与工程学院,江西南昌 330045)
中华绒螯蟹(Eriocheirsinensis)俗称大闸蟹、河蟹,节肢动物门、甲壳亚门、软甲纲、十足目、方蟹科。中华绒螯蟹食用和繁殖季节在秋季,“秋风起,蟹脚痒”的说法主要是中华绒螯蟹要到河口繁殖,也表示着中华绒螯蟹的食用季节到了,每年的农历九月和十月是食用中华绒螯蟹的最佳时间,素有“九雌十雄”的说法。中华绒螯蟹因营养价值高,味道鲜美而深受消费者的喜爱,但是水产动物类产品普遍存在一定的腥味影响了消费者对它的喜好。特别是熟制后未食用完的中华绒螯蟹在短暂冷藏过后腥味更加突出。
近几年来,国内外对于中华绒螯蟹的研究主要集中在不同生长阶段[1]、不同养殖环境[2]、不同育肥方式[3]、不同贮藏方式[4]等的基本营养成分以及风味物质的形成方面,而对于中华绒螯蟹的腥味研究鲜见报道。腥味是水产品的一个重要感官指标,它反映了水产品的品质。也直接影响消费者对产品新鲜度的评价。目前,国外对水产腥味形成机理的研究较早,国内主要对脱腥方法研究较多,Sae-Leaw等[5]研究发现尼罗非鱼在冰中贮藏0~18 d过程中腥味不断增加,且单不饱和脂肪酸总量出现明显下降。据报道腥味物质的形成受很多因素的影响[6]。有研究发现己醛[7]、壬醛[8]、庚醛[9]、(E)-2-辛烯醛[10]是引起水产动物类食物腥味的主要物质;其中不饱和醇阈值相对较低,对气味有一定贡献,有研究发现1-辛烯-3-醇[11]对鱼体腥味贡献较大;酮类物质含量相对较少,不过有研究发现2,3-辛二酮[12]与腥味有关;烷烃类阈值较大但对整体气味贡献不大。因此醛类、酮类、醇类这三类物质将是研究中重点观测对象。
为了能较好的探究蒸制中华绒螯蟹可食部位在冷藏过程中腥味变化,本研究以中华绒螯蟹为对象,采用腥味评价、电子鼻主成分分析及顶空-固相微萃取-气相色谱-质谱联用技术(HS-SPME-GC-MS),对在4 ℃冷藏0、1、3、5 d熟制的中华绒螯蟹体肉、肝胰腺和性腺挥发性成分进行分析。结合气味活性值法(odor activity value,OAV)分析在冷藏过程中,对腥味有贡献的物质。从而探讨在冷藏过程中导致腥味加重的挥发性成分,以期为水产动物类食品深加工、品控以及腥味的控制提供理论支持和参考。
1 材料与方法
1.1 材料与仪器
中华绒螯蟹雌蟹 2017年10月中旬,从上海市崇明岛某公司捕获鲜活中华绒螯蟹雌蟹120只[(130±4.9) g/只],捆扎完好低温贮藏于泡沫箱,于3 h内运到实验室;甲醇(色谱级99.9%)、氯化钠(色谱级99.5%) 上海安谱实验科技有限公司;2,4,6-三甲基吡啶 TMP纯度>98.0%,东京化成工业株式会社。
Fox 4000电子鼻 法国Alpha M.O.S公司;PC-420D型萃取手柄 美国色谱科技公司;20 mL顶空采样瓶、5 μm PDMS/DVB SPME萃取头 上海安谱实验科技有限公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;FA系列电子天平 上海安谱仪器有限公司;Milli-Q型超纯水机 美国Milipore公司;7890B-5977A气相色谱-质谱联用仪 美国Agilent公司。
1.2 实验方法
1.2.1 样品的制备 将中华绒螯蟹雌蟹用自来水冲洗干净,电磁炉2000 W,开水蒸制25 min,自然放凉,装入聚乙烯制成的透明自封袋,备用。取足够的中华绒螯蟹在低温实验操作间进行手工剥取,取中华绒螯蟹的3个可食部位,分别得到体肉、肝胰腺和性腺,每个样品集中混匀,分装每袋8 g装入聚乙烯制成的透明自封袋,各分装4袋,排除空气封口放入4 ℃冰箱,待取样进行检测。
1.2.2 腥味评价 腥味评价参照曾绍东[13],Yarnpakdee等[11]的方法略有改动,取在4 ℃冷藏0、1、3、5 d的蒸制中华绒螯蟹蟹肉、性腺、肝胰腺各2.00 g于10 mL的感官杯中,经严格培训的6人(3男3女)组成的腥味评价小组评价体肉、性腺、肝胰腺气味的优劣。因为中华绒螯蟹固有的腥味,所以使用从“略有腥味”到“非常重”为尺度进行鱼腥味评价,评价时根据嗅闻到腥味大小在腥味评分表上给出数值,并作为腥味评分值,结果取平均值。评定结果分5个等级:0<略有腥味≤1;1<腥味较轻≤2;2<腥味中等≤3;3<腥味较重≤4;4<腥味非常重≤5。
1.2.3 电子鼻分析 采用Fox 4000电子鼻对蒸制中华绒螯蟹体肉、性腺、肝胰腺的整体气味轮廓进行区分,通过电子鼻的18根传感器对其进行定性分析,采用吴娜[14]的方法略有改动,分别取2.00 g待测定蟹样于15 mL顶空瓶中,置于4 ℃托盘中。采用动态顶空法采集气体,自动采集样品置于50 ℃金属浴中平衡600 s,进样器温度为60 ℃,1 s内注射到进样管道中。以洁净干燥空气为进样载气,进样体积为250 μL,流速150 mL/min,数据采集时间120 s。单个样品进样完毕后以干净空气吹扫10 min,以防止样品气味的残留,而后自动进行下一个样品的分析。每个样品取6个平行。
1.2.4 顶空固相微萃取条件 取2.00 g样品于20 mL顶空采样瓶中,并加入2 mL 0.18 g/mL氯化钠溶液,加入5 μL 10-4g/mL 2,4,6-三甲基吡啶甲醇溶液中,将65 μm PDMS/DVB SPME萃取头插入顶空采样瓶顶空部位;萃取温度60 ℃,萃取时间45 min,然后迅速取出插入气相色谱质谱联用仪进样口,解吸5 min,取出萃取管。每个样品做3个平行。
1.2.5 气相色谱质谱联用仪条件 色谱柱:HP-5MS柱长30 m,内径0.25 mm,液膜厚度0.25 μm的弹性毛细管柱。程序升温:起始柱温40 ℃,保持2 min;以3 ℃/min升温至60 ℃,不保持;再以6 ℃/min升温至180 ℃,不保持;最后以10 ℃/min升温至250 ℃,保持10 min。载气流量:载气为He,流速1.2 mL/min,不分流模式,汽化室温度250 ℃。
质谱条件:电子轰击(EI)离子源,电子能量70 eV,离子源温度为230 ℃。
1.2.6 气味物质定性定量分析 GC-MS实验数据处理采用GC-MSD化学工作站完成,未知化合物采用计算机检索同时与NIST11数据库进行匹配定性,匹配度大于85(最大值100)的予以采纳。
挥发性物质定量分析通过计算待测挥发性物质与TMP峰面积之比,求得其绝对浓度(假定各挥发物的绝对校准因子为1.0)。计算公式如下:
浓度(ng/g)=峰面积比例(挥发性物质/TMP)×[500 ng(TMP)]/2.00 g(蟹样)
1.2.7 气味活性值法 根据OAV的定义,指嗅感物质的绝对浓度(C)与其感觉气味阈值(OT)之比,当物质的OAV>1时,整体气味特征会因该物质浓度高低而不同;OAV<1时,则该物质不是决定总体气味特征的主要组分[15],且在一定范围内,OAV 越大说明该组分对总体气味贡献越大。在检测到的挥发性物质含量基础上,各物质在空气中的气味阈值[16],计算表征挥发性物质贡献大小的物理量-OAV。OAV计算公式:
OAVi=Ci/OTi
式中:Ci为挥发性物质的浓度,ng/g;OTi为挥发性物质的气味阈值。
1.3 数据处理
2 结果与分析
2.1 腥味评价结果
对中华绒螯蟹体肉、性腺、肝胰腺在冷藏过程中腥味变化进行腥味评分,结果如图1,在0、1、3、5 d的冷藏过程中,体肉和性腺在冷藏0 d时表现出较轻腥味,在冷藏1 d和3 d时腥味中等,第5 d时腥味较重;肝胰腺在0、1 d时都表现为较轻的腥味,冷藏3 d时表现出中等腥味,第5 d时表现出较重的腥味。从腥味评价中可以推断出,随着冷藏时间的增加腥味评分不断增加,这说明在冷藏过程中腥味不断加重。
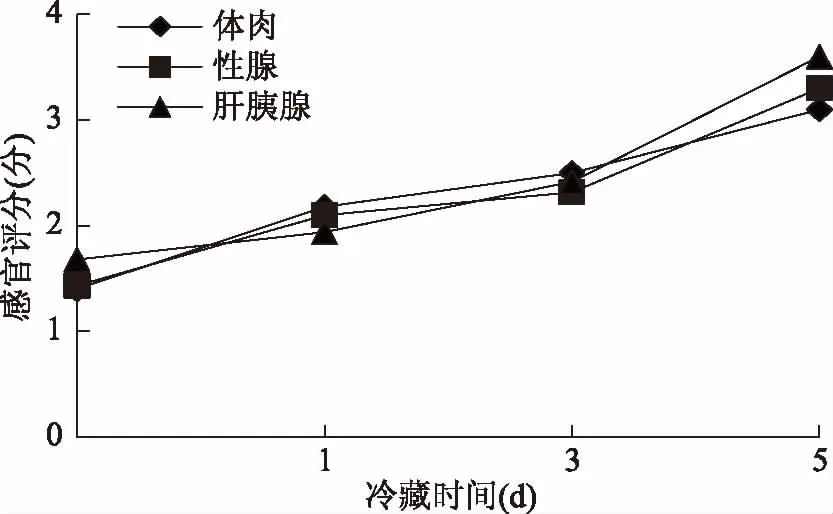
图1 蒸制中华绒螯蟹可食部位在冷藏过程中腥味分析Fig.1 Fishy odor analysis of the edible parts of steamed Chinese mitten crab during cold storage
2.2 冷藏过程中各可食部位气味轮廓
主成分分析(PCA)是将电子鼻18根传感器响应的特征向量矩阵数据转化和降维,并对降维后的特征向量进行线性分类,最后将分类结果以PCA散点图的形式展现出来[17]。第一主成分和第二主成分贡献度之和反映样本整体差异信息,(PC1%+PC2%)的值越大则样本差异信息体现越完整[18]。由图2~图4可知,PC1和PC2贡献度之和分别为95.304%、95.179%、95.352%,均大于90%。表明此差异能在PC1、PC2构建的平面上充分显示。体肉和性腺在冷藏过程中所形成的独立性区域无重叠;在冷藏过程中逐渐区分开,说明在冷藏过程中产生的挥发性成分有明显的差异。由于第一主分PC1贡献率大,3个可食部位在冷藏过程中所形成的的独立性区域映射在PC1上可以看出第3 d与第0 d相比已经完全被区分。而肝胰腺在冷藏过程中形成的独立性区域0、1、3、5 d有部分重叠,但0 d与3 d相比已经完全被区分,表明在冷藏过程中生成气味物质0 d与3 d相比有较大差异。
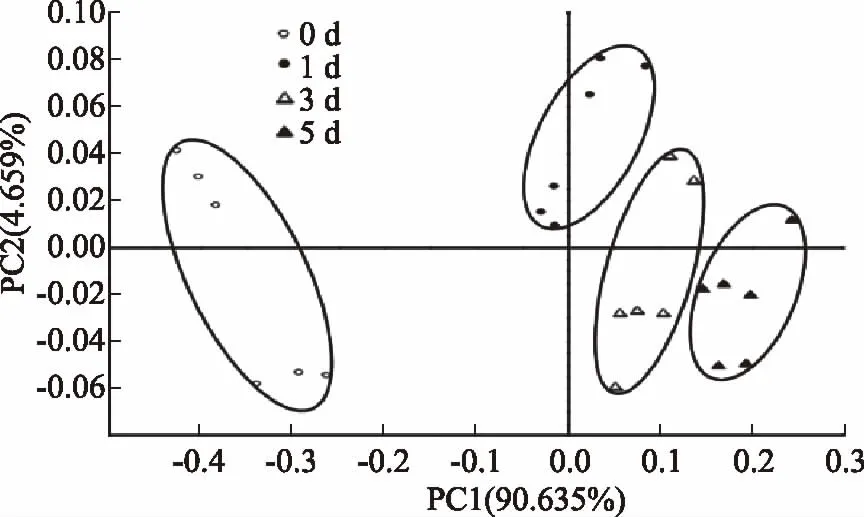
图2 蒸制中华绒螯蟹体肉在冷藏过程中气味轮廓主成分分析图Fig.2 Principal component analysis(PCA)of odor profile of Chinese mitten crab abdominal meat during cold storage
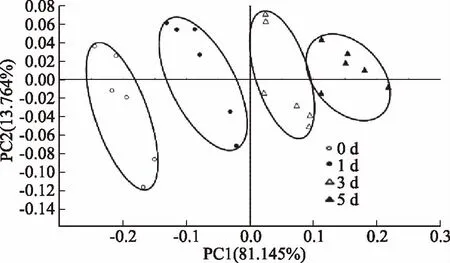
图3 蒸制中华绒螯蟹性腺在冷藏过程中气味轮廓主成分分析图Fig.3 Principal component analysis(PCA)of odor profile of Chinese mitten crab gonad during cold storage
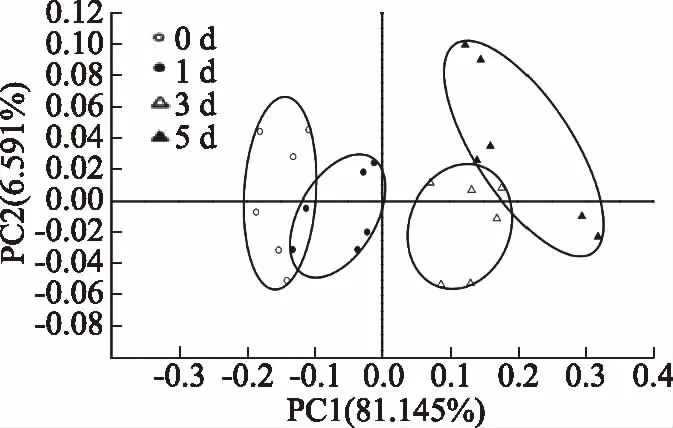
图4 蒸制中华绒螯蟹肝胰腺在冷藏过程中气味轮廓主成分分析图Fig.4 Principal component analysis(PCA)of odor profile of Chinese mitten crab hepatopancreas during cold storage
2.3 冷藏过程中体肉的腥味成分变化
图5表示体肉在冷藏0、1、3、5 d时分别检测到44、45、50、54种挥发性物质;醛类物质各检测7、7、8、11种;醇类各检测到7、6、8、8种;酮类各检测到4、5、5、7种,图6表示在冷藏的过程中醛、醇、酮类物质种类有所增加。在冷藏0、1、3、5 d内醛类物质总含量4.35、10.63、29.71、151.16 ng/g;醇类物质总含量2.22、11.24、41.11、121.43 ng/g;酮类物质总含量1.24、6.50、22.63、70.36 ng/g,说明随着冷藏时间的增加挥发性物质的总量也在不断增加,在冷藏过程中脂肪不断氧化;吴娜[14]研究发现中华绒螯蟹气味物质来源主要来自于脂类/脂肪酸的热氧化降解。
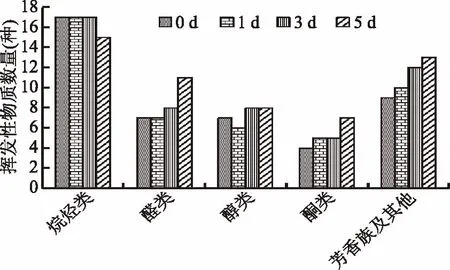
图5 蒸制中华绒螯蟹体肉在冷藏过程中挥发性物质分类图Fig.5 Classification of odor compounds in abdominal meat of steamed Chinese mitten crab during cold storage
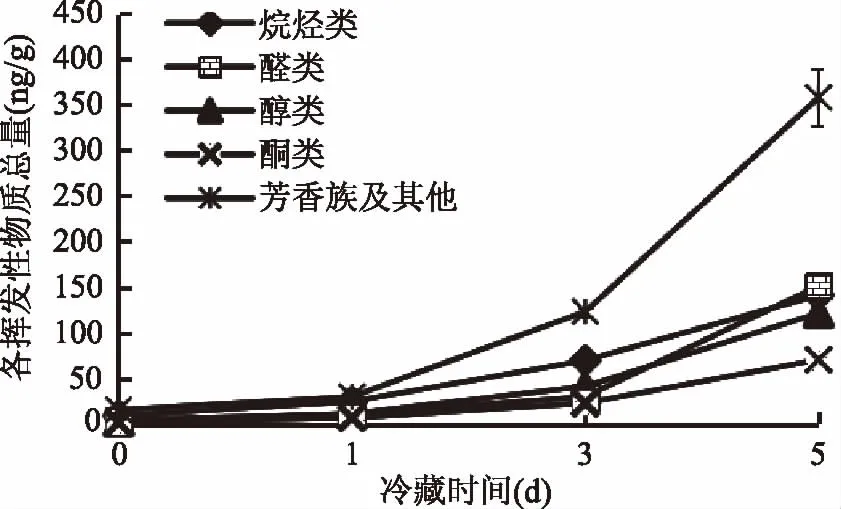
图6 蒸制中华绒螯蟹体肉在冷藏过程中挥发性物质总量变化Fig.6 Variations of total odor compounds in abdominal meat of steamed Chinese mitten crab during cold storage
从表1可以看出在冷藏过程中对体肉腥味的形成有贡献的醛类和醇类物质中己醛、庚醛、壬醛不断增加,(E)-2-辛烯醛在0、1、3 d均未检测到,说明在冷藏0、1、3 d时间段内(E)-2-辛烯醛对体肉的腥味并无贡献;1-辛烯-3-醇在0、1 d未检测到,说明在0、1 d时间段内1-辛烯-3-醇对体肉的腥味也无贡献,对于1-辛烯-3-醇在0、1 d未检测到和(E)-2-辛烯醛在0、1、3 d未检测到,可能的原因是产生这两种物质的前提物质未发生氧化降解。冷藏3 d时壬醛、1-辛烯-3-醇的含量相对0、1 d有显著性差异(p<0.05),说明在第3 d时腥味开始出现明显变化。在冷藏5 d时己醛、庚醛、壬醛、(E)-2-辛烯醛、1-辛烯-3-醇都有检测到,说明随着冷藏时间的延长腥味也在不断的加重。
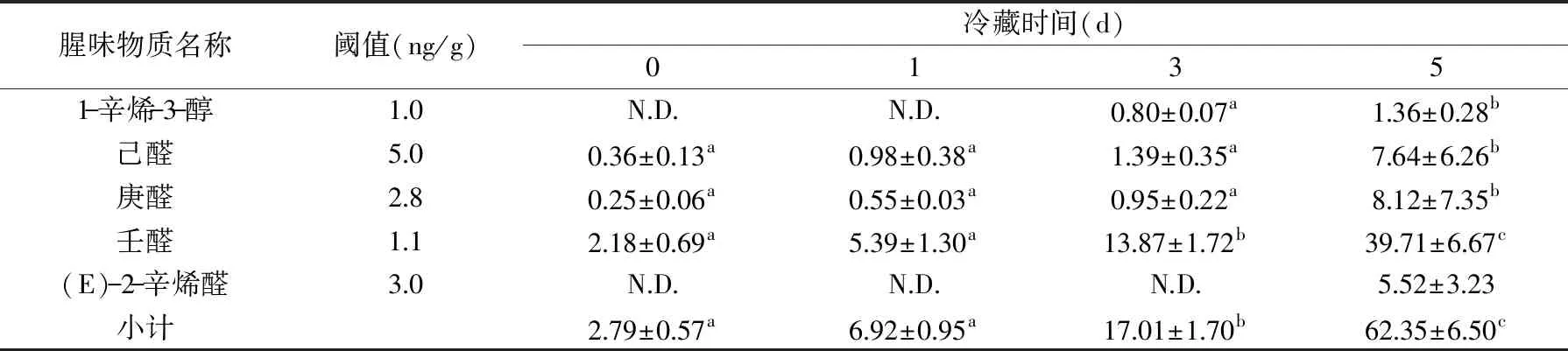
表1 蒸制中华绒螯蟹体肉在冷藏过程中腥味成分分析(ng/g)Table 1 Analysis of fishy odor compounds in abdominal meat of steamed Chinese mitten crab during cold storage(ng/g)
2.4 冷藏过程中肝胰腺的腥味成分变化
图7表示肝胰腺在冷藏0、1、3、5 d时共检测到52、61、62、57种挥发性物质;醛类物质各检测13、13、13、12种;醇类各检测到7、8、9、8种;酮类均检测到7种,在冷藏的过程中醛类物质种类基本不变,醇类物质种类有所增加,酮类物质种类不变。图8表示肝胰腺在冷藏0、1、3、5 d醛类物质总含量225.83、246.84、597.38、861.13 ng/g;醇类物质总含量52.18、82.24、289.44、453.77 ng/g;酮类物质总含量60.44、72.29、222.17、331.15 ng/g,说明随着冷藏时间的增加挥发性物质的总量也在不断的增加。
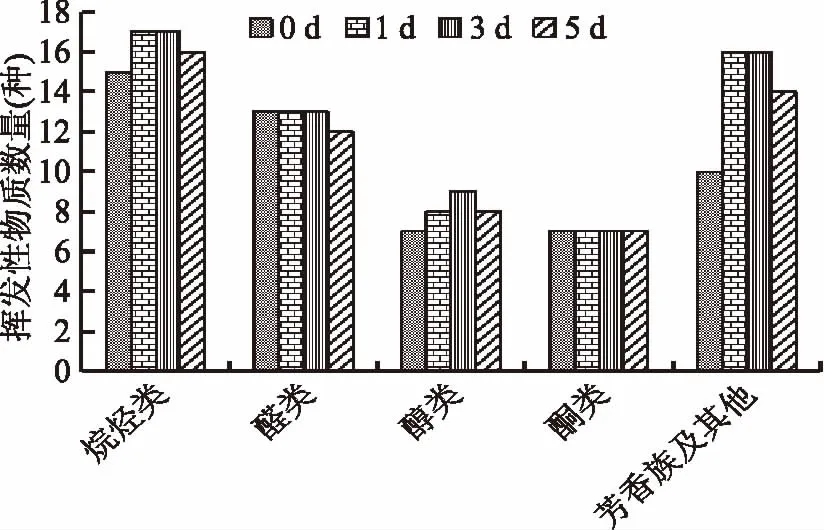
图7 蒸制中华绒螯蟹肝胰腺在冷藏过程中挥发性物质分类图Fig.7 Classification of odor compounds in hepatopancreas of steamed Chinese mitten crab during cold storage
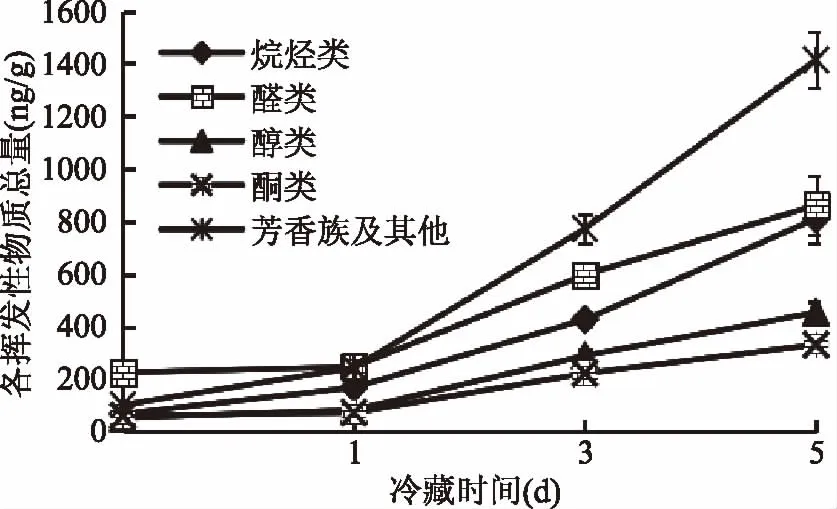
图8 蒸制中华绒螯蟹肝胰腺在冷藏过程中挥发性物质总量变化Fig.8 Variations of total odor compounds in hepatopancreas of steamed Chinese mitten crab during cold storage
从表2可以看出肝胰腺在冷藏过程中己醛、庚醛、壬醛、(E)-2-辛烯醛、1-辛烯-3-醇均有检测到,且随着冷藏时间增加这些物质不断增加。己醛的含量从第1 d时开始出现差异,庚醛、壬醛、(E)-2-辛烯醛、1-辛烯-3-醇含量均在第3 d开始出现显著性差异(p<0.05),说明随着冷藏时间的延长腥味也在不断的加重。但己醛、1-辛烯-3-醇的含量在第5 d减少,且有明显差异性。可能的原因这两种物质进一步降解成其他物质或者产生这两种物质的前提物质已经完全氧化,这有待于进一步研究。
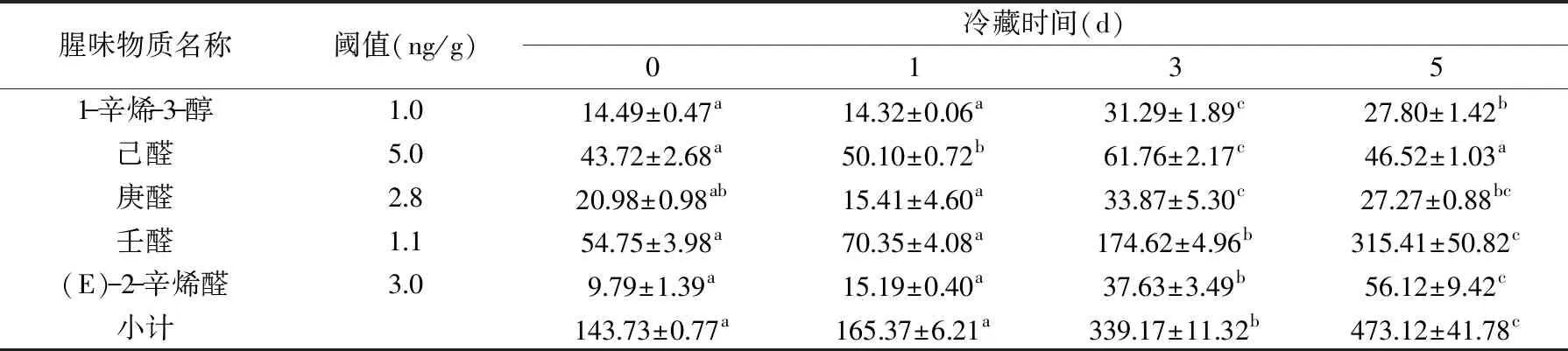
表2 蒸制中华绒螯蟹肝胰腺在冷藏过程中腥味成分分析(ng/g)Table 2 Analysis of fishy odor compounds in hepatopancreas of steamed Chinese mitten crab during cold storage(ng/g)
2.5 冷藏过程中性腺的腥味成分变化
图9表示,性腺在冷藏0、1、3、5 d时共检测到37、45、52、58种挥发性物质;醛类物质各检测11、14、15、14种;醇类各检测到9、7、7、10种;酮类各检测到2、4、7、6种,在冷藏的过程中醛类物质种类有所增加;醇类物质种类先减少后增加;酮类物质种类有所增加。由图10可知,在冷藏0、1、3、5 d内醛类物质总含量59.52、113.54、267.61、330.68 ng/g;醇类物质总含量45.24、65.15、169.01、239.66 ng/g;酮类物质总含量30.39、82.49、151.48、213.03 ng/g,说明随着冷藏时间的增加挥发性气味物质的总量也在不断的增加。
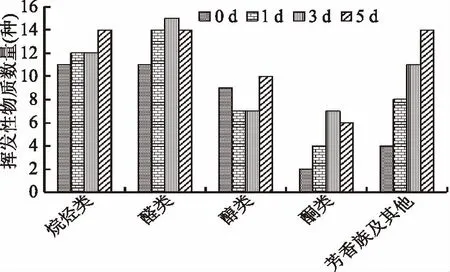
图9 蒸制中华绒螯蟹性腺在冷藏过程中挥发性物质分类图Fig.9 Classification of odor compounds in gonad of steamed Chinese mitten crab during cold storage
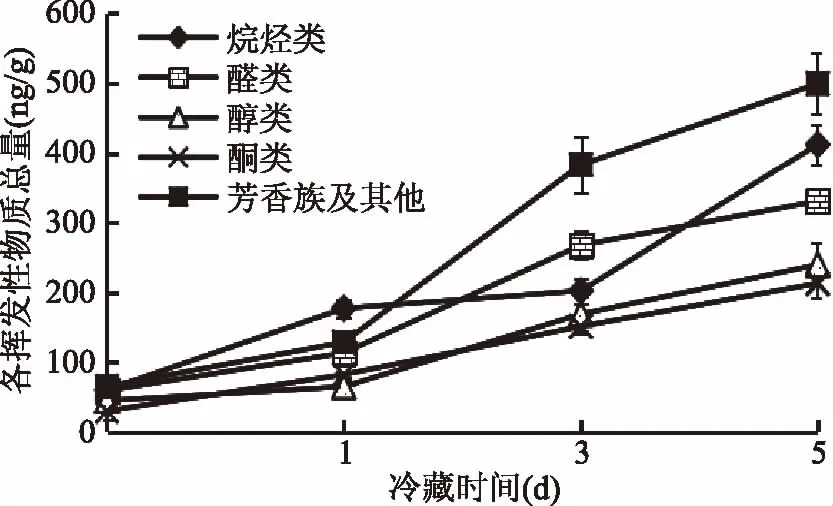
图10 蒸制中华绒螯蟹性腺在冷藏过程中挥发性物质总量变化Fig.10 Variations of total odor compounds in gonad of steamed Chinese mitten crab during cold storage
从表3可以看出性腺在冷藏过程中己醛、庚醛、壬醛、(E)-2-辛烯醛、1-辛烯-3-醇也均有检测到,且随着冷藏时间增加这些物质也在不断增加。其中壬醛的含量从第1 d时开始出现差异,己醛、庚醛、(E)-2-辛烯醛、1-辛烯-3-醇含量均在第3 d开始出现差异。说明随着冷藏时间的延长腥味也在不断的加重。其中1-辛烯-3-醇的含量在第5 d减少,且有明显差异性。
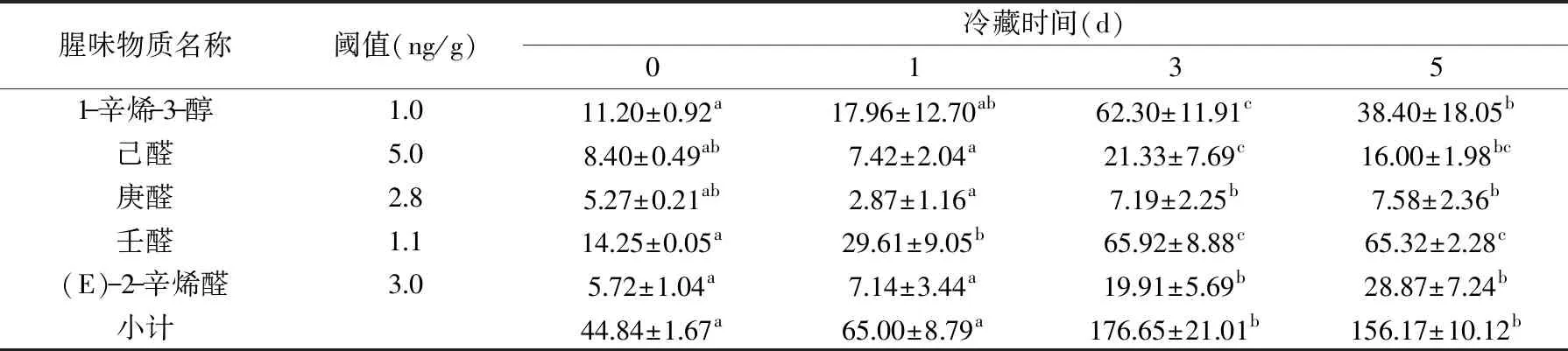
表3 蒸制中华绒螯蟹性腺在冷藏过程中腥味成分分析(ng/g,n=3)Table 3 Analysis of fishy odor compounds in gonad of steamed Chinese mitten crab during cold storage(ng/g,n=3)
2.6 冷藏过程中各可食部位总挥发性物质含量及腥味成分总含量的变化
图11表明,在在冷藏过程中,总挥发性物质不断增多,并随着冷藏时间的增加都存在明显的差异性,且差异性显著(p<0.05)。对于同一冷藏时间挥发性物质总量肝胰腺>性腺>体肉,张娜[19]、蒋根栋[20]和金燕[21]均采用HS-SPME-GC-MS对中华绒螯蟹中气味物质进行检测,结果显示其体肉、性腺和肝胰腺中的气味物质组成及含量均存在一定的差异。图12表明,在冷藏0、1、3、5 d时间段内,随着冷藏时间延长,对腥味有贡献的挥发性气味物质总量也在不断增多,并且在3 d都出现明显的差异,从图12中可以看出,同一天体肉、肝胰腺、性腺在冷藏中生成对腥味有贡献的挥发性物质的总量肝胰腺>性腺>体肉,这是由于在脂肪含量上肝胰腺>性腺>体肉,这也进一步说明了中华绒螯蟹关键气味物质主要来自于脂类/脂肪酸的热氧化降解。
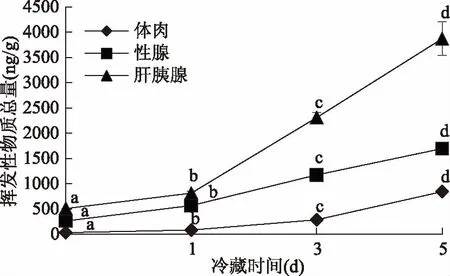
图11 蒸制中华绒螯蟹可食部位在冷藏过程中挥发性物质总量变化Fig.11 Variations of total odor compounds in edible parts of steamed Chinese mitten crab during cold storage 注:不同字母表示差异性显著(p<0.05);图12同。
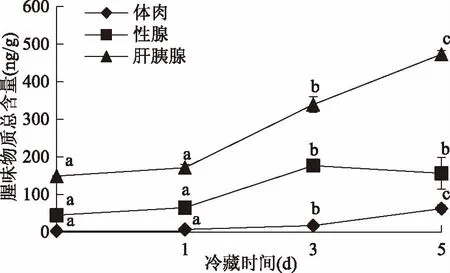
图12 蒸制中华绒螯蟹可食部位在冷藏过程中腥味物质总量变化Fig.12 Variations of total fishy odor compounds in edible parts of steamed Chinese mitten crab during cold storage
整体而言蒸制中华绒螯蟹在冷藏过程中腥味越来越重。Iglesias等[22]采用SPME-GC-MS方法研究发现,虹鳟鱼在冻藏过程中1-辛烯-3-醇、己醛、庚醛、壬醛等物质含量不断增大,与此结果基本相一致。
三个可食部位在冷藏过程中都有检测到己醛、庚醛、壬醛、(E)-2-辛烯醛以及1-辛烯-3-醇,随着冷藏时间的增加,腥味物质以及挥发性气味物质总量不断增多,且肝胰腺>性腺>体肉,这主要是由于油脂含量中肝胰腺>性腺>体肉,刘奇[12]研究发现,腥味特征与脂肪酸氧化有密切的关系,主要是不饱和脂肪酸氧化造成的。这几种腥味物质的前提物质主要由油酸、亚麻酸、亚油酸以及花生四烯酸氧化产生,Chen等[23]研究发现,己醛和庚醛的产生来自于亚油酸、亚麻酸,1-辛烯-3-醇产生来自于亚油酸和花生四烯酸。Chung[24]研究发现,壬醛的产生来自亚油酸和亚麻酸。Choi等[25]研究发现,油酸和亚麻酸是产生(E)-2-辛烯醛的前体物质。因此在冷藏过程中腥味增加主要可能原因是脂肪酸氧化造成的。
2.7 各可食部位在冷藏过程中关键腥味成分变化分析
在食物中分析鉴定出的化合物中,物质的浓度一定时,感觉阈值越低越容易被感知,感觉阈值一定时,浓度越高越易被感知。因此,仅有部分化合物是影响食物气味的活性物质,即可采用OAV值将物质浓度和感觉气味阈值结合起来,对物质气味作出评价[26]。因此结合OAV值从表4可以看出,在冷藏0、1、3 d的过程中,对体肉的腥味有贡献的主要是壬醛,冷藏5 d时己醛、庚醛、壬醛、(E)-2-辛烯醛、1-辛烯-3-醇对体肉腥味均有贡献,说明在第5 d时腥味已经开始发生明显变化。体肉、性腺和肝胰腺OAV值随着冷藏时间的增加整体呈现增加趋势,特别在3 d时,OAV值出现明显的增大,说明在3 d时腥味变得更加明显。性腺和肝胰腺在冷藏过程中OAV均大于1,说明从冷藏0~5 d,己醛、庚醛、壬醛、(E)-2-辛烯醛、1-辛烯-3-醇对性腺和肝胰腺都有贡献。结合2.6可以得出,蒸制中华绒螯蟹在冷藏过程对中腥味贡献最大的是肝胰腺,其次是性腺。
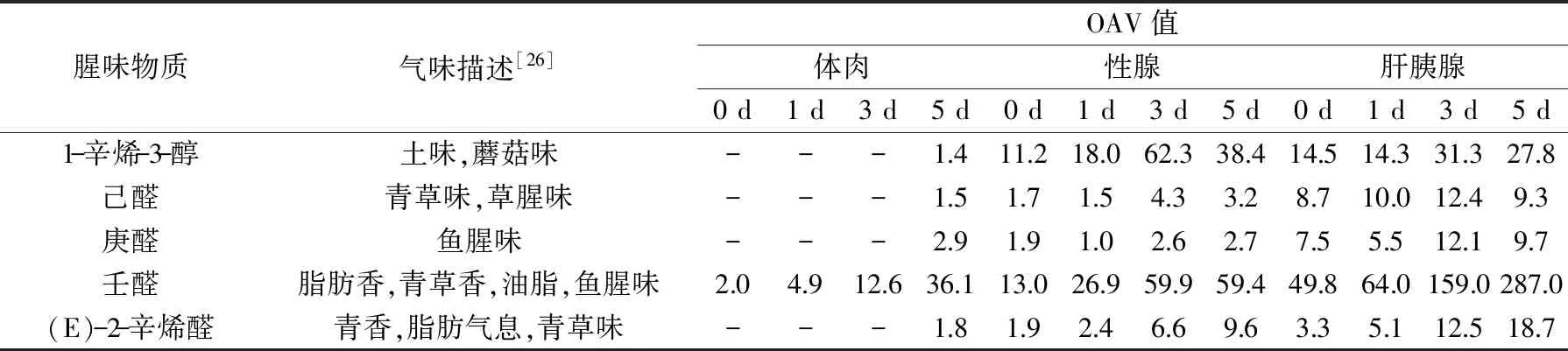
表4 蒸制中华绒螯蟹可食部位在冷藏过程中腥味物质OAV值分析结果Table 4 Analysis the OAV values of fishy odor in a edible parts of steamed Chinese mitten crab during cold storage
3 结论
腥味是评价水产动物新鲜和品质优劣的重要指标,本研究通过对蒸制中华绒螯蟹可食部位在冷藏过程中腥味变化分析,得出以下结论,蒸制中华绒螯蟹3个可食部位在0~5 d的冷藏过程中腥味不断加重,且在第3 d开始出现显著性差异(p<0.05)。利用HS-SPME-GC-MS检测发现,在冷藏过程中,随着冷藏时间的增加,挥发性物质总量也在增加,其中对腥味有贡献的己醛、庚醛、壬醛、(E)-2-辛烯醛、1-辛烯-3-醇各物质总含量呈现增加趋势,且都在第3 d时出现显著性差异(p<0.05)。通过结合OAV值得出,对腥味贡献程度肝胰腺>性腺>体肉,但对中华绒螯蟹整体而言肝胰腺、性腺和体肉对腥味的产生均有贡献。因此认为在生产和生活中,对冷藏的蒸制中华绒螯蟹赏味最佳时间最好在3 d内。
由于腥味的形成复杂多样而且是由多种物质共同作用的结果,对于在冷藏过程中水产动物腥味的形成机制也尚难以解决。本研究得出的结论将为后续研究腥味产生机制以及利用真空包装配合抗氧剂控制腥味变化提供数据支撑和理论依据。

