阻塞性睡眠呼吸暂停低通气综合征血小板/淋巴细胞比值与动脉粥样硬化的相关性分析
李燕 宗峰 吴剑卿
江苏省人民医院老年医学科,南京210000
OSAHS是一种在睡眠中反复发作的疾病,以气道完全或局部塌陷为主要特征,临床多表现为夜间睡眠打鼾、呼吸暂停,常伴精神异常、白天倦怠、打鼾等症状,严重降低睡眠质量,甚至威胁患者生命安全[1-2]。相关研究显示,OSAHS患者可引发局部或全身炎症反应,并削弱呼吸系统防御功能,免疫系统存在明显异常,其中血小板/淋巴细胞比值(platelet to lymphocyte ratio,PLR)被认为是反映机体免疫系统、炎症反应有效指标之一,具有促炎及促动脉粥样硬化作用,并与多种心血管疾病发生发展密切相关[3-4]。目前关于OSAHS患者PLR与动脉粥样硬化的相关性研究较少,本研究旨在探究PLR与动脉粥样硬化间相关性,从而为早期临床诊断与治疗提供理论依据。
1 对象与方法
1.1 研究对象 回顾性分析2016年3月至2018年3月于江苏省人民医院收集的84例OSAHS患者临床资料并将其设为观察组,男49例,女35例,年龄(51.38±5.96)岁,年龄范围31~65岁,体质量指数(26.71±2.94)kg/m2。体质量指数范围21~31 kg/m2,纳入标准:(1)所有患者经诊断符合中华医学会呼吸病学分会睡眠呼吸疾病学组所制定的OSAHS诊断标准[5];(2)均可接受多导睡眠监测(polysomnography,PSG)检测且临床资料完整;(3)本研究经过医学伦理委员会批准(20160109),患者及家属签订知情同意书。排除标准:(1)严重肝、肾疾病者;(2)患心肌梗死、急性冠状动脉综合征等心血管疾病者;(3)近期服用抗凝、抗血小板凝聚等药物者;(4)免疫系统、血液系统疾病者;(5)精神疾病以及不配合检测者。另选取51名健康体检者为对照组,男28例,女23例,年龄(51.74±6.14)岁,年龄范围30~64岁,体质量指数(26.15±3.04)kg/m2,体质量指数范围22~32 kg/m2。两组性别、年龄、体质量指数等一般资料比较,差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 PSG检测 所有受试者检查24 h前均禁茶、咖啡或镇静催眠类药物,应用64导睡眠检测仪(德国施曼诺公司)行整晚多导睡眠监测(polysomnography,PSG)检测(晚上20点至次日早晨6点),对脑电图、心电图、肌电图、胸腹运动、脉氧饱和度以及体位变化情况进行观察,比较呼吸暂停低通气指数(apnea hypopnea index,AHI)、最低血氧饱和度(blood oxygen saturation,SaO2)、血压以及最长呼吸暂停时间。
1.2.2 血常规检测 所有受试者均于检测当日清晨空腹抽取静脉血4 ml,应用血细胞分析仪测定白细胞总数、淋巴细胞计数、血小板总数、血小板平均体积(mean platelet volume,MPV)、血小板分布宽度(platelet distribution width,PDW)并计算PLR值。
1.2.3 动脉粥样硬化检测 应用美国GE公司彩色多普勒超声诊断仪检测,设置探头频率为8 MHz,患者首先取仰卧位,将颈部充分暴露,从颈总动脉远端近分叉部、颈内动脉动脉部上1cm左右处后壁进行测量,统计内中膜厚度(intimamedia thickness,IMT)值,反复测量3次取平均值。后对双下肢动脉进行检查,取平卧位、俯卧位,主要对股总动脉、股浅动脉、胫前后动脉、足背动脉等部位进行检查,当IMT≥1.5 mm可诊断为动脉粥样硬化。随后应用VP-1000 PWV/ABI测定仪(日本COLIN公司)检测上臂动脉-脚踝动脉的脉搏波传导速度(pulse wave velocity,PWV),分析两侧PWV值取平均值。最后患者取平卧位,外展右上肢,测量在静息状态下肘上3~5 cm肱动脉内径基础值,另将前臂充气加压在50 mm Hg(1 mm Hg=0.133 k Pa)以上,待5 min后对肱动脉反应性充血内径测量并计算血流介导性血管扩张(flow mediated dilation,FMD)值,反复测量3次取平均值。
1.3 统计学分析 应用统计学软件SPSS 22.0分析数据,计量资料以±s表示,组间比较采取t检验;计数资料以χ2检验处理,应用Pearson法对PLR与动脉粥样硬化间关系进行相关性分析,应用多因素logistic回归分析影响动脉粥样硬化发生危险因素,P<0.05为差异有统计学意义。
2 结果
2.1 两组PSG参数比较 观察组AHI、血压、最长呼吸暂停时间显著高于对照组,最低SaO2显著低于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组PSG参数比较(±s)
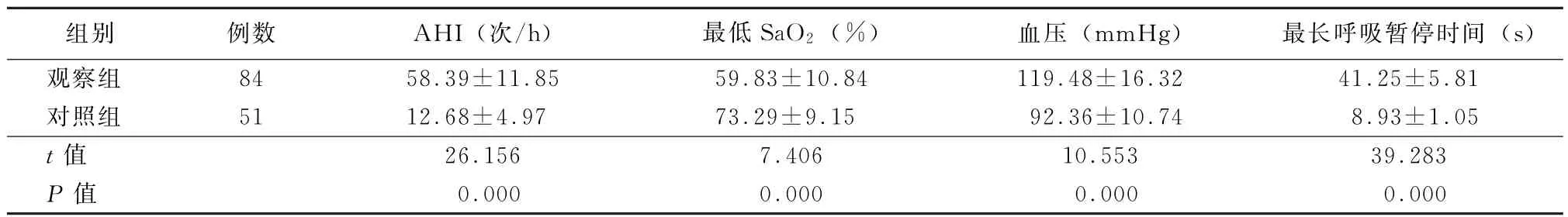
表1 两组PSG参数比较(±s)
注:AHI为睡眠呼吸暂停低通气指数,SaO2为血氧饱和度,1 mm Hg=0.133 k Pa
组别例数AHI(次/h)最低SaO2(%)血压(mm Hg)最长呼吸暂停时间(s)观察组84 58.39±11.85 59.83±10.84 119.48±16.32 41.25±5.81对照组51 12.68±4.97 73.29±9.15 92.36±10.74 8.93±1.05 t值26.156 7.406 10.553 39.283 P值0.000 0.000 0.000 0.000
2.2 两组血常规指标比较 观察组PLR、MPV、PDW显著高于对照组,差异统计学意义(P<0.05),见表2。
表2 两组血常规指标比较(±s)
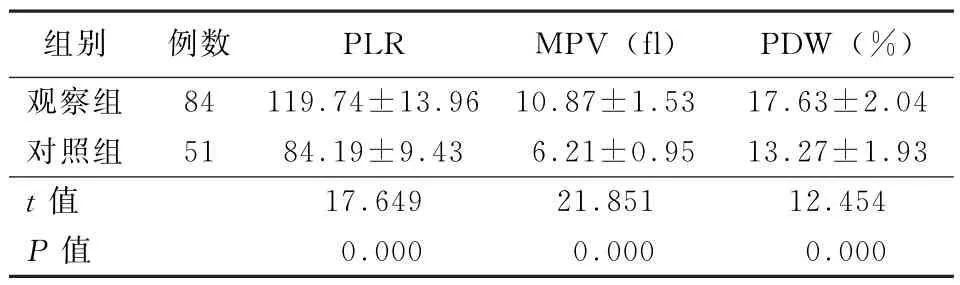
表2 两组血常规指标比较(±s)
注:PLR为血小板/淋巴细胞比值;MPV为血小板平均体积;PDW为血小板分布宽度
组别例数PLR MPV(fl)PDW(%)观察组84 119.74±13.96 10.87±1.53 17.63±2.04对照组51 84.19±9.43 6.21±0.95 13.27±1.93 t值17.649 21.851 12.454 P值0.000 0.000 0.000
2.3 两组动脉粥样硬化斑块指标比较 观察组下肢动脉粥样硬化斑块发生率、PWV、IMT显著高于对照组,FMD显著低于对照组,差异有统计学意义(P<0.05),见表3。

表3 两组动脉粥样硬化斑块指标比较
2.4 PLR与动脉粥样硬化相关性 PLR与FMD呈显著负相关,与PWV、IMT呈显著正相关(P<0.005),见表4。

表4 PLR与动脉粥样硬化相关性
2.5 影响动脉粥样硬化多因素logistic回归分析 年龄、AHI、最低SaO2、血压、最长呼吸暂停时间、PLR是影响动脉粥样硬化发生的危险因素(P<0.05),见表5。
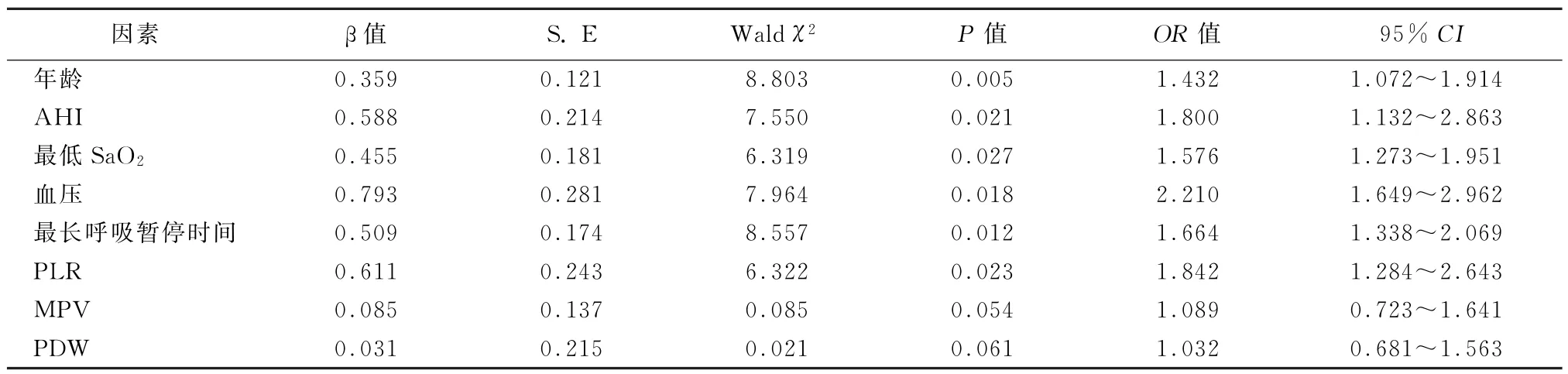
表5 影响动脉粥样硬化多因素logistic回归分析
3 讨论
OSAHS作为潜在危险性疾病之一,若未及时治疗,可引发冠心病、糖尿病等心脑血管疾病,甚至可导致患者死亡,其病死率较高[6]。当前关于OSAHS发病机制尚不明确,部分研究显示OSAHS与炎症反应、氧化应激等因素密切相关,其中核转录因子(nuclear transcription factor kappa B,NF-κB)所介导的炎症反应在OSAHS发病中发挥重要作用,另因长期反复缺氧导致氧化应激反应,增加氧活性簇,又可引发一系列机体炎症反应[7-8]。
PLR作为最新发现可反映机体炎症状态重要指标之一,是经测量淋巴细胞计数、血小板总数进行分析统计而来,其中血小板是由巨核细胞演变而来的无核血细胞,在血管损伤、血管重建、血栓栓塞等病理事件中发挥重要作用,淋巴细胞计数可一定程度上反映机体免疫状态以及应对应激时反应能力[9-10]。并且,临床进行PLR检测具有低廉、快捷、易操作等优势,在临床中可广泛用于评价心脏病、肿瘤等患者的炎症反应变化情况。郎娅淞和张月战[11]研究指出,急性缺血性脑血管病患者的PLR水平明显上升,可见PLR也是反映心血管疾病潜在指标,而心血管疾病又与动脉粥样硬化发生发展有关。部分研究表明,在OSAHS发展过程中,血流动力学改变、炎症、氧化等多种机制以复杂形式相互作用下影响动脉粥样硬化,患者在睡眠期因呼吸道受阻引发慢性周期性缺氧,致使一氧化碳生物利用度明显下降,从而引发血管反应性功能发生障碍,血栓形成能力也明显增强,最终进一步促使动脉粥样硬化发生,甚至加重,同时也显著提高高血压、缺血性损伤等相关心血管并发症发生风险[12-14]。
目前临床所应用的PSG检测为诊断OSAHS金标准,检测结果可明确疾病类型与程度,从而为临床治疗、疗效评定提供可靠依据[15]。本研究对受试者应用PSG检测,其结果显示观察组AHI、血压、最长呼吸暂停时间显著高于对照组,最低SaO2显著低于对照组,提示OSAHS患者睡眠存在明显障碍,病情较为严重。血常规结果显示,观察组PLR、MPV、PDW显著高于对照组,表明OSAHS患者处于炎症状态,主要是由于随着OSAHS病情程度加重,慢性间歇性低氧血症、高碳酸血症使患者交感神经持续兴奋,刺激机体释放大量炎症因子,并导致免疫功能发生紊乱,炎性指标则相应明显升高。此外,患者PLR水平较对照组显著上升,推测其原因为促炎细胞活素异常升高使巨核细胞增殖,进而导致血小板计数升高,并且MPV水平的升高可促使血栓形成,从而引发心血管疾病,增加不良后果的发生风险。当前临床所有应用的PWV、FMD、IMT为预测动脉粥样硬化检测指标,可反映动脉血管弹性、血管内皮功能及动态性改变,本研究对三者进行检测,其结果显示观察组下肢动脉粥样硬化斑块发生率、PWV、IMT显著高于对照组,FMD显著低于对照组,与连鹏等[16]研究显示患者存在颈动脉粥样硬化斑块相一致。表明OSAHS与动脉粥样硬化发生相关,患者颈动脉及下肢存在少量动脉粥样硬化斑块,血管内皮功能发生明显异常,可能因患者长期慢性间歇缺氧/再复氧产生氧化应激状态,将严重影响血管内皮功能,促使动脉粥样硬化逐步形成。另对PLR与动脉粥样硬化间关系进行分析,结果显示PLR与FMD呈显著负相关,与PWV、IMT呈显著正相关,因在炎症反应过程中,血小板、内皮细胞以及淋巴细胞等相互作用下可促使动脉粥样硬化发生,也充分表明PLR是预测系统性炎症疾病发生状况以及心血管疾病进程的有效炎症指标,从而可对OSAHS患者进行及时诊治,避免不良后果发生[17]。结果还显示,年龄、AHI、最低SaO2、血压、最长呼吸暂停时间、PLR是影响OSAHS患者动脉粥样硬化发生的危险因素,提示在临床中应密切关注高龄、高血压患者,同时定期进行PSG、PLR检测以观察患者病情进展情况,及时采取有效治疗措施阻断动脉粥样硬化发生,本结果与张素花和孙经武[18]研究显示AHI、夜间SaO2为颈动脉粥样硬化独立影响因素较为一致。
综上所述,OSAHS患者PLR水平较高,参与动脉粥样硬化发生发展过程,可作为反映疾病发展情况的有效指标,同时应采取有效治疗措施控制血压、PLR等水平以降低动脉粥样硬化发生。本研究样本量较少,存在一定不足,后期需大量样本并进行随机研究试验以明确药物治疗能否阻断动脉粥样硬化进展,预防心脑血管疾病发生,为临床治疗提供可靠依据。
利益冲突所有作者均声明不存在利益冲突

