经鼻高流量湿化氧疗治疗手术机械通气拔管后急性呼吸衰竭及气道管理
郭福燕 冉蕾 刘会霞 李会彦 魏维 翟闻芳 李静
1河北医科大学第三医院肾内科,石家庄050000;2河北医科大学第三医院呼吸内二科,石家庄050000
大型外科手术术后长时间有创正压通气(invasive positive pressure ventilation,IPPV)可导致呼吸肌疲劳和膈功能障碍,拔出气管插管后会出现不同程度的肺泡塌陷,严重者出现急性呼吸衰竭(acute respiratory failure,ARF),拔管后出现ARF意味着呼吸机脱机失败,患者将面临二次有创通气或气管切开损伤,既延长了住院时间,又增大了呼吸机相关性肺炎(ventilator-associated pneumonia,VAP)及肺损伤的发生概率[1]。无创正压通气(noninvasive positive pressure ventilation,NPPV)是抢救ARF的手段之一,经鼻面罩行NPPV可使ARF患者获益,降低二次气管插管率或气管切开率已成为专家共识[2-3]。经鼻高流量湿化氧疗(humidified high flow nasal cannula oxygen therapy,H HFNC)技术既往主要用于儿童或新生儿呼吸衰竭的治疗,近年国内外陆续报道HHFNC在成人急性呼吸衰竭、拔管后呼吸窘迫的临床救治中疗效可能较NPPV更加明显[4-6]。笔者对本院ICU术后气管拔管后发生ARF的病例分别采用NPPV与HHFNC治疗,结果如下。
1 对象与方法
1.1 研究对象 研究经本院医学伦理委员会审查批准(2018-005-1)。研究对象入组标准:(1)年龄<70岁;(2)术后气管插管辅助通气达到脱机指征;(3)脱机后出现呼吸衰竭症状并达到《内科学》ARF临床诊断标准[7];(4)患者意识清醒。排除标准:(1)鼻咽部解剖结构异常、面部损伤、口腔难以闭合者;(2)合并严重肺大疱、肺气肿、败血症、脑血管意外、严重心律失常者;(3)呼吸微弱或心跳骤停者;(4)明显吞咽反射困难者;(5)难以耐受无创正压通气者。
入选本院ICU 2014年8月至2015年12月术后行有创通气拔管后发生ARF的86例患者为研究对象。入组患者中男54例,女32例,年龄(56.2±7.2)岁,年龄范围44~68岁;胸部手术术后35例、心脏手术术后38例、消化道手术术后13例;术后气管插管通气天数(6.0±2.6)d,范围3~10 d;拔管后当日急性生理学和慢性健康状况评分系统Ⅱ(Acute Physiology and Chronic Health Scoring SystemⅡ,APACHEⅡ)评分13~25分,平均(18.5~3.3)分。入组患者根据随机数字表分为A(44例)、B(42例)两组,两组患者无创通气前基础特征差异无统计学意义(P>0.05),见表1。
1.2 无创通气治疗方法 所有患者脱机拔管后均采用3~5 L/min鼻塞吸氧,若患者出现呼吸频率(respiratory ratio,RR)增快,血氧饱和度(pulse oxygen saturation,SpO2)下降,PaO2下降至60 mm Hg(1 mm Hg=0.133 k Pa)伴或不伴PaCO2升高至50 mm Hg,考虑给予无创辅助通气治疗。
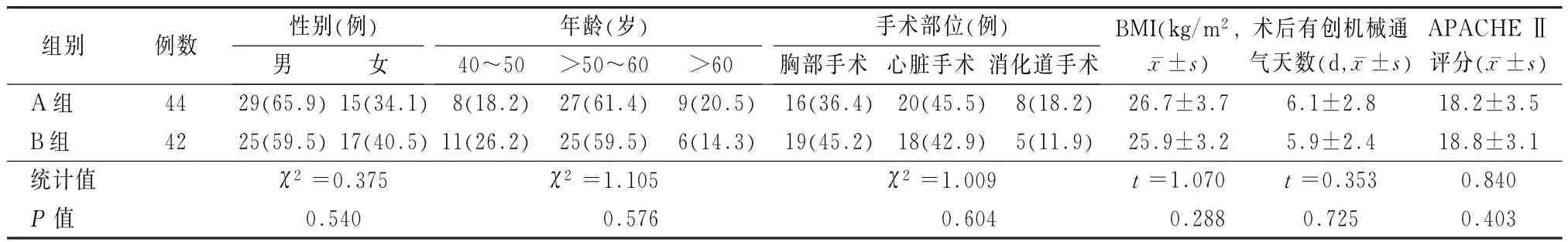
表1 两组患者无创通气前基础特征比较
A组:采用新西兰Fisher&Paykel公司的经鼻高流量湿化氧疗系统及配套Optiflow双腔鼻导管进行HHFNC辅助通气,设置功能参数:吸入氧浓度(forced inspiratory oxygen,FiO2)40%~50%,湿化温度37℃,初始吸入气体流量40 L/min,根据患者耐受程度逐步上调吸入气体流量,最大可至70 L/min,至患者意识清醒、自主呼吸频率维持至30次min、经鼻导管吸氧(FiO2≤40%)SpO2>90%、PaO2>60 mm Hg或氧合指数(PaO2/FiO2)>200时停止H HFNC通气。
B组:采用美国伟康公司面罩式双水平无创正压呼吸机(BIPAP ST/30型)辅助通气,参数设置:S/T模式,初始吸气压力(inspiratory positive airway pressure,IPAP)10~12cm H2O(1 cm H2O=0.098 k Pa),1 h逐步升至14~18 cm H2O,呼气压力(expiatory positive airway pressure,EPAP)5 cm H2O,吸入氧流量3~5 L/min,吸入氧浓度FiO240%~50%,使SpO2维持在90%以上。病情好转后逐渐下调IPAP、EPAP至5cm H2O,改用鼻导管吸氧,待自主RR、血气指标稳定后脱机。
在上述治疗2 h后,若患者呼吸困难症状进行性加重、意识不清;HR增快>150%或减慢、血流动力学不稳定;提高FiO2≥60%1 h后PaO2<50 mm Hg和/或PaCO2>70 mm Hg[8]则停止无创辅助通气,果断给予二次气管插管行有创通气。
1.3 观察指标 观察并记录两组拔管后ARF患者无创辅助通气前与辅助通气治疗2 h后基础生命体征[迈瑞PM8000型心电监护仪测定RR、心率(heart ratio,HR)、SpO2]与股动脉血气分析[罗氏cobas b123型血气电解质分析仪测定股动脉血PaO2、PaCO2]结果,记录两组无创辅助通气时间、再插管行有创通气例数、再插管患者中VAP发生及病死例数。其中,VAP定义为:气管插管及机械通气后发生的肺炎[7]。
1.4 统计学分析 应用SPSS 19.0软件进行统计学处理,生命体征与动脉血气分析等定量指标均符合正态分布,用±s表示,组间定量指标比较采用t检验;二次插管率、VAP发生率、病死率等定性指标用[例(%)]表示,组间定性指标比较采用χ2检验,不满足条件的四格表数据比较采用fisher精确概率法,检验效能α=0.05。
2 结果
2.1 生命体征与动脉血气指标改善情况比较 无创通气治疗2 h,两组患者HR、RR、SpO2、PaO2、PaCO2均较无创通气前改善;A组SpO2、PaO2上升幅度与RR、PaCO2下降幅度均显著高于B组,差异有统计学意义(P<0.05),见表2。
2.2 无创通气时间与再插管比例比较 A组治疗有效者无创通气时间显著少于B组(P<0.05)。A、B两组通气过程中分别有5例、7例治疗无效,重新行气管插管,二次插管患者分别发生VAP2例、3例,死于多器官功能衰竭各1例。两组无创通气后再插管比例、VAP发生率与病死率差异无统计学意义(P>0.05)。
表2 两组患者无创通气治疗前与治疗2 h生命体征和动脉血气结果比较(±s)
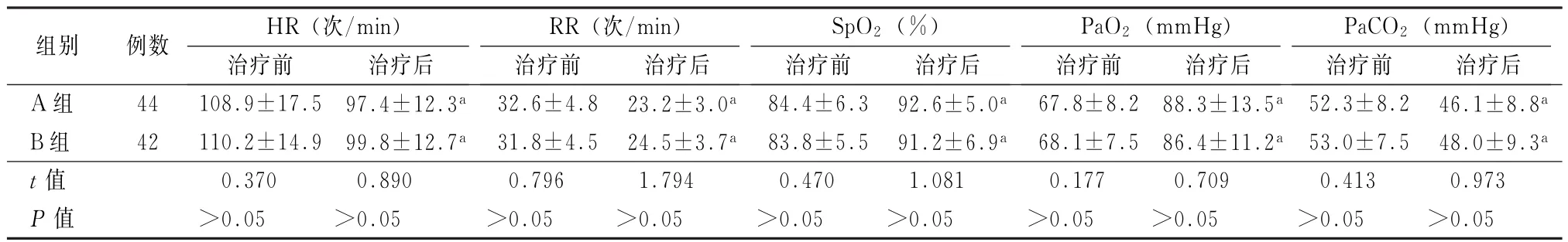
表2 两组患者无创通气治疗前与治疗2 h生命体征和动脉血气结果比较(±s)
注:HR为心率;RR为呼吸频率;SpO2为血氧饱和度;1 mm Hg=0.133 k Pa;与治疗前比较,a P<0.05
组别例数HR(次/min)RR(次/min)SpO2(%)PaO2(mm Hg)PaCO2(mmHg)治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后A组44 108.9±17.5 97.4±12.3a 32.6±4.8 23.2±3.0a 84.4±6.3 92.6±5.0a 67.8±8.2 88.3±13.5a 52.3±8.2 46.1±8.8a B组42 110.2±14.9 99.8±12.7a 31.8±4.5 24.5±3.7a 83.8±5.5 91.2±6.9a 68.1±7.5 86.4±11.2a 53.0±7.5 48.0±9.3a t值0.370 0.890 0.796 1.794 0.470 1.081 0.177 0.709 0.413 0.973 P值>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05>0.05
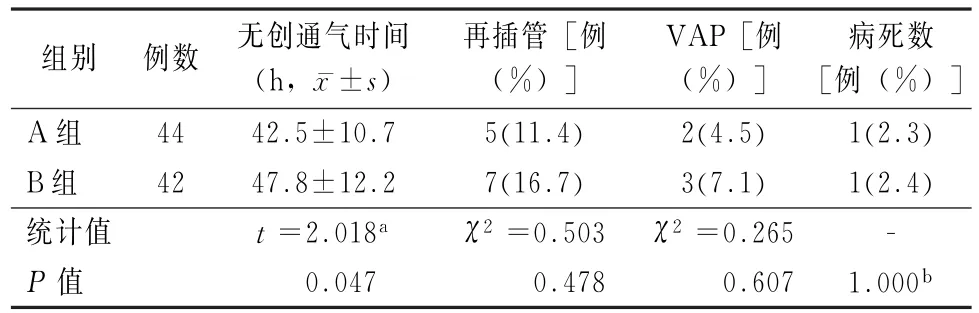
表3 两组患者无创通气时间及临床预后比较
3 讨论
大型外科手术直接损伤胸腹部肌肉组织,加之术后加压包扎限制了呼吸幅度,同时手术麻醉、术后高分解应激、疼痛、有创通气等因素会直接或间接影响呼吸肌运动[9],部分患者在有创通气拔管后依然会出现内源性呼气末正压(positive end expiratory pressure,PEEP)增高和呼吸肌疲劳,导致肺泡有效通气量和潮气量的下降,易发展为ARF[10]。呼吸阻力增大与呼吸运动驱动力不足是ARF的发生的核心机制,NPPV是救治多种病因引起的ARF的有效手段,适宜的NPPV对于减少再插管损伤及相关并发症、缩短ICU滞留时间、减轻患者经济负担具有重要意义。NPPV临床多采用双水平气道正压(bi-level positive airway pressure,BiPAP)或持续气道内正压(continuous positive airway pressure,CPAP)通气模式,两种模式均是通过施加正压、降低呼吸肌做功、扩张气道、改善肺泡萎陷而达到增加呼气末肺容积,改善SpO2的目的。其中,BiPAP通过设置一个较高的吸气压和一个较低的呼气压,能更好地辅助自主呼吸,增加肺的顺应性,减少呼吸肌做功,改善肺通气和换气功能[11]。本研究中,B组患者在使用BiPAP治疗2 h后,生命体征与动脉血气指标均较BiPAP通气前改善,使83.3%的患者避免了二次插管或气管切开。
HHFNC是一种新型的无创辅助通气方式,既往较少应用于成年人,该系统通过空氧混合器能提供精确的FiO2(21%~100%),提供最高达70 L/min的气体流量,且能通过单回路管路对流经气体进行加温加湿,提供37℃相对湿度100%的气体。既往研究表明:H HFNC的高流速混合气流量超过多数呼吸功能衰竭患者的吸气流量峰值,由此产生类似PEEP的作用,能有效冲刷鼻咽部及上呼吸道的生理死腔,促进肺部氧合和二氧化碳交换[12];同时能降低呼吸阻力与呼吸肌吸气做功[13],增加呼吸系统末端膨胀压力,复张肺泡,增加氧分子弥散,改善通气/血流比[14]。在每分通气量相同条件下,HHFNC较其他通气方式能有效增加肺泡通气量比例,提高肺换气效率[15]。此外,HHFNC能对混合气进行全程主动加温、加湿,确保患者气道处于近似生理湿化状态,活跃气道纤毛运动,有效稀释痰液,有助于保持呼吸道通畅,改善肺通气,且大大简化了吸痰工作量[16];该系统的主动加温加湿功能还能节约人体对吸入气体进行加温加湿所需的热量[17]。OptiFlow双腔鼻导管输送气体不需要密闭回路,不会对鼻中隔及口面部造成明显的压迫,与面罩、普通鼻导管等装置相比,患者舒适度及依从性较高[18]。总之,HHFNC通过高流量混合气体的输送,能降低呼吸做功、增加呼气末肺容积、改善患者氧合。
Roca等[19]报道,HHFNC治疗20例ARF,患者PaO2、RR较氧气面罩显著提高,而PaCO2则差异无统计学意义。Stéphan等[20]报道,414例心脏手术患者拔管后ARF患者行HHFNC支持的再插管率(21.0%比21.9%)、病死率(5.5%比6.8%)与416例行BIPAP支持的患者接近,而治疗24 h后皮肤破溃比例显著低于BIPAP组(3%比10%),得出结论H HFNC治疗心脏手术拔管后ARF的效果至少不差于BIPAP。国内学者对29例、24例术后脱机拔管后ARF患者分别采用HHFNC与CPAP治疗,结果提示前者再插管率显著低于后者(20.7%比45.8%)(χ2=3.81,P<0.05)。本研究无创通气治疗2 h,两组患者基础生命体征和股动脉血气指标均较NPPV治疗前改善,分别使88.6%和88.3%的患者避免了二次插管,说明H HFNC与BiPAP均是治疗拔管后ARF的有效手段,而HHFNC组治疗2 h后SpO2、PaO2上升幅度与RR、PaCO2下降幅度均显著高于B组,且治疗有效者无创通气时间亦显著少于B组,据此可推测H HFNC较BiPAP治疗拔管后ARF效果更佳;两组再插管率、VAP发生率、病死率差异虽无统计学意义,但HHFNC已表现出相对优势的趋势,故笔者支持HHFNC较BiPAP治疗拔管后ARF具有相对优势的结论。本研究中HHFNC在二次插管率、VAP发生率等方面的优势表现的不甚明显,笔者认为这可能与研究的样本量较小有关,伴随样本量的增加,这种趋势可能更加明显。笔者观察出现上述差异的原因之一可能与HHFNC使用的optiflow鼻导管及鼻塞有关,optiflow能更好地适应上呼吸道的生理功能,无需密闭回路便可形成较高的PEEP,能保证恒定浓度的混合气供应,而后者则需要密闭回路才能实现PEEP,这需要鼻(面)罩的完美贴合,一旦漏气则难以确保气道内正压的持续稳定性,且患者的耐受性大打折扣。
有效落实气道护理管理是避免手术拔管后ARF发生和HHFNC施治的基础。为此需注意如下方面:(1)充分的预脱机试验是确保IPPV脱机成功及避免ARF的前提。在对IPPV患者生命体征、动脉血气、意识、感染情况进行充分评估并认定符合脱机条件基础上,必须进行1~2 h的自主呼吸试验(spontaneous breathing trial,SBT)与气囊漏气试验,最好连续两次SBT成功且气囊漏气试验阴性,方可脱机;(2)H HFNC治疗前选择合适的optiflow管道与头带。Optiflow管道根据鼻塞孔径分为S、M、L号,以选择孔径超过50%鼻孔内径的鼻塞为宜,可有效减少漏气;同时,鼻导管的头带应松紧适宜,太松难以确保气道正压效果,太紧则影响患者的舒适性与耐受性;(3)HHFNC治疗中确保患者口腔闭合。在同一混合气流速下,HHFNC患者口腔开放时PEEP较口腔闭合时显著下降[21]。因此,在HHFNC治疗前与治疗中要叮嘱患者闭合口腔,以确保较高的气道压力,确保通气效果;(4)HHFNC治疗中加强护理巡视,果断履行插管操作。H HFNC治疗ARF的适宜对象、治疗时间及何时需要将NPPV转换为IPPV治疗目前尚无定论[22],研究显示当NPPV治疗2 h后,PaO2/FiO2<150 mm Hg是转为IPPV的临床指征[23],这意味气道压力不能维持患者的功能残气量,因此,治疗中要密切关注患者生命体征、氧合情况、咳嗽症状,若患者行HHFNC治疗2 h后呼吸频率、血氧饱和度没有得到明显改善,则应立即改行有创通气,及时进行气管插管或切开,建立人工气道。
综上所述,笔者认为对手术拔管后ARF患者实施HHFNC能快速改善氧合及减轻二氧化碳潴留,减少通气时间,临床效果不次于BiPAP。HHFNC操作前后需加强气道管理,确保HHFNC的有效实施。但本研究样本量较小,HHFNC较BiPAP对降低再插管与VAP风险的优势不明显,HHFNC对成人ARF的救治效果仍有待大样本的系统性评估。
利益冲突所有作者均声明不存在利益冲突

