MiR-449a和PLAGL2在卵巢癌中的表达关系及临床意义
王秋宇 李晓翔 朱军义
卵巢癌好发于50~60岁的绝经后女性,在妇科恶性肿瘤排名第三位,是临床上较为常见的女性生殖器官恶性肿瘤疾病[1,2]。国际癌症研究中心报道指出,全世界每年有70万新增卵巢癌患者,其病死率为18.78/10万,占恶性肿瘤死亡病例的18.09%,2013年全球卵巢癌标化发生率为37.68/10万,标化病死率为10.18/10万[3,4]。因此深入探讨卵巢癌的发病机制对卵巢癌患者的早期诊断、治疗以及提高患者的生存质量具有重要的意义。miRNA与肿瘤的发生、发展、凋亡也有有着密切的联系。MiR-449a可通过抑制蛋白激酶B信号通路进而抑制肿瘤内皮细胞增殖和集落形成。MiR-449a对免疫系统调控、血管生成和肿瘤转移等方面发挥着重要作用[5,6]。研究证实MiR-449a基因突变时,表达降低时,肿瘤细胞无限制増殖、血管生成速度加快,且相关细胞因子如VEGF、P53等均表达增高。多形性腺瘤基因锌指蛋白2(pleomorphic adenoma gene 2,PLAG2)是促癌蛋白,其突变率为3%~11%,当其突变时,肿瘤细胞无限制増殖、血管生成速度加快,PLAG2基因突变在癌症的早期就会出现,且PLAG2基因状态不受药物治疗的阻断[7,8]。目前关于MiR-449a和PLAGL2表达与卵巢癌关系的研究较少,本研究拟检测MiR-449a和PLAGL2在卵巢癌组织中的表达水平,探讨其与临床病理参数和预后的关系。
资料与方法
1.一般资料:选取2011年1月~2015年2月在笔者医院妇科行手术治疗并经病理证实的卵巢癌患者136例,患者年龄为40~74岁,平均年龄57.5±17.8岁,病程为9个月~4年,其中绝经妇女64例、未绝经妇女72例、未分化癌4例、子宫内膜样癌6例、透明细胞癌6例、混合型腺癌20例、浆液性腺癌82 例、黏液性腺癌18例。所有患者符合美国国家综合癌症网(NCCN)公布的2013版《Ovarian cancer, version 2.2013》中关于卵巢癌的诊断标准[9]。手术切除标本后行病理检查以判定肿瘤最大径、病理学分级、TMN分期、浸润深度、有无淋巴血管间隙浸润、有无淋巴结转移。同时取距卵巢癌组织5cm以上的正常卵巢组织为癌旁组。患者自愿提供正常卵巢组织及卵巢癌组织标本,用作分析MiR-449a、PLAGL2蛋白的表达。纳入标准:既往无精神障碍史,无心理疾患或精神疾病史;本研究经笔者医院医学伦理学委员会审批,所有患者(或患者直系亲属)均签署知情同意书。排除标准:肝脏、肾脏、心功能异常者,感染性疾病、甲状腺疾病、入院前接受放射治疗化学治疗的其他恶性肿瘤、胆汁淤积、自身免疫性疾病。
2.主要仪器和试剂:超净工作台(上海恒跃医疗器械有限公司)、MiR-449a、PLAGL2 Elisa试剂盒购自武汉华美生物科技有限公司、热电MK3酶标仪、MiR-449a、PLAGL2一抗购自上海邦奕生物科技有限公司、免疫组化二抗试剂盒、抗体稀释液、DAB显色试剂盒购自南京森贝伽生物科技有限公司。
3.ELISA测定MiR-449a、PLAGL2蛋白水平:所有实验操作均为无菌操作,实验所有器具高压灭菌,37℃烘干。将保存在-70℃冰箱中的正常卵巢组织、卵巢癌组织取出解冻。称取0.5g正常卵巢组织、卵巢癌组织,加入少量液氮,在微波碾磨仪(5000r/s)中迅速将其碾碎至粉末状;将组织粉末转入1ml Eppendorf管中,加入0.8ml PBS(pH值为7.4),充分振荡混匀,2000×g,4℃,离心20min。仔细收集上清液。获取正常卵巢组织、卵巢癌组织匀浆后,采用Elisa法检测正常卵巢组织、卵巢癌组织的MiR-449a、PLAGL2蛋白表达量。
4.MiR-449a、PLAGL2在正常卵巢组织、卵巢癌组织的表达水平的测定:免疫组化法测定MiR-449a、PLAGL2在正常卵巢组织、卵巢癌组织中的表达,制作常规5μm的正常卵巢组织、卵巢癌组织石蜡切片,3%的H2O2液常温阻断内源性过氧化氢酶活性,微波修复抗原,PBS常规冲洗,1%的MiR-449a、PLAGL2抗体工作液(稀释浓度1∶200)购自英国Abcam公司,4℃过夜,加入二抗(IgG),室温30min,加链霉素抗生物素蛋白-过氧化物,PBS冲洗,DAB显色,苏木素复染,(50%、60%、80%、90%、95%、100%)梯度乙醇脱水,二甲苯透明,封片。随机选取5个高倍视野(×400)计数,无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分,同时计数;>50% 为(+++),26%~50%为(++),6%~25% 为(+),阳性细胞≤5%为(-),(-)及(+)归为不表达组或低表达组即为阴性,(++)及(+++)归为高表达组即为阳性。

结 果
1.癌旁组、卵巢癌组中MiR-449a、PLAGL2蛋白水平表达:由表1可见,卵巢癌组MiR-449a蛋白表达水平低于癌旁组,PLAGL2蛋白表达水平高于癌旁组(t=113.821、88.774,P<0.01)。
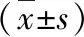
表1 癌旁组、卵巢癌组中MiR-449a、PLAGL2蛋白水平的表达
2.癌旁组、卵巢癌组中MiR-449a、PLAGL2表达的相关性:由表2、图1可见,卵巢癌组MiR-449a阳性率低于癌旁组、PLAGL2阳性率高于癌旁组(χ2=18.708、151.786,P<0.01)。
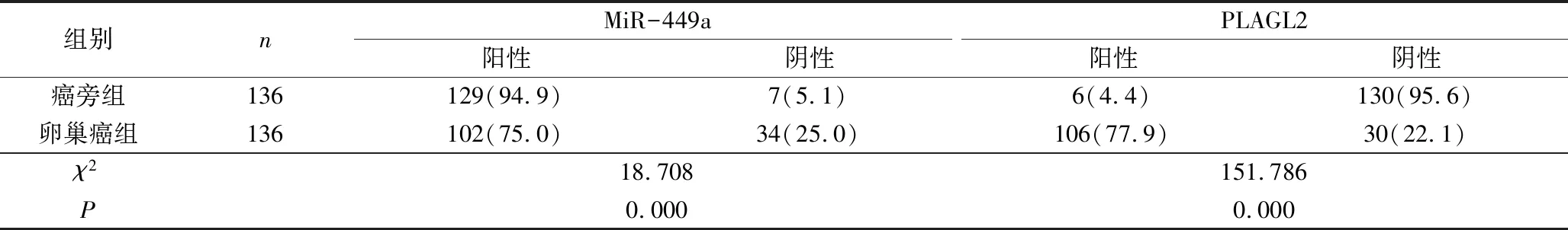
表2 不同临床病理特征组中MiR-449a、PLAGL2表达的相关性分析[n(%)]
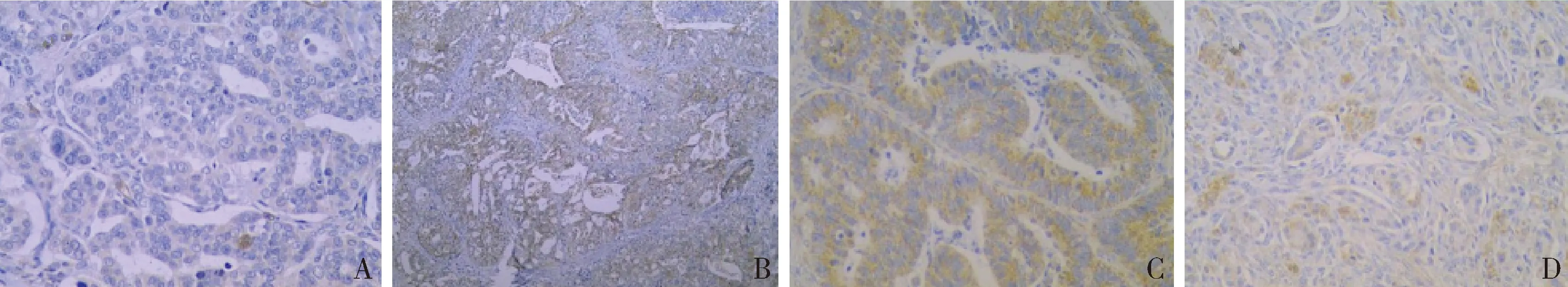
图1 MiR-449a、PLAGL2在癌旁组、卵巢癌组的表达(免疫组化法,×400)
3.MiR-449a、PLAGL2蛋白表达与临床病理特征的关系:由表3可见,MiR-449a、PLAGL2蛋白表达与年龄相关性不明显(χ2=0.348、2.429,P>0.05);与肿瘤最大径、病理学分级、TMN分期、浸润深度、淋巴血管间隙浸润、淋巴结转移、复发相关性明显,且肿瘤最大径≥5cm、病理学分期越高、TMN分期越高、浸润深度越深、有淋巴血管间隙浸润、有淋巴结转移、有复发,MiR-449a蛋白阳性表达率越低、PLAGL2蛋白阳性表达率越高(χ2=21.889、17.231、32.026、24.764、49.788、13.782、23.791、15.460、19.436、20.424、17.352、15.631、36.560、23.042,P<0.01)。
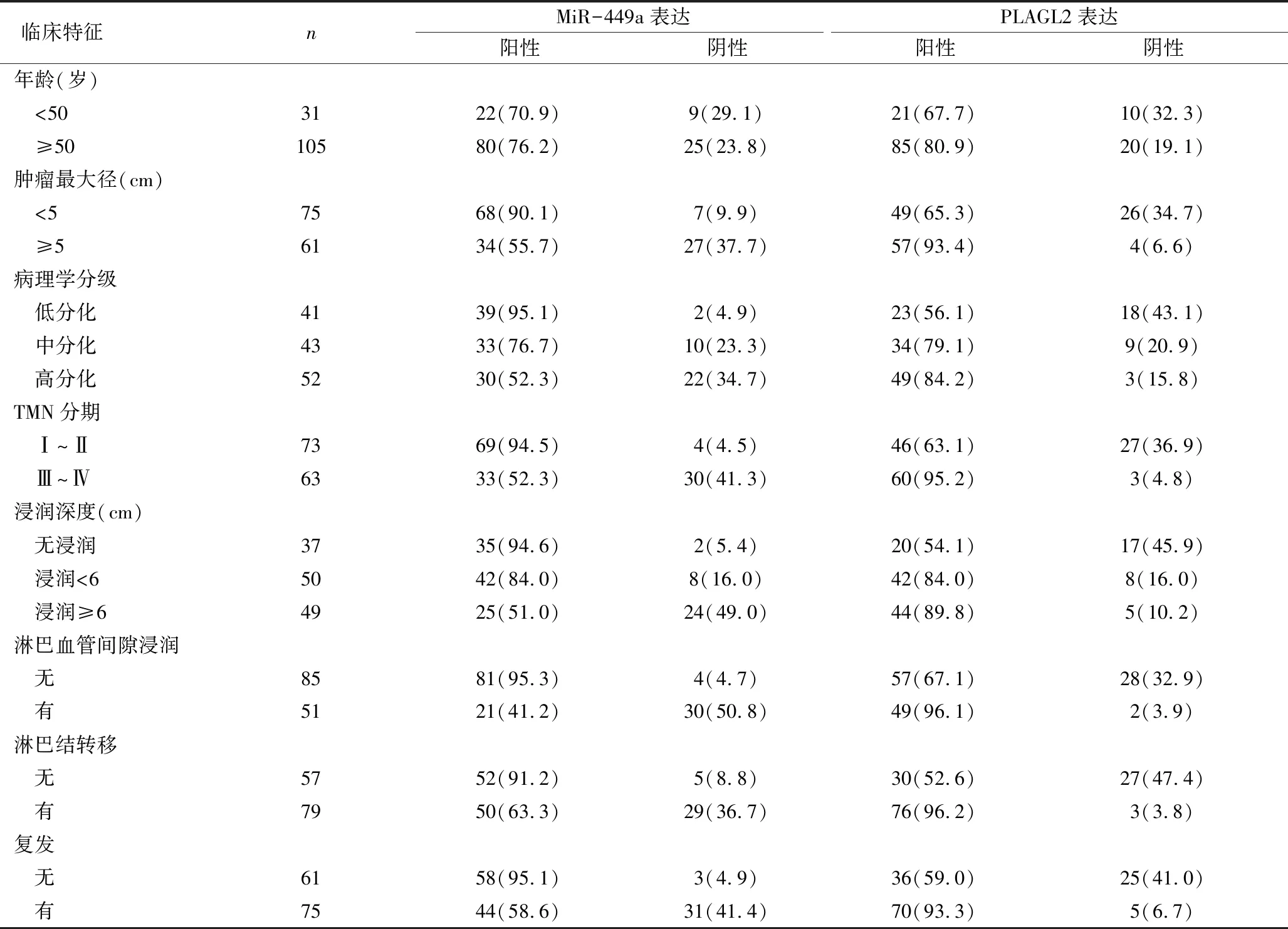
表3 MiR-449a、PLAGL2蛋白表达与临床病理特征的关系[n(%)]
4.MiR-449a、PLAGL2蛋白表达水平与卵巢癌患者预后分析:由表4及图2可见,MiR-449a阳性组3年生存率及生存期均明显高于MiR-449a阴性组,PLAGL2阴性组3年生存率及生存期均明显高于PLAGL2阳性组(χ2=41.666、37.816、Z=17.980、18.092,P<0.01)。

表4 MiR-449a、PLAGL2蛋白表达水平与卵巢癌患者预后分析
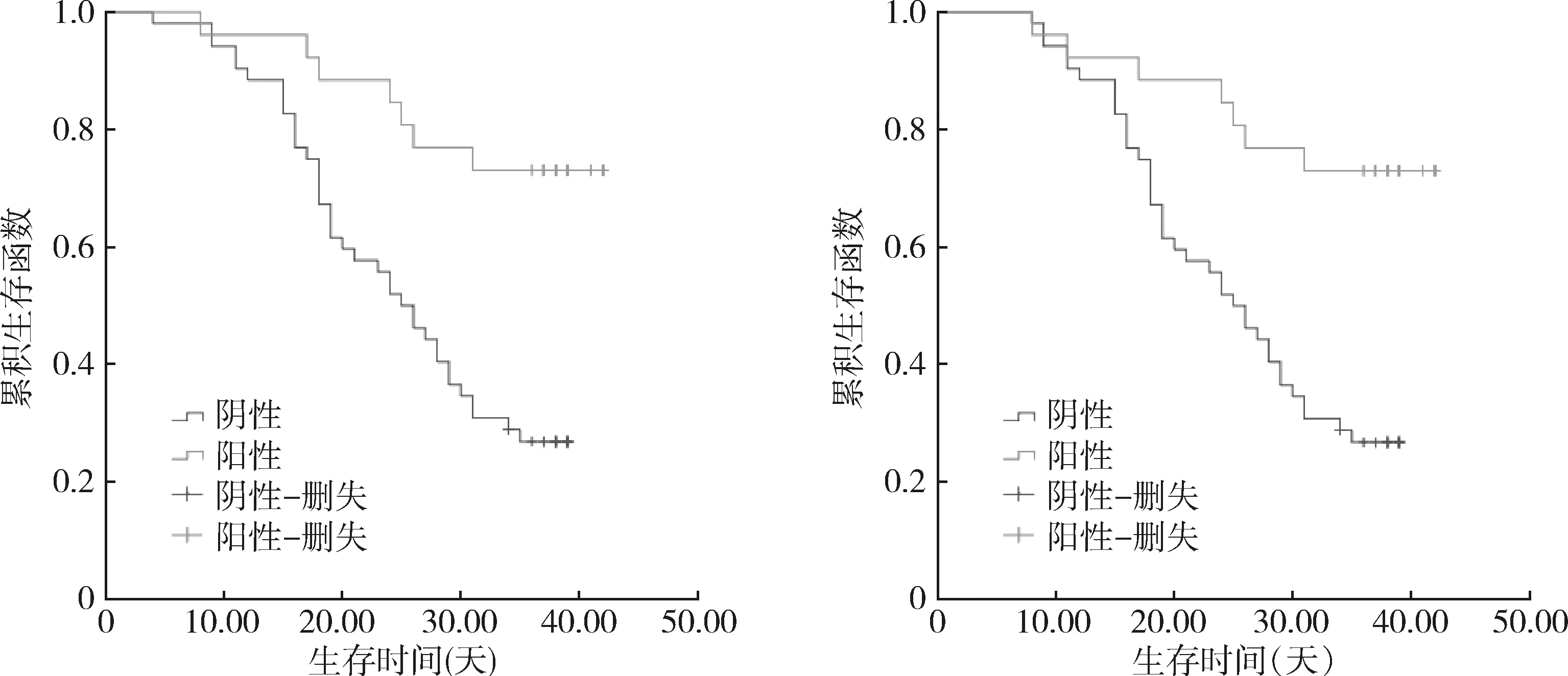
图2 MiR-449a、PLAGL2阳、阴组生存曲线
讨 论
MiR-449a在肿瘤的发生、发展中扮演者重要的角色,MiR-449a在Hedgehog 信号通路扮演着核心调节作用,配体(Shh)未与跨膜蛋白受体(Ptch)结合时,Ptch 抑制跨膜蛋白受体 (Smo)的活化,Smo 被释放,其下游细胞因子MiR-449a被活化,促进MiR-449a移位到细胞核内,进而抑制下游原癌基因[12]。此外低表达MiR-449a蛋白的肿瘤细胞黏附内皮细胞的能力强,而肿瘤细胞与内皮细胞紧密结,才能穿过细胞外基质层,建立转移灶[10,11]。体外试验已证实,MiR-449a能抑制癌细胞增殖,并能强烈促进细胞凋亡,高度表达MiR-449a的乳腺癌细胞株增殖能力明显低于野生株[12]。本研究中卵巢癌组MiR-449a水平低于癌旁组,卵巢癌组MiR-449a阳性率低于癌旁组,且肿瘤最大径≥5cm、病理学分期越高、TMN分期越高、浸润深度越深、有淋巴血管间隙浸润、有淋巴结转移、有复发,MiR-449a表达越低,也与上述讨论符合,同时也说明MiR-449a具有抑制癌细胞分化与侵袭迁移能力的作用。本研究同时也发现,MiR-449a阳性组3年生存率及生存期均明显高于MiR-449a 阴性组,MiR-449a高表达能明显提高卵巢癌患者预后。
PLAGL2是原癌基因,其结构、功能的异常与遗传性及散发性肿瘤均相关。近年来国外人群流行病学研究显示,在乳腺癌的发病过程中,MiR-449a的过度表达会明显下调PLAG2的表达,进而对乳腺癌细胞的分化及迁移起到抑制作用[13]。此外,PLAGL2在调节人体细胞的复制、遗传物质DNA损伤修复、细胞的正常生长方面有重要作用。遗传基因学发现PLAGL2过表达是引发大部分遗传性肿瘤的主要原因。PLAGL2是Wnt信号通路的重要组成部分,其通过与膜结合钙黏素结合形成复合体,定位与细胞骨架,维持组织细胞结构的稳定性[14~16]。研究表明,若Wnt信号通路异样,则PLAGL2过表达,胞质内游离的β-catenin进入胞核,激活下游癌基因(P53、Ras等),促进癌细胞增殖。本研究中,卵巢癌组PLAGL2水平高于癌旁组,卵巢癌组PLAGL2阳性率高于于癌旁组,这与上述结论一致。研究还发现,IL-8、血管内皮生长因子 (VEGF)由可能由PLAGL2调控,高表达PLAGL2蛋白的肿瘤细胞可分泌更多的IL-8、血管及VEGF,而VEGF、IL-8在供应肿瘤生长的血管系统的形成及实体肿瘤的发展过程中发挥重要作用[17]。
本研究中,肿瘤最大径≥5cm、病理学分期越高、TMN分期越高、浸润深度越深、有淋巴血管间隙浸润、有淋巴结转移、有复发,PLAGL2表达越高,也证实了这一点。此外,PLAGL2基因突变一般发生于肿瘤的早期。PLAGL2基因突变后,处于高度活化状态,且不受EGFR信号通路的调控,即使用EGFR拮抗剂阻断了上游信号转导,突变的PLAGL2的仍可发挥其促肿瘤增殖作用, EGFR拮抗剂对PLAGL2基因突变的恶性肿瘤患者不能发挥抗肿瘤作用[18]。本研究中PLAGL阴性组3年生存率及生存期均明显高于PLAGL 阳性组,推测PLAGL具有促进癌细胞分化与侵袭迁移能力的作用,PLAGL高表达能明显降低卵巢癌患者预后,与上述讨论一致。近期研究表明,PLAGL2蛋白对于肿瘤的发生、发展具有重要的调控作用,其具有时间、空间表达特异性,若药物抑制PLAGL2蛋白表达,肿瘤细胞的生长得到有效抑制,PLAGL2可能成为肿瘤治疗的分子靶点,这有待于进一步研究证实[19]。
综上所述,MiR-449a在卵巢癌的发生、发展过程中起抑制作用,PLAGL2起促进作用;MiR-449a蛋白在卵巢癌组织中表达量降低,PLAGL2蛋白表达量增加;MiR-449a蛋白高表达的卵巢癌患者能获得较好的预后,PLAGL2蛋白低表达能获得较好的预后。

