蜂房哈夫尼亚菌对粘质沙雷氏菌群体感应信号分子产生与生物被膜形成的调控
李婷婷,高娜娜,于海凤,国竞文,王当丰,励建荣,*,黄建联
(1.大连民族大学生命科学学院,生物技术与资源利用教育部重点实验室,辽宁 大连 116600;2.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;3.福建安井食品股份有限公司,福建 厦门 361022)
群体感应是一种微生物细胞与细胞间的通讯方式,细菌通过自身产生的一些信号分子感知环境中与其共存细菌产生的信号分子,当信号分子质量达到一定浓度时启动细菌中相关靶标基因的表达,调控微生物的特定功能,如运动性介导的铜绿假单胞菌与根癌土壤杆菌在生物膜共培养中的相互作用、荧光假单胞菌胞外酶的分泌及霍乱弧菌毒力因子的表达等[1-3]。革兰氏阴性菌一般由LuxR/LuxI型系统调控,以N-酰基高丝氨酸内酯(N-acyl homoscrinc lactones,AHLs)为信号分子;革兰氏阳性菌的信号分子一般为寡肽类化合物(autoinducing peptides,AIPs);AI-2是细菌种间交流的信号分子,其结构是一种呋喃硼酸二酯类物质[4-6]。此外,细菌还存在其他群体感应系统[7]。
蜂房哈夫尼亚菌(Hafnia alvei)命名为H. alvei-14,属于肠杆菌科哈夫尼亚属,革兰氏阴性菌,主要存在于污水、乳制品、土壤、人和动物粪便中,是一种细菌性污染菌[8]和条件致病菌[9]。粘质沙雷氏菌(Serratia marcescens)命名为S. marcescens-01,属于沙雷氏菌属,革兰氏阴性菌,是肠杆菌科的一种条件致病菌,存在于水、土壤、动植物及人类的肠道和呼吸道中,能够产生核酸酶、蛋白酶、脂肪酶等次级代谢产物,对人类存在潜在伤害[10]。
导致水产品腐败的实际环境为多菌种混杂共存并相互影响,单菌落存在的可能性非常小[11-12]。但目前多集中在单菌种的研究上,对基于群体感应的2 株菌共培养体系的研究缺乏有效的方法和理论指导,对菌与菌之间生态关系及群体感应方面的共生机理仍不清楚。而微生物生长特性的表达受生长阶段、营养状态等环境因素的影响,环境条件的改变会调控细菌群体感应活性,进而影响AHLs的分泌和生物被膜的形成。本实验拟从腐败鲈鱼中分离到的2 株具有群体感应现象的H. alvei-14和S. marcescens-01为研究对象,探讨在不同NaCl浓度、碳源、氮源、起始pH值条件下,与蜂房哈夫尼亚菌共培养的粘质沙雷氏菌AHLs产生和生物被膜形成能力,旨在研究菌株在共培养条件下AHLs的分泌规律和生物被膜的形成能力,为水产品的保鲜和腐败菌的防治提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
鲜活海鲈鱼购于锦州市林西水产市场,平均质量(1.5±0.5)kg。
供试菌株:从腐败鲈鱼中分离所得,经16S rRNA序列比对鉴定为H. alvei-14和S. marcescens-01;报告菌株:紫色杆菌CV026(Chromobacterium violaceum CV026)、根癌农杆菌A136(Agrobacterium tumefaciens A136),均由本实验室保藏。菌株均在LB液体培养基中,28 ℃、160 r/min摇床振荡培养,CV026活化时需添加20 μg/mL卡那霉素,A136需涂布20 mg/mL 5-溴-4-氯-3-吲哚-β-D-半乳糖苷(5-bromo-4-chloro-3-indolyl β-D-galactopyranoside,X-gal)。
1.1.2 试剂
信号分子标准品(C4-HSL、C6-HSL、C8-HSL、C10-HSL、C12-HSL、C14-HSL) 美国Sigma公司;卡那霉素国药集团化学试剂有限公司;细菌基因组DNA提取试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)引物 生工生物工程(上海)股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
PCR仪 德国Eppendorf公司;Quantity One凝胶成像系统、imark酶标仪 美国Bio-Rad公司;HZQ-X300C型恒温振荡器、BPS-100CA恒温恒湿培养箱 上海一恒科技有限公司;MS105UD电子分析天平 瑞士梅特勒-托利多有限公司;Purifier Logic生物安全柜 美国Labconco公司;MLS-3020高压蒸汽灭菌机 日本三洋公司;Biofuge Stratos冷冻高速离心机美国Thermo公司。
1.3 方法
1.3.1 菌落分离和纯化
购买鲜活鲈鱼碎冰猝死,用无菌蒸煮袋包装,置于4 ℃冰箱冷藏至腐败,于无菌条件下称取10 g腐败鱼肉剪碎,加90 mL无菌生理盐水摇匀制成菌悬液,进行梯度稀释,选择合适的稀释度吸取1 mL于无菌平皿中,及时将15~20 mL平板计数琼脂培养基倾注平皿,并转动平皿使其混合均匀,待琼脂凝固后置于37 ℃进行培养。挑选各典型菌落,反复连续划线,得到单菌落。初筛具有群体感应现象的菌株。
1.3.2 细菌16S rRNA序列测定
取初筛菌株过夜活化,取1 m L新鲜菌液离心(10 000 r/min、10 min),留菌体。按照细菌基因组D N A快速抽提试剂盒方法提取基因组D N A作为1 6 S r R N A序列扩增反应模板,2 7 F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492 R(5′-ACGGCTACCTTGTTACGACTT-3′)为引物进行PCR扩增。PCR程序:94 ℃、4 min,94 ℃、30 s,58 ℃、30 s,72 ℃、95 s,共30 个循环后,72 ℃、10 min。PCR产物进行0.1%琼脂糖凝胶电泳,然后送至生工生物工程(上海)股份有限公司测序,将测序结果与NCBI数据库进行比对。
1.3.3 AHLs活性检测
1.3.3.1 初步检测AHLs
平行划线法[13]:报告菌株CV026和A136与供试菌株活化后,在LB营养琼脂平板上平行划线,以报告菌株做阴性对照,C6-HSL作阳性对照。28 ℃过夜培养,观察颜色变化。
平板扩散法[14]:报告菌株CV026和A136过夜活化,与LB营养琼脂混匀并倒入已放好牛津杯的平板中,待其凝固后,加入150 µL/孔的AHLs粗提物,28 ℃恒温培养24 h,观察颜色变化。
1.3.3.2 气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用技术定性检测AHLs
分别将6 种AHLs标准品(C4-HSL、C6-HSL、C8-HSL、C10-HSL、C12-HSL和C14-HSL)溶于甲醇中配制为质量浓度200 µg/mL的混合溶液,-20 ℃保存备用,用于GC-MS检测。
制备AHLs粗提物:参考綦国红等[15]方法,将供试菌株在LB液体培养基中28 ℃、160 r/min振荡培养至对数期,离心(10 000 r/min、10 min)取上清液,用含0.01%冰乙酸的乙酸乙酯溶液等体积混合萃取3 次,混合有机相旋蒸至干,甲醇溶解,-20 ℃保存备用。
1.3.4 不同培养条件下产AHLs能力检测
将H. alvei-14和S. marcescens-01活化后,分别接种到10 mL LB培养基中,并在28 ℃振荡(160 r/min)培养到光密度(OD595nm)为0.5左右。然后按S. marcescens-01和H. alvei-14体积比1∶1和1∶3混匀后以1%的总接种量接种在不同液体培养基中,28 ℃、160 r/min摇床培养24 h后,取200 µL培养菌液测定AHLs诱导的变色圈直径(mm),每组3 个平行。
不同液体培养基分别为:不同NaCl质量分数(0%、0.5%、1%、1.5%、2%、3%、4%)的液体培养基,不同pH值(5、6、7、8、9)的LB液体培养基,不同碳源(乳糖、蔗糖添加量为5.0 g/L,葡萄糖、果糖、木糖、麦芽糖添加量为5.26 g/L)的AB培养基(3.0 g/L K2HPO4,1.0 g/L NaH2PO4,1.0 g/L NH4Cl,0.3 g/L MgSO4·7H2O,0.15 g/L KCl、0.01 g/L CaCl2,0.002 5 g/L FeSO4·7H2O,酪蛋白水解氨基酸5.0 g/L),不同氮源(氯化铵、胰蛋白胨、酵母浸粉、尿素)的液体培养基。
1.3.5 S. marcescens-01生物被膜的形态观察
将菌悬液稀释100 倍添加在灭菌后的培养皿中,然后分别放入打磨后的锌片,28 ℃静置培养适宜的时间后取出锌片,用无菌蒸馏水冲洗数遍,置于4 ℃预冷的2.5%戊二醛溶液中浸泡4 h,进而梯度乙醇脱水,再经醋酸异戊酯置换2 次,15 min/次,取出后放入紫外灭菌后的超净台内自然风干。样品喷金后,经过扫描电子显微镜观察。
1.3.6 不同培养条件下生物被膜的培养及测定
将H. alvei-14和S. marcescens-01活化后,分别接种到10 mL LB培养基中,并在28 ℃振荡(160 r/min)培养到光密度(OD595nm)为0.5左右。H. alvei-14和S. marcescens-01用不同液体培养基(同1.3.4节方法)稀释100 倍后,按S. marcescens-01与H. alvei-14体积比1∶1和1∶3混匀后在96 孔板中28 ℃培养,每组3 个平行,以液体培养基为对照。培养48 h后采用结晶紫染色的方法在595 nm波长处测定光密度。
1.4 数据处理
2 结果与分析
2.1 16S rRNA序列分析与系统发育树的构建

图1 菌株H. alvei- 14和S. marcescens-01的16S rRNA PCR扩增产物电泳图Fig. 1 Electrophorograms of 16S rRNA PCR ampli fi cation products from H. alvei-14 and S. marcescens-01
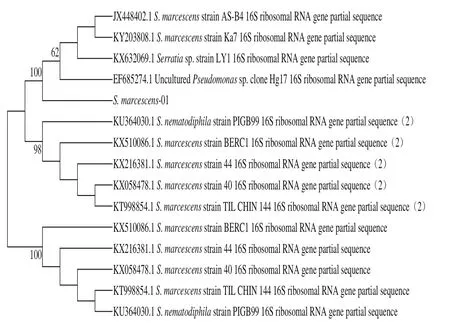

图2 基于16S rRNA基因序列H. alvei- 14和S. marcescens-01的系统发育树Fig. 2 Phylogenic tree based on 16S rRNA sequence analysis of H. alvei-14 and S. marcescens-01
首先以菌株H. alvei-14和S. marcescens-01的总基因组DNA为模板,以细菌的通用引物扩增16S rRNA序列,经PCR特异性扩增,对所获得的PCR产物进行测序(图1)。所测得的菌株H. alvei-14和S. marcescens-01的16S rRNA序列与NCBI数据库进行BLAST比对,发现与蜂房哈夫尼亚菌和粘质沙雷氏菌的相似度高达99%。利用MEGA 5.0软件构建系统发育树如图2所示。
2.2 AHLs检测结果

表1 平行划线法和琼脂扩散法对AHLs的检测Table 1 Identification of AHLs production by parallel streak and agar diffusion methods
由表1可知,供试菌株都能诱导CV026变紫色,诱导A136水解X-gal产生蓝色。H. alvei-14分泌AHLs的能力较S. marcescens-01强。
2 种菌株对不同酰基侧链长度及不同取代基AHLs敏感性不同,平行划线和琼脂扩散法检测与样品中信号分子提取量和浓度有关,仅用于AHLs初步分析,不能确定AHLs种类和定量分析,而GC-MS可用于多种AHLs的定性和定量检测,有灵敏性与准确性更高的优点[16]。
AHLs标准品的出峰时间和顺序如图3A所示,各峰分离良好,峰形尖锐且对称,完全分离开来。从左到右依次为C4-HSL、C6-HSL、C8-HSL、C10-HSL、C12-HSL和C14-HSL,保留时间分别为3.974、5.674、7.629、9.846、12.410、15.398 min。采用选择离子监测模式对未知样品进行检测。通过菌株H. alvei-14粗提液(图3B)、菌株S. marcescens-01粗提液(图3C)的色谱图与AHLs标准品色谱图进行比较,发现菌株H. alvei-14粗提液和菌株S. marcescens-01粗提液可分别检测到C6-HSL和C4-HSL、C6-HSL。
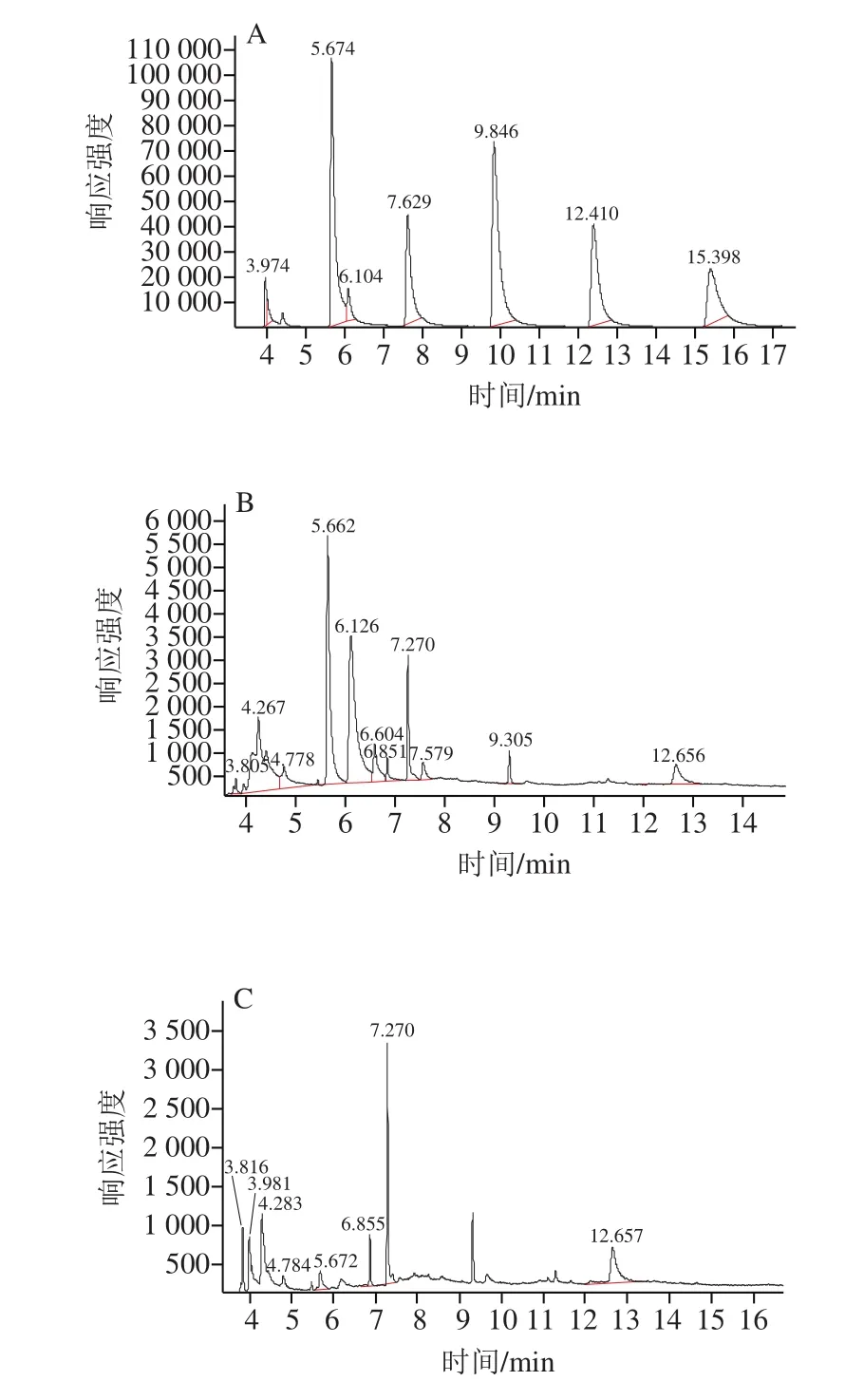
图3 选择离子监测模式下标准品(A)、菌株H. alvei-14粗提液(B)、菌株S. marcescens-01粗提液(C)GC-MS图Fig. 3 GC-MS chromatogram in selected ion monitoring (SIM) mode
2.3 生长动力学曲线

图4 菌株H. alvei- 14和S. marcescens-01的生长动力学曲线Fig. 4 Growth curves of H. alvei-14 and S. marcescens-01
图4 为细菌的H. alvei-14和S. marcescens-01的生长动力学曲线,0~4 h菌株呈指数增长趋势,12~24 h菌株不断生长,菌落数缓慢上升,24 h后随着培养时间的延长,菌株生长较平稳。菌株H. alvei-14生长能力较S. marcescens-01强,但是基本趋势相同。后期实验,采用OD595nm为0.5左右的菌株,此时菌株处于对数期,仍具有较好生长能力,活性较稳定,便于实验研究。
2.4 不同培养条件下AHLs的分泌


图5 不同培养条件下AHLs的分泌Fig. 5 Effects of different culture conditions on secretion of AHLs
如图5A所示,与阴性对照(NaCl为0%)相比,一定NaCl质量分数(0.5%~2%)可刺激菌株分泌AHLs,当质量分数大于2%时,菌株生长受到抑制,AHLs产量明显减少。与对照S. marcescens-01相比,共培养体系在各质量分数下变色圈直径均变大,说明共培养后促进AHLs的分泌。Ravn等[17]研究表明,当NaCl质量分数为3%时,变形斑沙雷氏菌B5a的信号分子分泌量减少,而成团肠杆菌B6a的信号分子分泌量会增加,说明NaCl的质量分数会对菌株分泌信号分子产生不同程度的影响。
如图5B所示,以LB为对照,S. marcescens-01诱导CV026紫色圈直径仅达到20.35 mm;且仅以木糖、果糖为碳源时才能检测到AHLs。共培养体系以葡萄糖、果糖、木糖、麦芽糖为碳源时,产AHLs的能力较强;而对乳糖、蔗糖利用程度较低,产AHLs的能力较弱。Geisenberger等[18]对于铜绿假单胞菌的研究表明,在补充添加0.2%葡萄糖作为唯一碳源时分泌的AHLs种类和含量最高。说明碳源不同,导致菌株分泌信号分子的能力不同。
如图5C所示,S. marcescens-01仅以蛋白胨为氮源时才能检测到AHLs,变色圈直径为19.01 mm。共培养体系以尿素为氮源,菌液密度较大,但分泌信号分子的能力较差;以蛋白胨和氯化铵为氮源,菌体密度较小,但分泌AHLs的量较多。Dandekar等[19]研究比较了380 个可溶氮源中的铜绿假单胞菌AHL合成突变体加或减对AHL的生长,发现在以Glu-Tyr、His-Trp、Tyr-Gly-Gly、Tyr-Phe、Tyr-Trp和Tyr-Tyr作为氮源的信号存在下,生长得到改善。说明在特定氮源存在下,可改善菌株生长,进而调控AHLs的分泌。
如图5D所示,共培养体系在不同pH值下产AHLs能力的趋势与S. marcescens-01相似,在pH 7时分泌信号分子的能力最强,变色圈直径达到最大,pH过低或过高时,菌株生长未受到明显影响,但AHLs分泌能力下降。
2.5 不同时间S. marcescens-01生物被膜扫描电子显微镜观察

图6 不同培养时间下S. marcescens-01生物被膜形态(×10 000)Fig. 6 Bio fi lm morphology of S. marcescens-01 at different culture times ( × 10 000)
生物被膜是指菌体黏附于载体表面,分泌黏性的胞外多聚物,并与其他成分组成胞外基质将其自身包围其中而形成复杂三维结构,能使细菌高度耐药,抵抗不利环境[20]。细菌生物被膜的形成是一个动态过程。细菌的生物被膜一般会经历:1)初始附着期;2)不可逆附着期;3)初始形成和发展期;4)成熟期;5)脱落期。如图6所示,在12 h菌体开始聚集黏附在锌片表面;随着时间的延长,锌片表面附着的菌体数目逐渐增多,细菌之间开始黏结,且胞外聚合物将菌体包裹其中,进而生成成团聚集的生物被膜,36~60 h是生物被膜形成的发展成熟和稳定阶段。
2.6 不同培养条件下生物被膜的形成
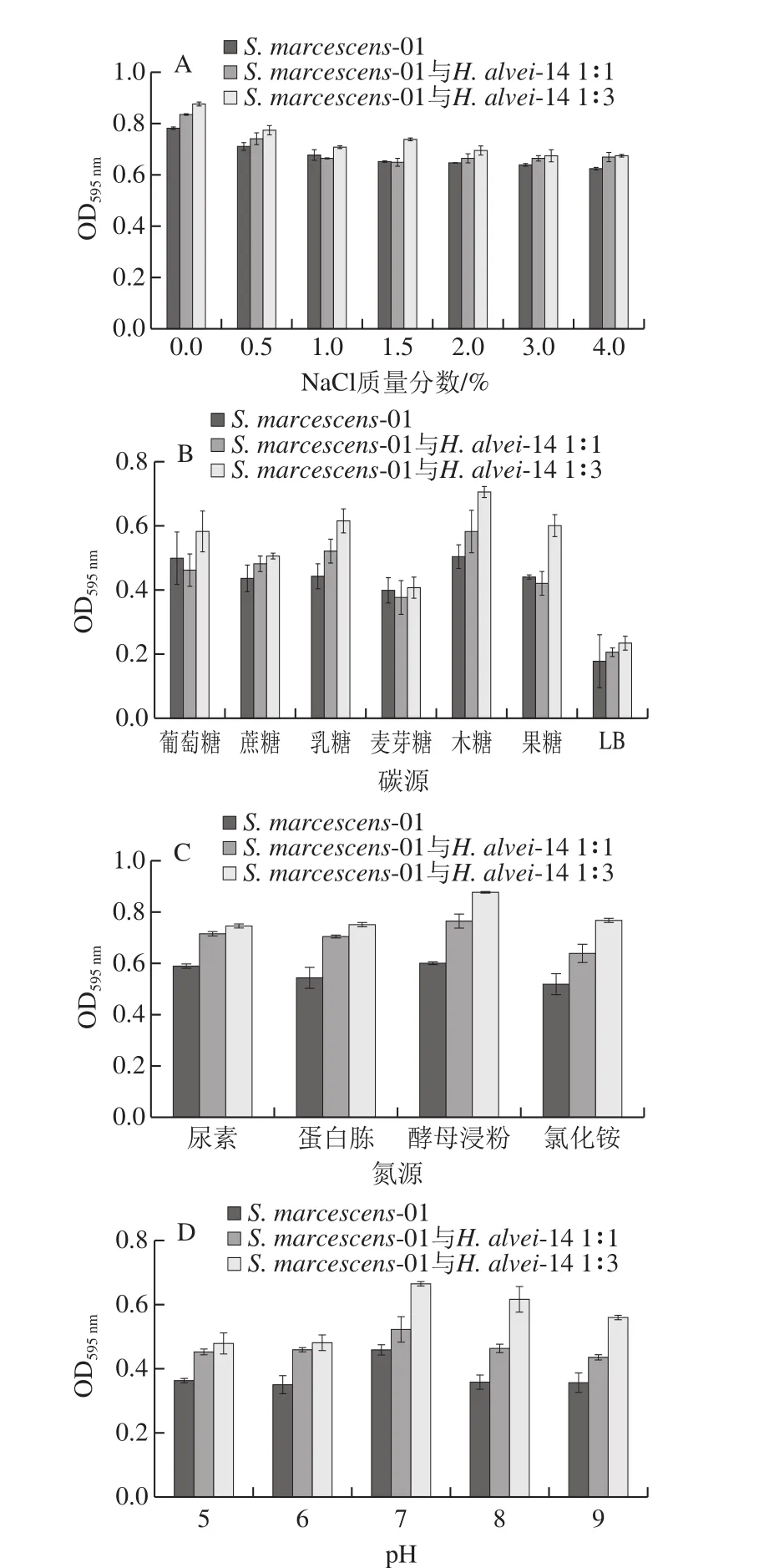
图7 不同培养条件对生物被膜的影响Fig. 7 Effect of different culture conditions on the formation of biofilm
如图7A所示,随着NaCl质量分数的增加,细菌细胞因渗透压过高而脱水,导致其失水死亡,进而抑制生物被膜的形成。H. alvei-14与S. marcescens-01共培养,生物被膜形成能力增强,S. marcescens-01与H. alvei1∶3产生物被膜的能力强于共培养体系S. marcescens-01与H. alvei1∶1体系。
如图7B所示,以LB培养基为对照,添加碳源促进了菌株S. marcescens-01生物被膜的形成。共培养体系以木糖、乳糖为碳源,生物被膜生成量最多,以麦芽糖为碳源时,生物被膜生长较差。刘晶晶等[21]研究发现,在25 ℃条件下,麦芽糖和乳糖质量分数由0.2%增至1.4%时,金黄色葡萄糖球菌-大肠杆菌混合生物被膜形成较快。
如图7C所示,S. marcescens-01与共培养体系均以酵母浸粉为氮源时,生物被膜产生量最多,而以氯化铵为氮源时,生物被膜量形成较少。不同氮源会使菌的生长速率出现差异,并进一步对生物膜的黏附和代谢活性等产生影响[22]。
由图7D所示,生物被膜生长的最佳pH值都为7,生长环境中pH值过低或过高均不利于微生物生物被膜的形成。
3 讨 论
共存体系中微生物互相作用是一个复杂的过程,不仅存在菌落间竞争营养物质,还存在代谢产物对彼此菌体的影响[23]。与对照S. marcescens-01相比,2 个共培养体系在各不同培养条件下变色圈直径变大,说明共培养后促进AHLs的分泌,其原因可能在于H. alvei-14的存在被S. marcescens-01认为是一种环境刺激,其通过某些调控机制调节自身AHLs的合成,这种调控机制可能包括对H. alvei-14的感知和对AHLs合成的调控。环境条件的改变会影响AHL的产生量,即在环境中可能存在影响AHL积累的因素,或者是存在一些因素抑制与AHL合成相关基因的表达。钠离子不参与细胞的组成,但仍是微生物发酵培养基的必需成分,钠离子与维持细胞渗透压有关,在培养基中常常加入少量钠盐,但是用量不能过高,否则会影响微生物的生长,氯离子在一般微生物中不具有营养作用,但是对某些微生物生长是必需的[24]。低NaCl含量和高NaCl含量均会抑制AHLs的分泌[25]。糖类在微生物正常生长有着重要作用,一般来说微生物对单糖的利用程度优于双糖和多糖[26],可能由于木糖、葡萄糖、果糖均为单糖,共培养体系对其利用程度较高,产AHLs的能力较强;而蔗糖、麦芽糖、乳糖均为双糖,菌株对麦芽糖、蔗糖利用能力依次降低,AHLs活性随着降低;而以乳糖为碳源时,菌株密度较小,但产AHLs的能力则相反,其原因可能为乳糖为菌株的限制性碳源,不利环境反而促进了AHLs的产生;因此在水产品加工过程中,应尽量选用蔗糖、乳糖等为原料,以减少由AHLs介导的食品腐败的发生。通常,微生物生长所需的氮源主要分为有机氮源和无机氮源两大类,其中有机氮源物质成分复杂,主要是蛋白质及其降解物,而微生物对无机氮源的吸收利用能力较强。菌株对蛋白胨的吸收利用能力较差,而在胁迫环境下,菌株刺激自身分泌大量的AHLs,而氯化铵可能是为其限制性氮源不利于菌株生长,但可以刺激菌体群体感应系统,促进AHLs的释放。相比碱性,菌株在酸性环境下产AHLs能力较强可能是因为不利环境下共培养体系感知危机信号,启动相关基因表达,刺激群体感应应急机制而分泌大量的AHLs,从而达到保护自身的目的[27]。
在自然条件下,大多数生物被膜是由许多微生物组成的混合生物被膜,被膜态细菌具有浮游菌不具有的优势,这增加了不同微生物之间的相互作用和胞外分泌物的复杂性,从而改变生物被膜的生理特性及功能。生物被膜的形成与胞外聚合物的分泌有关,而胞外聚合物的分泌离不开营养物质,所以营养物质对细菌生物被膜的形成至关重要[28]。Brink等[29]研究报道,影响益生菌生物被膜形成除去自身基因调控的因素外,还存在其他环境因素如培养基中营养物质的不足及限制性碳源的供给均有利于生物被膜的形成。高质量分数NaCl溶液能使细菌细胞因渗透压过高而脱水,抑制其生长繁殖,进而抑制生物被膜的形成。可能由于麦芽糖为双糖,菌株对其利用程度较低,生物被膜生长较差。以氯化铵为氮源时,菌株菌液密度较低,生物被膜生长较差。pH值一般对处于生物膜形成初期的浮游菌和周围的活菌产生影响,通常中性环境对生物被膜的形成有利[30]。在酸性条件下,微生物胞外分泌物可能会发生变性,而不利于其生物被膜的形成;在碱性条件下,不利于菌体的聚集,进而抑制其生物被膜的形成。因此,生长环境中pH值过低或过高均不利于微生物生物被膜的形成。
4 结 论
与蜂房哈夫尼亚菌共培养能促进粘质沙雷氏菌分泌AHLs和形成生物被膜,这种影响可能与菌群间群体感应有关。环境条件的改变是影响细菌分泌AHLs和生物被膜形成的重要影响因子,较高盐含量、pH值过低或过高均不利于微生物分泌AHLs和生物被膜的形成,而限制性碳源及氮源等胁迫环境均可以刺激菌体群体感应系统,促进AHLs的释放和生物被膜的形成。因此在水产品加工过程中应选择更适合的食品加工和贮藏条件,以减少由AHLs介导的食品腐败的发生和生物被膜的形成。

