微量Fe3+对过氧化氢异丙苯热稳定性影响研究
王 飞, 刘惠平, 刘章蕊, 王 萌, 朱 鹏, 张小良
(上海应用技术大学 城市建设与安全工程学院,上海 201418)
0 引言
过氧化氢异丙苯(Cumene Hydroperoxide,CHP)是生产苯酚和丙酮的重要中间体,广泛用于乙烯裂解汽油脱砷和丙烯腈丁二烯苯乙烯(Acrylonitrile Butadiene Styrene,ABS)接枝聚合反应。由于CHP分子结构中含有不稳定的过氧基团,因此在其生产、运输、储存或使用等过程中极易分解,并放出大量的热,若不及时移除,则可能造成灾难性的后果[1]。1970—2002年期间,美国等地发生过多起由CHP引发的热爆炸及反应失控事故,造成了人员伤亡和经济损失[2-4]。
近年来,一些学者采用不同的方法对CHP的稳定性和热安全性进行了研究,如黄艳军等[5]利用C80微量量热仪对CHP的热稳定性进行了研究,发现不同的升温速率对CHP的初始分解温度和最大放热温度有影响,升温速率越快,CHP的初始分解温度和最大放热温度会越高;金满平等[6]利用C600微量热仪研究了水和弱酸对CHP热稳定性的影响,发现水和弱酸能降低CHP分解的活化能、起始分解温度和最大分解温度;倪磊等[7]利用差示扫描量热仪(Differential Scanning Calorimetry,DSC)和绝热量热仪研究了CHP及其与不同金属离子混合后的热稳定性,为企业储存、运输CHP提供了指导。
本文利用绝热加速量热仪(Adiabatic Rate Calorimeter,ARC)研究微量Fe3+对CHP绝热分解的影响,得到了被测样品校正后的起始分解温度(To,s)、绝热温升(ΔTad,s)、最大温升速率(mm,s)和最大温升速率达到时间(θm,s)等参数,并计算了测试样品分解反应的动力学参数及CHP的分解热,评估微量Fe3+的存在对CHP热稳定性的影响,以期为CHP的热稳定性安全提供一定的参考。
1 实验
1.1 试剂
实验采用的试剂为过氧化氢异丙苯(FeCl3·6H2O),纯度≥70%。
1.2 仪器与测试条件
测试采用的仪器为德国耐驰公司的ARC244型绝热加速量热仪。测试结果用仪器自带的ARC2000软件进行分析。
测试样品:样品1为市售CHP试剂,CHP含量≥70%;样品2为含0.4×10-3(w.t.)% Fe3+杂质的CHP溶液;样品3为含1.2×10-3(w.t.)% Fe3+杂质的CHP溶液;样品4为含2.0×10-3(w.t.)% Fe3+杂质的CHP溶液;样品5为含4.0×10-3(w.t.)% Fe3+杂质的CHP溶液。测试所用样品球为不锈钢小球,比热Cvb为0.576 J/(g·℃)。详细的样品测试质量及测试条件见表1。
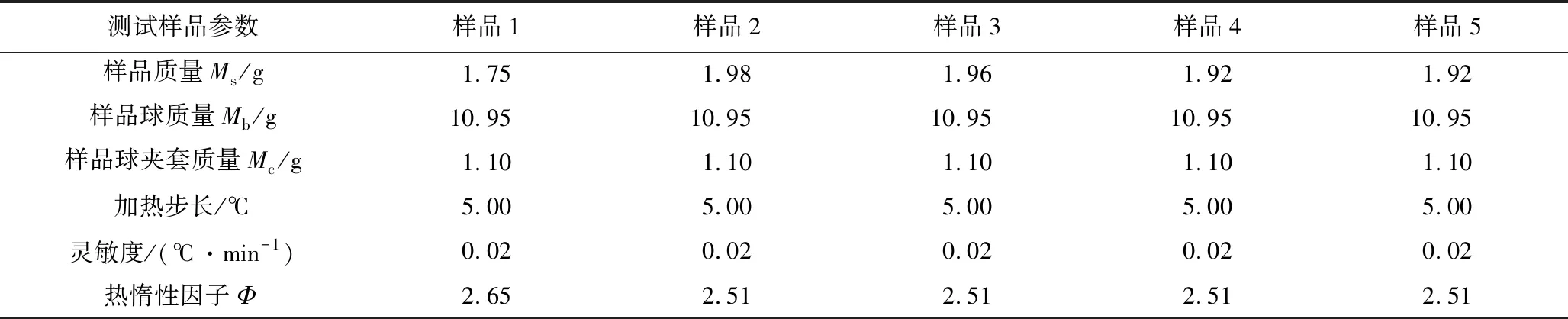
表1 测试样品参数及测试条件Table 1 Test sample weight and test conditions
2 结果与讨论
2.1 测试结果
5个样品分解过程中的温度-时间曲线、自放热速率-温度曲线、压力-时间曲线分别见图1、图2和图3,绝热分解参数见表2。

图1 温度-时间曲线Fig.1 Temperature-time curves
由图1可知,样品1~4的初始分解时间随着Fe3+含量增加而增加,但当Fe3+达到一定浓度后(样品5),样品的起始分解时间会明显缩短。
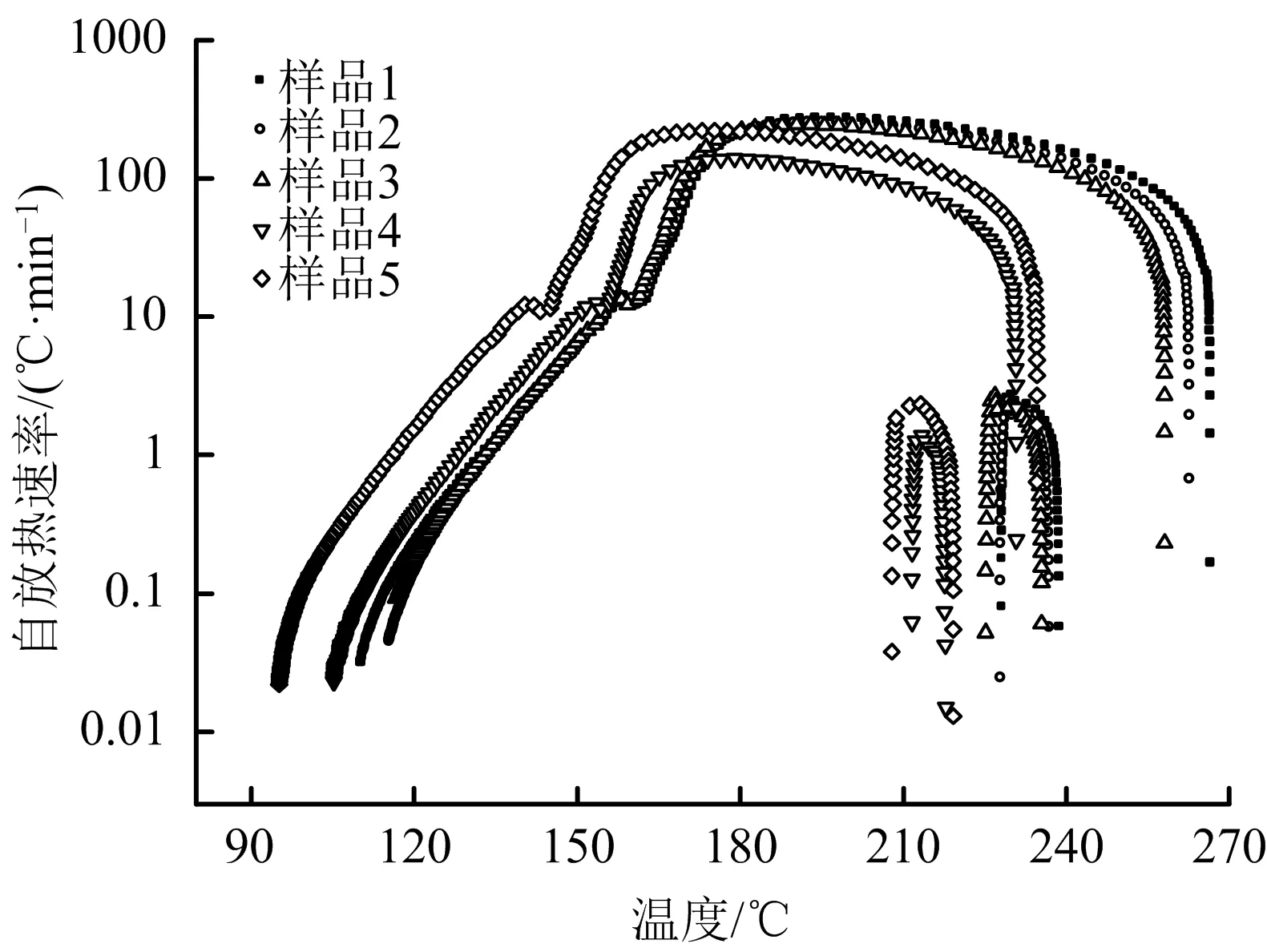
图2 自放热速率-温度曲线Fig.2 Self-heat release rate-temperature curves
图2表明,5个样品在分解过程中的自放热速率-温度曲线变化规律不尽相同;样品1,样品2,样品3的变化规律基本一致,而样品4和样品5的变化趋势类似。
由图3可知,5个样品在分解过程中的压力-时间曲线与图1的温度-时间曲线变化规律基本一致。

图3 压力-时间曲线Fig.3 Pressure-time curves
由图1-3数据可知,5个样品的初始分解温度呈先递增,后递减趋势,按序依次分别为110.51,115.73,116.75,105.25和95.23 ℃。另外,5个样品分解过程中所达到的最大温升速率不同,分别为267.73,249.48,243.7,138.91和220.79 ℃/min,特别是分解开始后至到达最大温升速率的时间差别较大,分别为152.92,110.10,67.81,54.24和45.50 min。
2.2 微量Fe3+对分解反应活化能的影响
图4为5个样品绝热分解过程中反应活化能随温度变化的曲线。由图4可见,5个样品分解过程中活化能随温度的变化趋势相似。根据测试数据分析可得,5个样品分解过程中的平均活化能分别为456.29,443.99,382.51,351.21和343.49 kJ/mol。
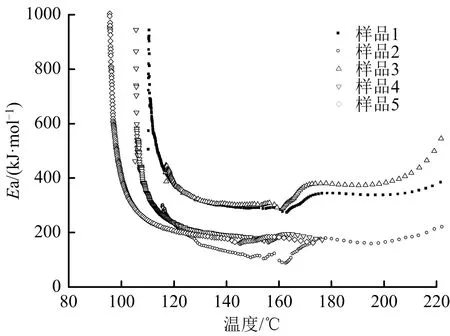
图4 活化能-温度曲线Fig.4 Activation energy-temperature curves
另外,由Arrhenius方程(见式(1))求得的动力学参数之一的指前因子A,计算结果见表2。
(1)

表2 5个样品的反应活化能及指前因子Table 2 Reaction activation energy and pre-exponential factors of five samples
2.3 测试数据校正
利用ARC测试样品的过程中,样品球内物质分解产生的热量不仅要加热样品本身,还要加热样品球,所以测试的是样品和样品球组成的体系的温度变化[8]。如果测试样品自分解放出的热量只用于加热样品本身,而不加热样品球,那么实际测得的温升及温升速率都会高于测量值[9]。因此,需要引入热惰性因子Φ对ARC测试的结果进行校正,从而使测试结果更准确、真实[10]。具体校正方法见式(2)~(9)[11-15],校正结果见表3。
Φ=1+[(MbCvb+McCvc)/(MsCvs)]
(2)
(3)
(4)
ΔTad,s=ΦΔTad
(5)
mo,s=Φmo
(6)
mm,s=Φmm
(7)
Tm,s=To,s+Φ(Tm-To)
(8)
(9)
式中:Φ为热惰性因子,无量纲;Mb为样品球的质量,g;Mc为样品球夹套的质量,g;Ms为样品的质量,g;Cvb为样品球夹套的比热容,J/(g·℃);Cvc为样品球夹套的比热容,J/(g·℃);Cvs为样品的比热容,J/(g·℃);To为初始分解温度,℃;To,s为校正后的初始分解温度,℃;R为摩尔气体常数,R=8.314 J/(mol·K);Ea为活化能,kJ/mol;Tf,s为校正后的最高分解温度,℃;ΔTad为绝热温升,℃;ΔTad,s为校正后的绝热温升,℃;mo为初始温升速率,℃/min;mo,s为校正后的初始温升速率,℃/min;mm为最大温升速率,℃/min;mm,s为校正后的最大温升速率,℃/min;Tm为最大温升速率对应温度,℃;Tm,s为校正后的最大温升速率对应温度,℃;θm为最大温升速率对应时间,min;θm,s为校正后的最大温升速率对应时间,min。

表3 样品绝热分解的测试结果及校正值Table 3 Test results and corrected values of sample adiabatic decomposition
2.4 测试结果分析
由图1样品的温度-时间变化曲线可见,当样品分解使得反应体系温度达到最大值后,都有1个突然下降,达到某一温度后又上升直至平稳的过程。这可能是由于测试过程中CHP分解反应达到剧烈状态时放出热量很快,使得反应体系的温度上升过快,即温升速率很快(见图2和表3),远远超过了ARC仪器维持模拟绝热过程而加热的最大额定温升速率(20 K/min);当反应达到最剧烈状态后,反应体系内的温度达到了1个最高点,而此时样品球外的仪器加热温度还没跟上,因此反应体系的热量会向样品球外传递,导致体系的温度降低,直至与仪器加热温度一致;之后,由于反应后期的反应速率较小,放出热量较少,反应体系的温升速率与仪器的加热速率一致,测试又回到了正常状态,直至反应完全结束。
图1和表3结果表明,样品1~5的校正初始分解温度分别为107.95,113.10,114.42,102.52和91.49 ℃,呈现先增加后降低的趋势;5个样品的绝热温升分别为414.22,369.47,354.76,315.06和349.82 ℃;最大温升速率分别为709.48,626.19,611.69,348.66和554.18 ℃/min。造成上述现象的原因可能是,当样品中含有较低含量的Fe3+时(样品2和样品3),其对CHP具有缓慢的催化分解作用,由于分解反应较慢,放出的热量较少,反应体系的温升速率低于仪器检测的灵敏度(0.02 ℃/min),因此实验开始后很长时间内检测不到温升信号,但此过程中样品中的CHP浓度却会由于长时间缓慢的分解而逐渐降低,从而导致样品2和样品3在绝热受热过程中的初始分解温度略高于样品1的初始分解温度。当样品中Fe3+含量增加到一定的量后(样品4和样品5),Fe3+对CHP的催化分解作用更明显,放热越多,反应体系的温升速率更容易高于仪器检测的灵敏度而被仪器检测,因此,样品4和样品5的起始分解温度低于样品1的初始分解温度。另外,不含Fe3+的样品1在受热过程中主要发生的是CHP热分解反应,而含微量Fe3+的样品在受热过程中除了发生热分解反应外,还发生了催化分解反应,且在一定浓度范围内,Fe3+含量相对越高,发生催化分解反应的CHP也越多。由于不同分解反应机理的放热效应不一样,不同样品对反应体系的最终绝热温升及反应过程中的最大温升速率的影响也不一样(见图2和表3)。由表3结果可见,5个样品单位质量的反应热呈现依次递减规律,分别为3.64,3.25,3.12,3.06和2.98 kJ/g。此外,从图1和表3中还可发现,样品2~5从分解开始至达到最大温升速率的时间分别为43.86,27.02,21.61和18.13 min,明显短于样品1的相应时间(57.71 min),说明微量Fe3+的存在能够显著加快CHP的分解过程,且Fe3+浓度越大,CHP达到剧烈分解的时间越短。
由图3可见,样品4和样品5的压力-时间变化曲线与样品1、样品2和样品3的相比略有差别。这可能是由于Fe3+浓度的增加,明显加快了CHP的催化分解,从而使得反应体系的压升速率显著增加,但反应体系最后达到的最大压力却相差不大(见表3),说明Fe3+的存在对反应体系的最终压力影响不大。
表2和图4结果表明,Fe3+的存在对CHP绝热分解的活化能影响较大,既影响了样品的初始分解活化能,也影响了其整个分解过程的平均活化能;而且,Fe3+含量越高,样品分解过程的平均活化能越低,说明Fe3+的存在对CHP起到了明显的催化分解作用,增加了CHP绝热分解的危险性。
3 结论
1)测试的5个CHP样品校正初始分解温度(To,s)随着Fe3+浓度的增高而呈现先增加后下降的趋势,即Fe3+浓度较低时,CHP的初始分解温度略有上升;随着Fe3+浓度的进一步增大,CHP初始分解温度逐渐降低,CHP分解危险性也随之增大。
2)绝热分解过程中,随着Fe3+浓度的增高,5个CHP样品的最大温升速率对应时间θm依次减小,Fe3+的加入使得CHP分解变得更加剧烈。
3)绝热分解过程中,随着Fe3+浓度的增高,CHP样品校正最大温升速率mm,s和校正绝热温升ΔTad,s呈现先下降后增加的趋势,即Fe3+浓度达到一定值后,绝热温升会变大,最大温升速率会增加,CHP分解危险性也会越高。
4)绝热分解过程中,Fe3+浓度越高,相应CHP样品的活化能Ea值越小,CHP更易发生分解。因此,在储存和运输CHP的过程中,要避免CHP与Fe3+接触,防止CHP发生分解。

