糙米浓浆制备及其稳定性和消化性研究
李 娟 何雪丹 陈正行 詹锦玲 余培斌 鲁振杰
(江南大学食品学院1,无锡 214122)(江南大学粮食发酵工艺与技术国家工程实验室2,无锡 214122)
糙米是稻谷脱壳后的稻米籽粒,是一种100%的全谷物,富含维生素、矿物质和必需氨基酸[1],其中60%~70%都聚积于糙米外层的米糠中,具有高营养价值。但米糠是一种柔性致密物料,难以进行细微粉碎,限制了糙米在食品深加工领域的应用和推广。因此本研究探求一种高效的粉碎技术,将糙米加工成为糙米浓浆,实现糙米的食品化利用,从根本上解决糙米难粉碎的问题。目前谷物浓浆的加工工艺主要有传统加工工艺、挤压膨化工艺和乳酸菌发酵工艺[2],本研究中采用的是传统加工工艺。传统食品领域常采用干法粉碎和湿法粉碎进行加工,在动齿和定齿的部件间隙中受到挤压、摩擦与剪切从而达到粉碎效果,存在设备易损耗、卫生条件差、难控制出粉粒径等问题。高压微通道微粉碎技术(HMUG)是物料在高速剪切效应、流道瞬时压降产生的空穴效应、物料与管壁的高能冲撞以及物料间的相互碰撞和摩擦作用三重作用下,产生高密度聚集的能量来实现对物料的高效粉碎。不仅能避免传统粉碎方式的问题,还具有能耗低、处理量大、安全卫生等优点[3]。
根据我国谷物饮料的行业标准QB/T 4221—2011,谷物浓浆归属于谷物饮料,是指以谷物为原料,经加工调配制成的含有较多的总固形物和总膳食纤维的饮料。其中谷物添加量不少于4%(m/m)、总固形物含量≥10 g/100 g、总膳食纤维含量≥0.3 g/100 g的一类谷物产品。目前,韩国和日本在糙米饮料产业发展较快,例如早在2003年,韩国的“熊津”牌糙米浓浆就在中国达到了1亿瓶的销售量。但是,国内尚没有成熟的糙米浓浆产品。因此,本研究探求一种高效的粉碎技术,将糙米制备成糙米浓浆,从根本上解决糙米难粉碎的问题。此外,对减少粮食副产物的产生和粮食浪费,保全糙米营养价值,具有重要意义。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
糙米:盘锦运通米业有限公司,水分(13.18±0.00)%,灰分(1.26±0.01)%,蛋白质(8.02±0.06)%,脂肪(2.02±0.11)%,淀粉(73.90±0.04)%;CaCl2、醋酸钠、α-淀粉酶、羧甲基纤维素钠:国药公司。
1.1.2 仪器与设备
QSWR电热恒温鼓风干燥箱;SYF系列多功能干湿法粉碎机;直立式多功能粉碎机;KD-L50F胶体磨;BT-9300s型激光粒度分布仪;高压微通道超细微粉碎机;HYP-314消化炉;KDN-103F自动定氮仪;LXJ-IIB型离心机。
1.2 方法
1.2.1 糙米浓浆制备
1.2.1.1 糙米预处理
选取优质的实验原料,洗净后105 ℃烘烤2 h。烘烤结束冷却至室温,备用。
1.2.1.2 干法粉碎法
预处理后的糙米用磨粉机粉碎,得到干磨粉,1∶2料水比混合,加入耐高温α-淀粉酶[4],加酶量15 U/g[5],于90 ℃下酶解,酶解30 min[6],得到糙米浓浆,于115 ℃下灭菌,时间15 min[7],灭菌后灌装于已灭菌的塑料瓶中。
1.2.1.3 湿法粉碎法
浸泡糙米,料水比为1∶2,常温浸泡24 h(60 ℃浸泡1 h或夏季常温浸泡12~18 h或冬季浸泡18~24 h)[8]使糙米组织软化。浸泡完成后进行粗粉碎(胶体磨1次),之后酶解,条件如1.2.1.2所示。然后进行细粉碎(胶体磨处理)得到糙米浓浆,后灭菌、灌装,同1.2.1.2。
1.2.1.4 高压微通道微粉碎法
糙米进行粗粉碎(多功能干湿法粉碎机,频率40 Hz),按照料水比1∶2混合后酶解,条件如1.2.1.2所示。浆液冷却至室温,用高压微通道微粉碎机进行微粉碎,得到糙米浓浆,后灭菌、灌装,同1.2.1.2。
1.2.2 糙米浓浆成分测定
含水量测定:105 ℃恒重法参照GB 5009.3—2010;粗灰分含量测定:干法灰化法参照GB 5009.4—2010;蛋白质含量测定:凯氏定氮法参照GB 5009.5—2010;粗脂肪含量测定:索氏抽提法参照GB/T 5009.6—2003;淀粉含量测定:酸水解法参照GB/T 5009.9—2008;总膳食纤维测定:酶重量法参照GB/T 5009.88;总固形物含量测定:参照QB/T 4221—2011。
1.2.3 糙米浓浆粒度测定
将样品逐滴加入激光粒度分布仪样品池中直至仪器显示遮光度范围在15%~25%之间,由系统给出粒子体积为权重的重量为平均粒径分布[9]。激光功率为75 mW,室温下测定,每个样品重复测量3次。
1.2.4 糙米浓浆稳定性测定
以稳定系数(R)和离心沉淀率(SR)为指标,对选用的海藻酸钠、明胶、黄原胶和羧甲基纤维素钠4种稳定剂进行单因素实验和正交实验,优化出最佳的稳定剂复配方案。
1.2.4.1 稳定系数的测定
样品稀释10倍,在785 nm波长下测定其吸光度值A前,3 000 r/min离心10 min,再次在785 nm波长下测定上清液的吸光度值A后。R越大,则所测定的料液越稳定。
R=A后/A前
(1)
1.2.4.2 离心沉淀率的测定
准备离心管,称量其质量m0。加入适量的样品,称量质量m1,3 500 r/min离心20 min。弃去上清液,再次准确称量沉淀和离心管质量记为m2。SR值越小,料液越稳定。
SR=(m2-m0)÷(m1-m0)×100
(2)
1.2.5 糙米浓浆消化特性和血糖生成指数(GI值)测定
配制酶液:4 mmol/L CaCl2的0.1 mol/L的醋酸钠缓冲溶液,配制成最终酶活为猪胰α-淀粉酶290 U/mL、AMG酶15 U/mL的粗酶液[10]。高速振荡10 min,后置于37 ℃水浴摇床中恒温活化30 min。4 500 r/min离心15 min,收集上清液(酶液)待用。
1.2.5.1 体外消化实验
准确称取600 mg糙米浓浆/200 mg糙米粉于含5颗小玻璃珠的50 mL离心管中,加入10 mL混合酶液,置于37 ℃,185 r/min的振荡水浴锅中开始反应并精确计时。水解20 min和120 min后分别准确吸取100 μL水解液加入含900 μL无水乙醇的试管中灭酶。用葡萄糖氧化酶法(GOPOD)在510 nm的波长下测定水解出的葡萄糖含量,并按以下公式进行分析计算。
RDS(%)=(G20-FG)×0.9×100/TS
(3)
SDS(%)=(G120-G20)×0.9×100/TS
(4)
RS(%)=1-RDS-SDS
(5)
SDI=(RDS/TS)×100%
(6)
式中:RDS为快消化淀粉;SDS为慢消化淀粉;RS为抗性淀粉;G20为水解20 min后样液中葡萄糖质量/mg;FG为水解前样品的游离葡萄糖质量/mg;G120为水解120 min后样液中的葡萄糖质量/mg;TS为样品的总淀粉质量/mg;SDI为淀粉消化指数。
1.2.5.2 GI值的测定
血糖生成指数(GI值)按照Goni等[11-12]建立的方法进行测量和计算。按照1.2.5.1的方法分别测定水解10、20、30、40、60、90、120、180 min之后样液中的葡萄糖含量,按照公式计算淀粉的水解率。
淀粉水解率=(取样时间点消化液中葡萄糖含量×0.9)÷总淀粉含量×100%
(7)
以淀粉水解率和消化时间分别作为横、纵坐标,绘制淀粉水解曲线。计算AUC(曲线下面积)[13],并计算GI值。
GI=39.71+0.549HI
(8)
HI=AVC样品÷AVC参考食品(面包)
(9)
式中:HI为水解指数/%;AUC为水解曲线下方面积。
1.2.6 数据统计与分析
采用Origin 9.0软件对实验数据进行图形处理;采用SPSS 18.0和Excel软件对实验数据进行显著性分析,P<0.01为极显著,P<0.05为显著。
2 结果与讨论
2.1 糙米浓浆成分测定
糙米浓浆基本成分如表1、2所示,不同粉碎方式对糙米浓浆基本成分无明显影响。糙米浓浆中总固形物含量≥10 g/100 g;总膳食纤维含量≥0.3 g/100 g,符合QB/T 4221—2011。

表1 糙米浓浆基本成分测定/%
注:同列字母相同表示差异不显著,余同。

表2 糙米浓浆其他成分测定/%
2.2 不同粉碎方式处理后粒径变化
糙米经过干法粉碎处理前后,平均粒径D50值的变化如图1a所示。随着粉碎时间的延长,当糙米粉碎量分别为100、125、250 g,糙米浓浆的平均粒径D50均有显著下降趋势(P<0.05)。当处理时间达到150 s以上,糙米平均粒径的下降趋势不再显著(P>0.05)。由此可见,当糙米粉碎量为100 g,粉碎时间为150s,所得的糙米平均粉碎粒径最小约为106.40 μm。
糙米平均粒径D50值随胶体磨粉碎次数和胶体磨辊磨之间的间隙的变化如图1b所示。随着粉碎次数的增加,糙米浓浆的粒径无显著变化(P>0.05);随着胶体磨间隙的减小,糙米浓浆的粒径有显著减小的趋势(P<0.05)。这是由于样品在胶体磨中受到的剪切力而达到粉碎效果,剪切力的大小是由间隙的大小决定[14]。因此,当胶体磨的粉碎间隙为0.01 mm,粉碎次数为1次,所得的糙米粉碎粒径最小(约为66.65 μm)。



图1 不同粉碎方式对糙米浓浆粒径的影响
糙米浓浆经过高压微通道微粉碎处理后其平均粒径D50值的变化如图1c所示。糙米在不同粉碎压力下,粉碎1至2次后,D50值均出现显著的下降趋势(P<0.05);粉碎次数达3次后,糙米粒径已无显著下降趋势(P>0.05)。此外,随着微通道压力从30 MPa升至35 MPa时,糙米的平均粒径呈显著下降趋势(P<0.05);但随着微通道压力的继续升高(>35 MPa)时,糙米的平均粒径下降不显著(P>0.05)。因此,当微通道粉碎压力为35 MPa,且粉碎2次后,糙米的粉碎粒径最小可达24.38 μm且粉碎最经济。
综上所述,糙米经高压微通道微粉碎技术粉碎后(35 MPa,处理2次)所得的糙米浓浆平均粒径值最小(约24 μm)。考虑到粉碎能耗和经济成本等因素,因此选择经高压微通道微粉碎技术粉碎后(35 MPa,处理2次)所制备的糙米浓浆进行后续的稳定性实验和淀粉消化特性与血糖生成指数测定等实验。
2.3 不同亲水胶体对糙米浓浆稳定性的影响
2.3.1 单因素实验
四种不同稳定剂对糙米浓浆稳定性的影响如表3所示。黄原胶、羧甲基纤维素钠、海藻酸钠的稳定系数R和离心沉淀率SR与空白对照都有显著性差异(P<0.05),其中,黄原胶稳定效果最好,稳定系数最大为3.07。羧甲基纤维素钠和海藻酸钠对糙米浓浆的稳定性次之。明胶对糙米浓浆的稳定系数最小,稳定效果最差,它的R和SR与未添加稳定剂的空白对照无明显差异(P>0.05)。
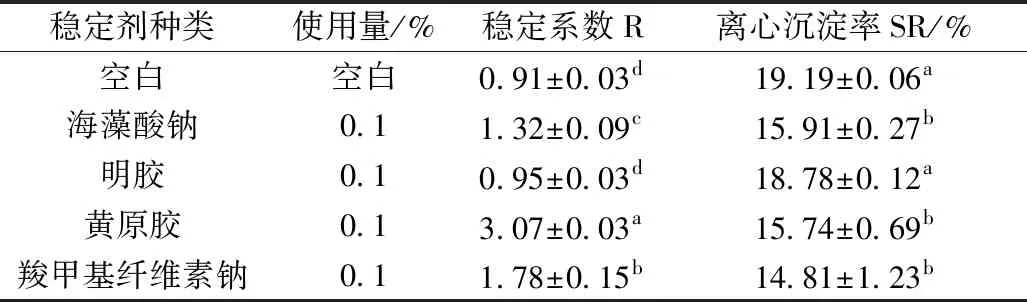
表3 单一稳定剂对糙米浓浆稳定性的影响
2.3.2 正交实验
选取单因素试验2.3.1中稳定效果最优的3种稳定剂进行正交实验。稳定剂复配实验设计方案和稳定剂正交复配如表4、表5所示。

表4 稳定剂复配实验水平因素设计表

表5 稳定剂复配L16(43)正交实验结果
图2分别为3种稳定剂稳定系数和离心沉淀率的极差分析表,反映了不同稳定剂对糙米浓浆稳定系数和离心沉淀率的影响。由极差分析可得出2组优化水平组合(表6),分别是A2B1C4和A2B2C4。羧甲基纤维素钠对稳定系数和离心沉淀率的影响最大,综合平衡以确定最优工艺条件,可以参考正交实验中羧甲基纤维素钠的添加量为0.05%(m/V)的组别中的数据。最终确定最优方案为A2B1C4,即稳定剂添加量为羧甲基纤维素钠0.05%(m/V),黄原胶0.15%(m/V),不添加海藻酸钠。以此方案添加的糙米浓浆离心沉淀率为(5.23±0.13)%。


图2 稳定系数R和离心沉淀率SR极差分析直观图

实验指标主次顺序优化水平组合稳定系数RACBA2B1C4离心沉淀率SRACBA2B2C4
2.4 消化特性与血糖生成指数测定结果
2.4.1 体外消化实验
高压微通道微粉碎处理后,糙米中的淀粉消化特性变化如表7所示。经过微通道微粉碎后,慢消化淀粉比例有所下降,快消化淀粉含量增加。这可能是因为粉碎过程中破坏了淀粉的颗粒结构,产生破损淀粉[15],结构疏松,导致淀粉更容易被酶解,进而提高了淀粉的消化指数。

表7 高压微通道微粉碎对淀粉消化性的影响
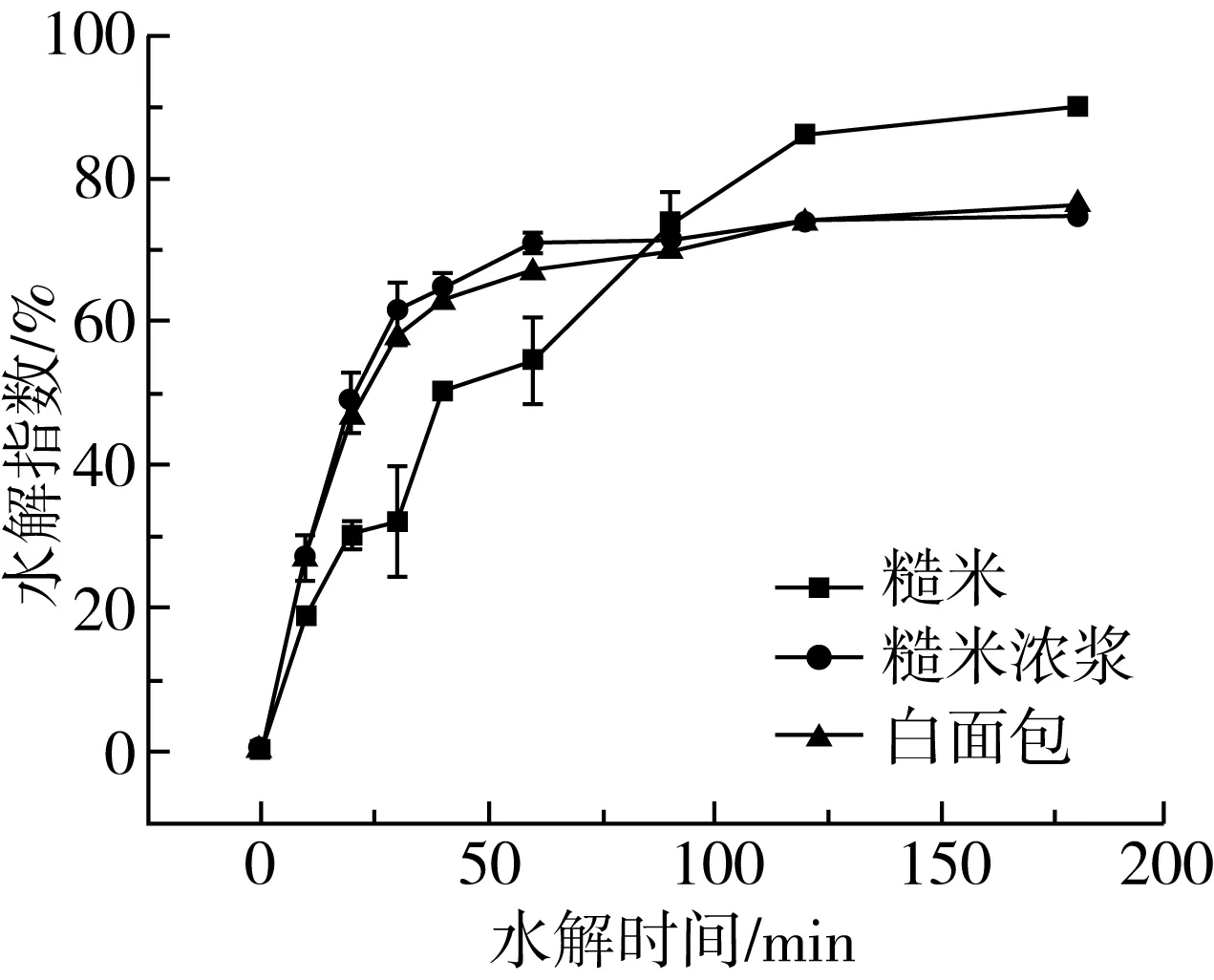
图3 糙米浓浆与糙米、白面包的水解曲线
2.4.2 血糖生成指数
根据图3糙米浓浆水解曲线图式(6)~式(8)计算可得GI值(表8)。将GI值曲线经过平滑处理,计算得糙米浓浆和糙米均为GI值低于55的低血糖食品,远低于人们常食用的大米饭的GI值88。因此,糙米浓浆特别适合需要控制血糖的和控制体重的人群食用。

表8 糙米与糙米浓浆的GI值
3 结论
基于高密度能量聚焦粉碎原理的高压微通道超细微粉碎技术突破传统粉碎方式的局限性,显现出较好的粉碎优势。通过高压微通道微粉碎技术可显著降低糙米浓浆的平均粒径,最小粒径可达24 μm且制得的糙米浓浆感官特性较好。本研究并对糙米浓浆中存在的主要问题即稳定性问题进行了深入研究。糙米浓浆中添加0.05%(m/m)的羧甲基纤维素钠和0.15%(m/m)的黄原胶可使糙米浓浆的离心沉淀率从19.69%降至5.23%,显著提升糙米浓浆的悬浮稳定性,进而解决了糙米浓浆贮藏稳定性差的关键问题。最后对糙米浓浆的营养健康性进行了研究,实验结果表明糙米浓浆的GI值为40.28,属于低血糖食品,特别适合需要控制血糖以及控制体重的人群食用。

