设施葡萄叶片理化指标的日变化及其相关性分析
商佳胤,李凯,集贤,王丹,苏宏,田淑芬
(1. 天津市设施农业研究所,天津 301700;2. 天津市林业果树研究所,天津 300384)
叶片导水率被用来量化植物体内水分运输的传输能力[1],它表示单位水势驱动力下通过叶片的水通量[2],可以表示为水流通过叶片时所产生的水力阻力的倒数(即,1/Rleaf)[3]。导水率是反映植物水分传输效率高低的一个重要生理参数,是确定气孔导度和气体交换速率的关键因子,在确定植物最大气体交换速率中起重要的作用[4]。植物叶片的水分传输是整株植物水分传输的重要组成部分,在该过程中水分传输大小受各种内、外部复杂因素的影响,呈现动态变化[5]。研究表明,叶片导水率对干旱[2,3]、高温[6]、光照[3,7]等外界环境因素存在一定的响应机制;对于设施葡萄种植而言,春夏季高温造成的热伤害是影响葡萄品质、造成葡萄园减产的一大因素;高压流速仪(HPFM)被认为是一种测定植物导水率相对简单、快速、精确的方法[8]。因此,本试验拟使用HPFM法,研究夏季高温日光温室中葡萄叶片的导水率日变化,再结合相关的生理生化指标,采用相关性分析法,为利用叶片导水率评价葡萄植株的耐胁迫能力提供理论基础。
1 材料与方法
1.1 试验材料
试验于2016年7月20日至8月9日进行,试验地点为天津市农业科学院创新基地,供试品种为4年生‘金田美指’‘夏黑’‘红宝石无核’。塑料大棚种植,行株距为4.0 m×2.2 m,树形为有干双臂水平棚架,结果新梢间距为20 cm,每株留新梢40条,每条新梢留叶16片、留果1穗。试验材料全年施肥、灌水、打药采用常规管理。
1.2 试验设计
根据天气预报,试验选择3个晴朗高温日进行,分别为7月20日、7月25日、8月9日,在每个试验日的8∶00至18∶00对3个品种进行叶片采样,每隔2 h采样一次,共采样7次,同时记录棚内温湿度。采样叶片为新梢基部以上的第4片,每次采12片,采后立即带回实验室进行各项指标的测定。以每个采样日的样品为1个重复,共3次重复。
1.3 测定指标与方法
1.3.1 温湿度测定
使用普通温湿度计测定。在棚内自西南角向东北角的延长线上悬挂温湿度表,共6个,每个表的上方使用纸箱遮阳,悬挂高度为距离地面1.5 m处,每个测定时间点读取6个温湿度表数据,计算平均值。
1.3.2 叶片导水率的测定
参照杨启良[8]的方法测定葡萄叶片的导水率,略做改进。测定前给仪器加水后在550 kPa恒压下排除HPFM体内的气泡,历时12 h。对仪器进行归零,然后适当的位置用刀片切断叶柄,将压力耦合器与叶柄相接,再将PVC管接到HPFM的八通阀门出口处,打开出口阀门,观测八通阀门各个出口处是否有渗漏现象,接着将PVC管的另一端与压力耦合器相接,最后进行量程选择。选好量程后开始测量,使用瞬时法获得最终数据。
1.3.3 叶片叶绿素、丙二醛、脯氨酸的测定
叶绿素含量的测定采用丙酮-乙醇浸提法[9];丙二醛(MDA)含量的测定采用硫代巴比妥酸法[10];脯氨酸(Pro)含量的测定采用磺基水杨酸法[11]。
1.4 数据分析
数据统计采用SPSS 24.0进行单因素的方差分析,使用T-best法进行显著性分析,使用典型相关性法进行相关性分析;使用Excel 2007进行图表制作。
2 结果分析
2.1 塑料大棚内温湿度日变化
由图1可以看出,塑料大棚内的温湿度呈明显不同的变化趋势,其中,温度在6∶00最低,为20.17 ℃,随着外界温度的升高,棚内温度逐渐升高,在14:00达到最高的43.5 ℃,此后开始下降,并在18∶00降至31.83 ℃;棚内的相对湿度变化与棚内温度变化相反,在6∶00时最高为85.50%,此后开始下降,在14∶00下降到最低的23.33%,然后再缓慢上升,在18∶00时达到42.00%。
2.2 葡萄叶片导水率日变化
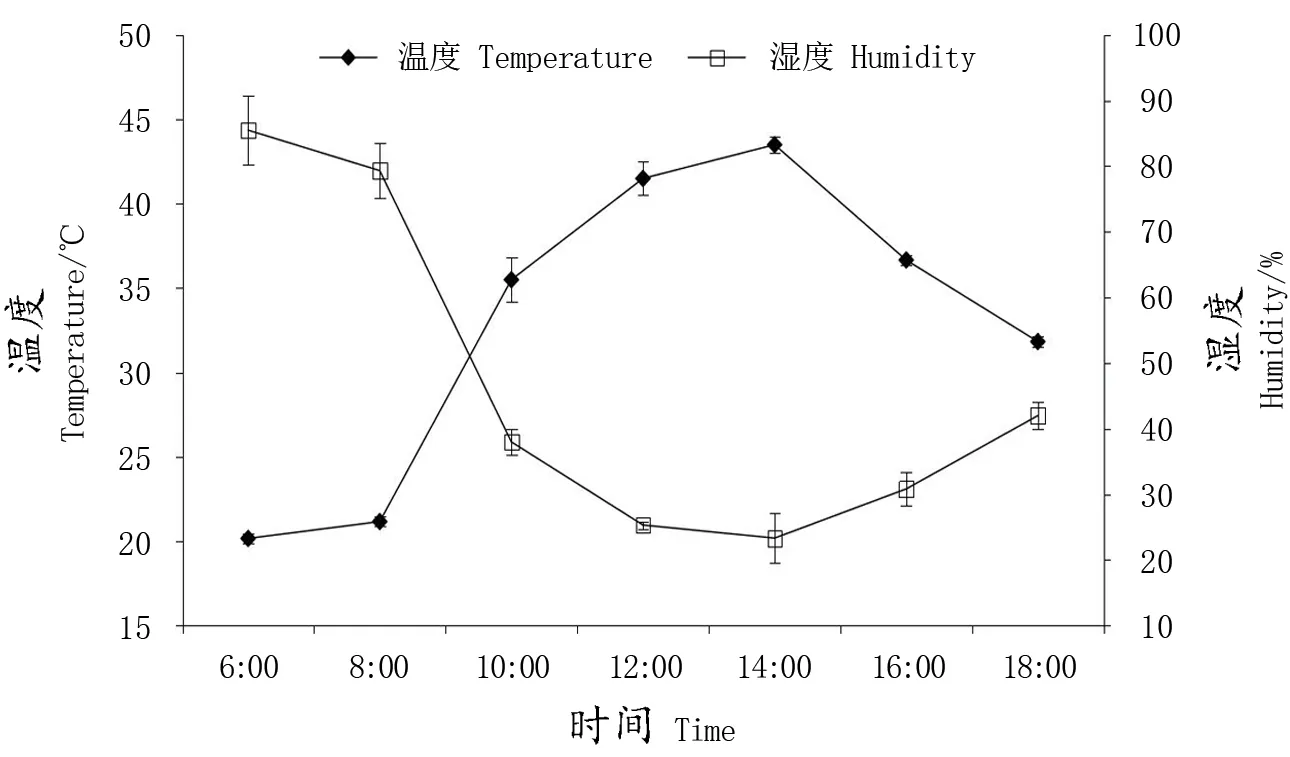
图1 温湿度日变化Figure 1 Diurnal variation of temperature and humidity
由图2可以看出,3个葡萄品种的叶片导水率日变化基本呈先上升、下降、再上升的趋势。其中,‘金田美指’‘夏黑’在6∶00时的叶片导水率最低,分别为1.39×10-6/S·MPa、1.74×10-6/S·MPa;此后,3个品种的叶片导水率开始上升,其中,‘金田美指’和‘红宝石无核’在10∶00时达到白天最高,叶片导水率分别为2.92×10-6/S·MPa、3.20×10-6/S·MPa;此后3个品种的叶片导水率开始下降;在14∶00时,‘红宝石无核’达到白天最低值的2.31×10-6/S·MPa;之后3个品种的叶片导水率逐渐上升,‘夏黑’在18∶00的叶片导水率达到全天的最高值,为3.01×10-6/S·MPa。通过与棚内温度进行比较来看,叶片导水率在温度升高、湿度下降后出现了明显的下降趋势,可见棚内环境变化对其有一定的影响。
2.3 葡萄叶片含水量日变化
由图3可以看出,3个葡萄品种的叶片含水量日变化基本呈先下降、再上升的趋势。其中,3个品种在6:00时的叶片含水量最高分别为78.52%、81.72%和77.61%;此后均开始下降,‘金田美指’和‘红宝石无核’2个品种在14∶00的叶片含水量达到最低,分别为66.56%和65.13%,‘夏黑’的叶片含水量则在16:00达到最低,为68.97%;3个葡萄品种的叶片含水量在达到最低点后,又出现缓慢的上升。3个葡萄品种叶片含水量最高时较最低时分别提高了17.97%、25.47%和12.53%。
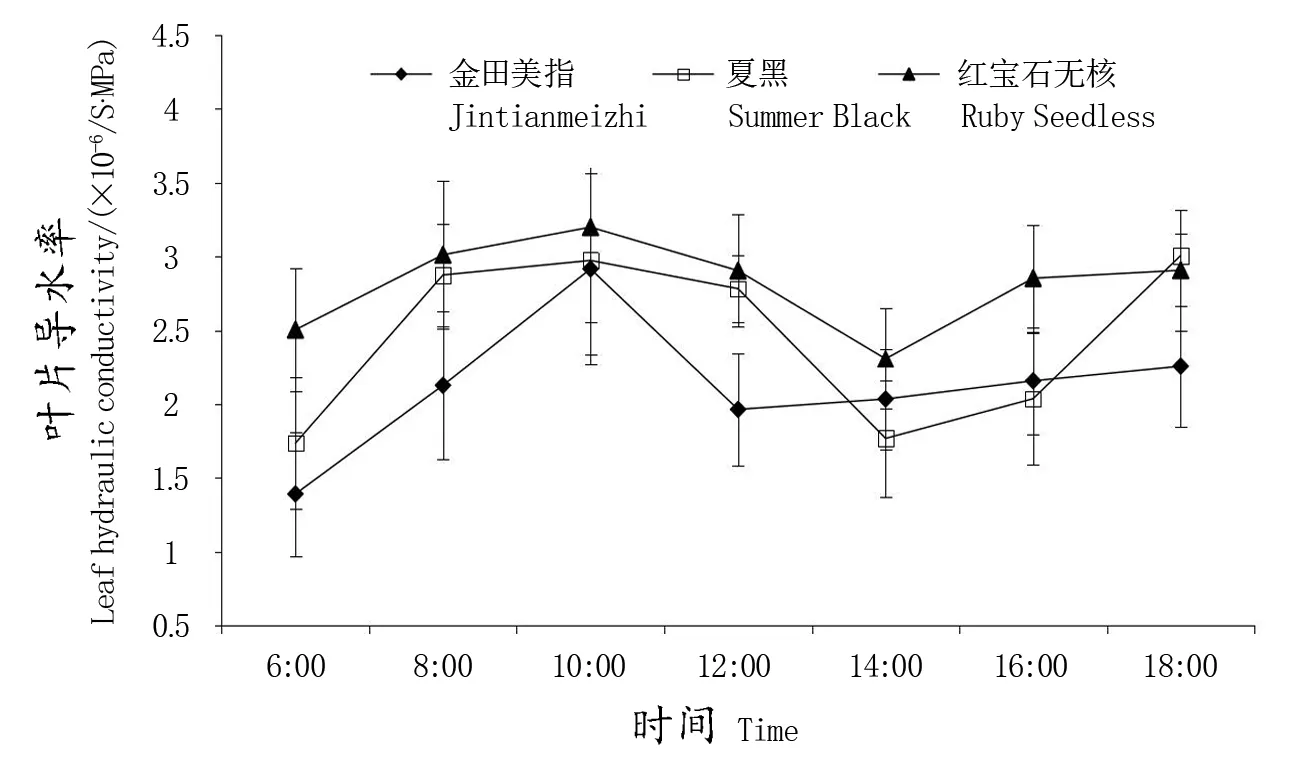
图2 葡萄叶片导水率日变化Figure 2 Diurnal variation of hydraulic conductivity in grape leaves

图3 葡萄叶片含水量日变化Figure 3 Diurnal variation of water content in grape leaves
2.4 葡萄叶片叶绿素含量日变化
图4为3个葡萄品种的叶片叶绿素a、叶绿素b、叶绿素总含量的日变化情况。由图4-1可以看出,3个葡萄品种的叶片叶绿素a的变化趋势不很明显,其中‘金田美指’在16∶00时、‘夏黑’在6∶00时、‘红宝石无核’在14∶00的叶绿素a含量最低。3个葡萄品种的叶片叶绿素b的变化趋势也不很明显,‘金田美指’和‘夏黑’在10∶00时、‘红宝石无核’在14∶00的叶绿素b含量最低;与叶绿素a和叶绿素b类似,3个葡萄品种叶片的总叶绿素含量的变化趋势也不明显,但是呈现出在16∶00或18∶00时,其含量逐渐达到最高的趋势。

图4 -1 葡萄叶片叶绿素a含量日变化Figure 4-1 Diurnal variation of Chla content in grape leaves
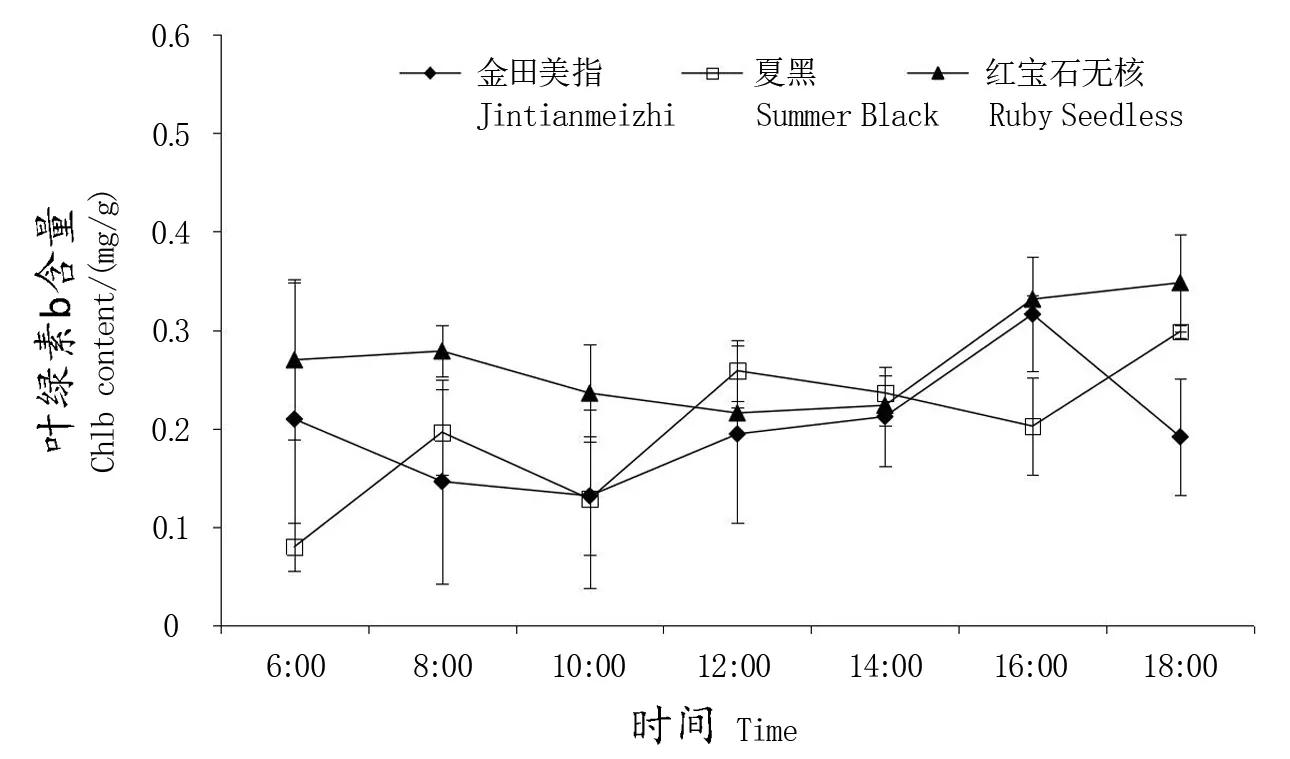
图4 -2 葡萄叶片叶绿素b日含量变化Figure 4-2 Diurnal variation of Chlb content in grape leaves

图4 -3 葡萄叶片叶绿素总量日含量变化Figure 4-3 Diurnal variation of total chlorophyll in grape leaves
2.5 葡萄叶片MDA含量日变化
由图5可以看出,3个葡萄品种的叶片MDA含量基本呈先下降、再上升的趋势,不同品种的变化转折时间点有明显差异;其中,‘金田美指’的叶片MDA含量在18∶00时最高,为8.50 µmol/g FW,在10∶00时最低,为6.54µmol/g FW;‘夏黑’在6∶00时最高,为8.91 µmol/g FW,在8∶00时最低,为6.03 µmol/g FW;‘红宝石无核’在14∶00时最高,为10.83 µmol/g FW,在8∶00时最低,为7.53 µmol/g FW。从3个品种的变化趋势上看,在8∶00—10∶00的MDA含量最低,而最高值则在3个时间点。由于MDA是植物重要的逆境胁迫的指标,可以认为,在8∶00和18∶00光照较弱的环境下,其含量也显著升高;而在14∶00温度最高时,其含量也会发生明显的升高;而在8∶00—10∶00时温度适宜,光照良好的条件下,其含量处于白天相对较低的水平。

图5 葡萄叶片丙二醛含量日变化Figure 5 Diurnal variation of MDA content in grape leaves
2.6 葡萄叶片Pro含量日变化
由图6可知,3个品种的叶片Pro含量基本呈先下降、再上升的趋势,不同品种的变化转折的时间点有明显差异;‘金田美指’和‘夏黑’在6∶00和16∶00的Pro含量在白天的测定中处于较高水平,最高值分别出现在16∶00(0.35 μg/g FW)和6∶00(0.44 μg/g FW);而‘红宝石无核’在6∶00和18∶00之外的12∶00三个时间点的Pro含量处于较高水平,其最高值出现在6∶00,为0.42 μg/g FW。
2.7 各项指标的相关性分析
在对9个指标的分析过程中我们发现,大棚内的温度和湿度呈极显著的负相关性;叶绿素b与大棚内的湿度和叶绿素总量呈显著的正相关性;其它各指标两两之间均不存在极显著或显著的相关性。

图6 葡萄叶片脯氨酸含量日变化Figure 6 Diurnal variation of Pro content in grape leaves

表1 葡萄叶片生理指标的相关性分析Table 1 Correlation analysis of the physiological indexes of grape leaves
3 讨论与结论
研究表明,植物导水率的变化受各种环境共同影响和调控,多种因素及其交互作用影响着植物叶片水分的传输。温度和光在对整个叶片导水率的影响上是良性互动:在较高叶片温度时对光照的反应更为明显[12]。本研究则表明,随着塑料大棚内温湿度的变化,3个葡萄品种的叶片导水率也随着发生变化,且有一定的规律性,即较高的温度或较低的湿度会导致葡萄叶片的导水率下降;同时,在14∶00日温度最高、湿度最低时,3个葡萄品种叶片含水量也降到了最低,可见高温(>40 ℃)、低湿(<25%)对叶片导水率和含水量有一定的影响。但是,通过相关性分析发现,葡萄叶片的导水率、含水量与大棚内的温湿度变化以及各项生理生化指标的相关性不显著。
植物在受到高温胁迫时,其代谢机制会发生一系列的变化,如叶绿素降解、细胞膜透性增大、活性氧含量增加等[13]。丙二醛(MDA)是膜脂过氧化的主要产物之一,其含量越高,说明质膜受损伤越严重;反之,则膜受害越轻[13]。大多数植物体内脯氨酸(Pro)含量在逆境条件下会成倍增加,且其含量越高,植物体的抗逆性越强[14-15]。在本研究中,通过测定葡萄叶片的叶绿素、MDA和Pro含量发现,夏季大棚内自然的高温低湿对于3个葡萄品种的这3项指标的影响并不明显,这可能说明短时间超过40 ℃的温度或低于25%的湿度对于葡萄植株可能没有达到逆境胁迫的程度,因此,这些指标的变化不显著。
综上所述,本实验设计之初,我们希望HPFM测定的葡萄叶片导水率能够反应出大棚葡萄在高温条件下的差异,从数据上看,虽然其变化趋势与棚内温湿度的变化趋势无显著的相关性,但是与其它生理生化指标相比,其在高温低湿时表现出了明显的下降趋势,这与前人的研究[16]比较接近,但是,如果要利用HPFM去探讨温度、湿度、光照等环境因子对葡萄叶片导水率的影响,还需要进一步开展研究工作。

