西藏牦牛MyoD1基因多态性及与生长性状的关联性分析
黄 兴,柴志欣,王 会,姬秋梅,信金伟,钟金城*
(1.西南民族大学/青藏高原研究院,四川 成都 610041;2.西藏自治区农牧科学院省部共建青稞和牦牛种质资源与遗传改良国家重点实验室,西藏 拉萨 850009)
【研究意义】牦牛主要分布于海拔3000 m以上,以青藏高原为中心,及其毗邻的高山、亚高山地区,能够适用高寒缺氧等极端生态环境,素有“高原之舟”之称[1]。能够充分利用低海拔家畜难以利用的牧草资源,生活自如,繁衍后代。其耐粗、耐劳、善走陡坡险路、雪山沼泽,是高原牧区主要的运输工具,为当地牧民提供不可或缺的生产生活资料。由于受分布区自然环境条件和经济社会发展水平的限制,加之牧民缺乏科学的管理,牦牛生产性能不高[2]。因此利用现代分子生物学技术对牦牛生长性状相关基因进行挖掘并进行相关性分析,也成为牦牛种质资源的保护和经济性状选育的主要手段。【前人研究进展】生肌决定因子1(Myostatin1,MyoD1)是肌肉调节因子(Muscle Regulatory Factors,MRFS)基因家族的一员,对成肌细胞的生长和分化具有重要的调控作用[3]。相关研究表明,牛MyoD1基因定位在第15号染色体上,全长2648 bp,由2个内含子和3个外显子组成[4-5]。MyoD1是调控骨骼肌生成或再生的一个重要转录因子,它能够激活肌肉基因转录,使非肌细胞转变为肌细胞,调控肌细胞的融合,促进成肌细胞分化为肌管,进而融合为肌纤维,是调控脊椎动物胚胎期肌肉发育过程的主调控因子[6],同时也是参与坏损组织修复。因此,MyoD1基因的改变影响肌肉组织结构的表达,产生的遗传改变对嫩度有影响。研究表明MyoD1与肉嫩度数量性状显著相关[7-8]。近年来,通过对影响牦牛生长发育等性状候选基因的研究,筛选出许多影响其经济性状的关键位点和分子标记[9,12]。目前,对牛、羊、鸡、鸭等家畜及家禽MyoD1基因的研究较多,但对牦牛的研究尚存在较大的空缺。【本研究切入点】鉴于此,本研究通过对西藏不同牦牛类群(品种)MyoD1基因的PCR-RFLP研究,筛选关键SNP位点,并与其体重、体高、体斜长、胸围、管围等生长性状进行关联性分析。【拟解决的关键问题】以期获得对牦牛重要经济性状具有显著效应的遗传标记,为解析牦牛重要经济性状的遗传基础,挖掘鉴定与生长发育、抗逆、产肉、产乳等性状相关的优异基因,促进牦牛育种工作提供科学依据。
1 材料与方法
1.1 材料
1.1.1 研究样品 选取4个具有代表性的西藏牦牛品种,分别为帕里(PL)26头、斯布(SB)30头、申扎(SZ)55头、类乌齐(LWQ)37头,共148头健康成年牦牛。采集耳组织,置于75 %的乙醇,带回实验室,-80 ℃保存备用,同时测定其体重、体高、体斜长、胸围、管围等体尺指标。
1.1.2 主要试剂与分析软件 DNA提取试剂盒(TIANGEN);TaqGreen PCR Master Mix(Thermo);琼脂糖(Amresco)、D2000DNA Ladder(BioMIGA)、EDTA、NAOH、甘油,XmaI酶(Thermo)等。
分析软件有:Primer Premier5.0、Excel2010、SPSS18.0、Popgen1.32、PIC-CALC、DNAMAN5.0、Chromas、Photoscape、BioEidit7.0.5、Watcut在线SNP-RFLP分析软件等。
1.2 方法
1.2.1 总DNA提取与检测 利用动物组织基因组DNA提取试剂盒,提取DNA,然后用紫外分光光度计检测浓度,1.5 %的琼脂糖检测其纯度,并置于-20 ℃保存备用。
1.2.2 构建DNA池及SNP查找 分别从每个品种中提取10头牦牛的DNA,共计40头,放4度冰箱使其单个自身混匀,1 d之后,测浓度(利用DNA试剂盒洗脱液做空白)。分别测出40个样的DNA浓度(上层,中层,下层),平均3次取平均值(需>50 ng/μl),每个稀释到50 ng/μl,所有稀释好的样品使其混匀,静止1周达到充分均匀。设计引物进行PCR扩增,将扩增产物进行测序并进行Chromas软件处理和DNAMAN比对序列,查找SNP位点。
1.3 引物设计及PCR产物扩增
1.3.1 引物设计 根据GenBank公布的牛MyoD1基因序列(Accession No:AC_000172),将内含子2以及外显子3的部分序列应用Primer Premier5.0软件设计引物(表1),引物由英潍捷基(上海)生物技术有限公司合成。

表1 牦牛MyoD1基因的引物序列
1.3.2 PCR产物扩增 PCR扩增总体系为25 μl:ddH2O 9.5 μl、上下游引物各1μl、DNA模板1μl、DreamTaqGreen PCR Master Mix(2×,1.25 mL) 12.5 μl。PCR反应程序为:95 ℃ 预变性2 min,95 ℃变性1 min,58 ℃退火45 s,72 ℃延伸1 min,循环35次;72 ℃延伸8 min,4 ℃保存。PCR产物经1.5 %的琼脂糖凝胶电泳0.5 h后用凝胶成像系统观察扩增情况,并保存结果。
1.4 PCR产物的XmaI酶切
将4 ℃保存的PCR产物进行酶切,酶切体系为20 μl:XmaI酶1.2 μl,10×Buffer 2 μl,ddH2O 8.8 μl,PCR产物8 μl。金属浴37 ℃,过夜酶切12 h。酶切产物用1.5 %的琼脂糖凝胶在80 V电压下电泳50 min后用凝胶成像系统观察酶切情况,并保存结果。
1.5 序列分析
PCR产物酶切处理后,显带分型,将不同基因型PCR产物纯化后送由上海生物工程技术有限公司测序。利用DNAMAN5.0将测序序列比对,确定突变位点。
1.6 数据处理
利用Excel2010、Popgen1.32、PIC-CALC等软件进行西藏4个牦牛品种多态信息含量(PIC)分析和Hardy-Weinberg平衡检测,以及基因型、基因频率、杂合度、有效等位基因数的计算。运用SPSS18.0软件采取最小二乘拟合线性模型(least squares fitting linear model)将不同基因型及体尺性状数据进行关联分析。
2 结果与分析
2.1 MyoD1-PCR扩增产物检测
对西藏4个牦牛类群不同个体进行PCR扩增,获得370 bp的目标片段(图1)。利用1.5 %琼脂糖凝胶电泳检测,其特异性好,均无杂带,与预期的实验结果一致,表明实验成功,具备后续实验的条件。

图1 MyoD1基因扩增产物琼脂糖凝胶电泳图Fig.1 Agarose gel electrophpresis of MyoD1 gene amplification products
2.2 PCR-RFLP分析
对西藏4个牦牛类群帕里(PL)、斯布(SB)、申扎(SZ)、类乌齐(LWQ)的不同个体进行XmaI酶切,通过2 %琼脂糖凝胶电泳检测分型,存在CC、CT、TT 3种基因型,分别为370 bp/50 bp、370 bp/320 bp/50 bp、370 bp(图2)。

第2、4、9泳道为TT型,3、5、8泳道为CC型,6、7、10泳道为CT型The 2,4,9 lanes are TT genotype: the3,5,8 lanes are CC genotype; the 6,7,10 lanes are CT genotype图2 西藏牦牛MyoD1片段PCR产物XmaI酶切电泳图Fig.2 Electrophoresis patterns of digesting PCR products of MyoD1 fragment with XmaI
2.3 SNPs位点筛选与检测
对不同基因型个体进行测序,分析测序峰图发现,在MyoD1基因第2内含子上并未检测到突变位点,在外显子3的部分序列中发现C-T点突变(C1710T,图3)。
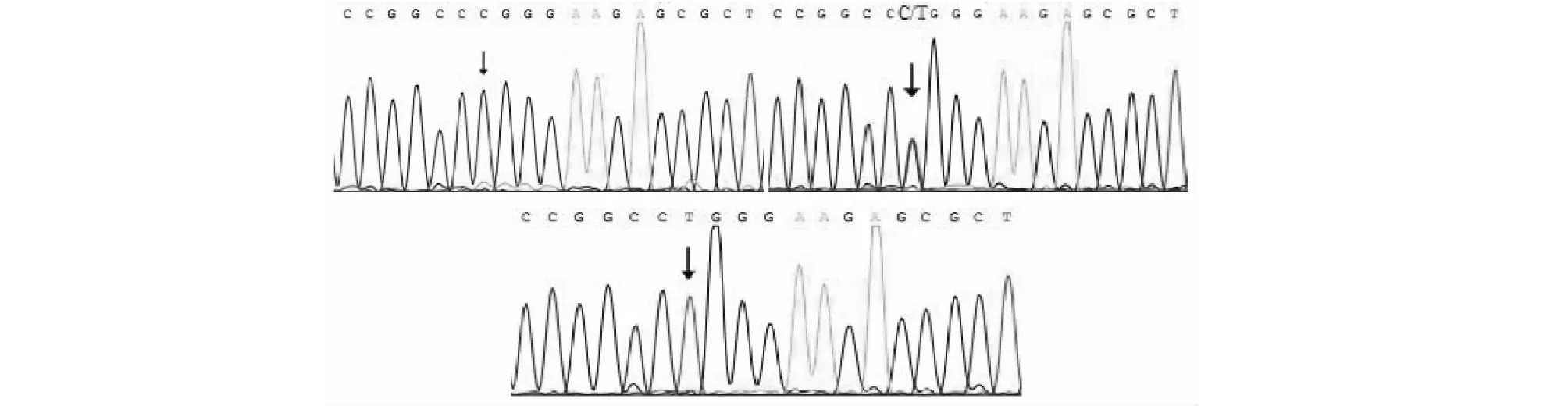
图3 MyoD1片段测序结果Fig.3 The results of sequencing of MyoD-Exon2 fragment

位点Loci品种Breeds个体数Individuals基因型频率Genotypes frequencies基因频率Allele frequenciesCCCTTTCTMyoD-C1710T帕里(PL)260.5000.3850.1150.6920.308斯布(SB)300.3330.5340.1330.6000.400类乌齐(LWQ)550.3460.5090.1450.3950.605申扎(SZ)370.1620.6220.2160.4730.527

表3 4个牦牛类群MyoD1基因1个SNP位点的Hardy-Weinberg平衡的χ2 检验
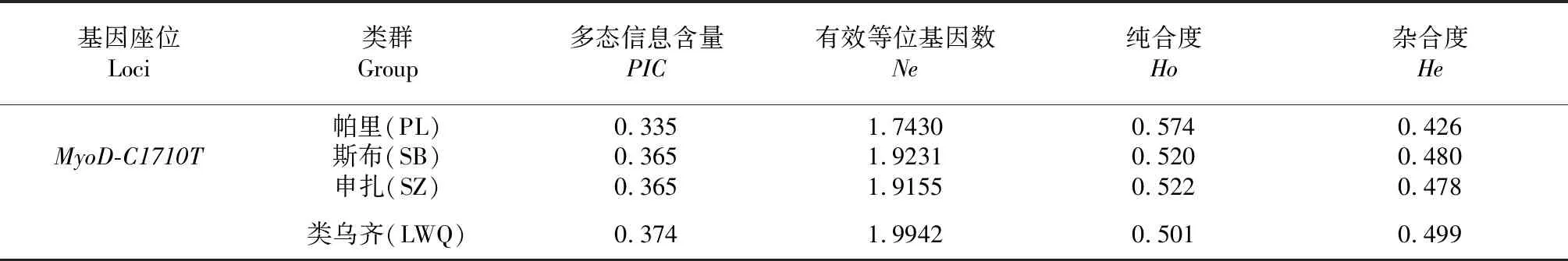
表4 4个牦牛类群MyoD1基因SNP位点的遗传多态性指标
2.4 突变位点的群体遗传学分析
2.4.1 基因型频率、等位基因频率、χ2检验 由表2,3可知,斯布(SB)、申扎(SZ)、类乌齐(LWQ)3个牦牛类群中杂合型(CT)为优势基因型,基因型频率分别为0.534、0.509和0.622,而帕里(PL)CC纯合型为优势基因,基因频率达到0.500。等位基因C在帕里(PL)和斯布(SB)中为优势基因,分别达到0.692和0.600。等位基因T在申扎(SZ)和类乌齐(LWQ)中为优势基因,分别达到0.605和0.527。χ2适合性检验显示,χ2分别为0.245、0.371、0.202和2.255,P值均大于0.05,均处于Hardy-Weinberg平衡状态。
2.4.2 多态指标分析 如表4所示,帕里(PL)、斯布(SB)、申扎(SZ)和类乌齐(LWQ)4个牦牛类群的多态信息含量(PIC)分别为0.335、0.365、0.365和0.374,均处于中度多态(0.25 利用SPSS18.0软件,根据最小二乘拟合线性模型,对西藏4个牦牛类群MyoD1基因外显子3上的C1710T突变位点的不同基因型与体尺指标进行关联分析。将4个牦牛类群共计148头个体整体进行多重比较,结果显示,CT基因型在身高、体重、体斜长、管围、胸围上均大于CC和TT基因型,但差异不显著(P>0.05);每个类群单独分析时,帕里牦牛CC基因型在体重、体斜长、胸围、管围上均大于CT和TT基因型,CT基因型在体高上大于CC和TT基因型,但差异不显著(P>0.05);斯布牦牛CT基因型在体重、胸围、管围上均大于CC和TT型,而体高和体斜长CC型大于CT和TT型,差异不显著(P>0.05);申扎牦牛CT型在体重、体高、胸围和管围上大于CC和TT型,而体斜长CC型长于CT和TT型,申扎牦牛C1710T突变位点TT和CT基因型与胸围存在显著相关性,CT型的胸围达到116.72 cm,TT型胸围为96.50 cm,相差达到了20.22 cm,差异显著(P<0.05;表5);类乌齐牦牛在生长性状指标上CT型均高于CC和TT型,CT型为优势基因型,但差异不显著,不存在关联性。 表5 申扎牦牛MyoD1基因Xmal位点对体尺性状的影响(平均数±标准误) 注:不同小写字母表示差异显著(P<0.05)。 Note:The different scripts (a,b) mean differ significantly (P<0.05). 目前,MyoD1基因多态性研究在人,小鼠和猪等物种中开展的较早且全面,而对羊和牛等反刍动物的研究相对滞后[13]。1987年Davis[14]利用小鼠的MyoD基因作为探针,克隆并分离了人的MYF3基因,后被证实为MyoD基因。在对猪的研究中,Knoll等[15,18]研究表明猪MyoD基因内含子1上存在DdeI-PCR-RFLP位点,且该位点显著影响眼肌面积、腿臀比例、胴体瘦肉率、皮脂含量和胴体长度,从而间接影响猪肉品质,Lee等[19]研究显示,猪的MyoD基因不同的单核苷酸多态性影响其基因的表达水平,并且其在一定程度上对瘦肉率、肌纤维特性及肉质性状存在影响。田璐等[20]在对黄牛的研究中发现MyoD基因第二内含子39和112 bp处存在突变位点,且这2个位点对肉牛的宰前活重、胴体重和净肉重等有显著影响。贾伟德[21]在牛MyoD基因家族多态性及其与肉质性状的关联性分析中发现该基因第1外显子166 bp处有一处突变。黄萌等[22]在对肉牛的研究中发现MyoD基因的第3外显子1867 bp处存在突变位点,且不同基因型对肉牛的背膘厚和大腿肉厚的具有显著影响。赵金红等[23]研究显示,牛MyoD基因第1外显子782 bp处发现一处突变,与肌纤维发育、肌肉色泽和肉质嫩度等方面都密切相关。已发现的多态位点均与基因的表达存在关联,而本研究所发现的突变位点尚未见报道。 本研究通过随机挑选1/3左右的样本建立DNA池,初步确定了西藏牦牛的突变位点,利用在线SNP-RFLP分析软件筛选出来的XmaI酶对西藏牦牛所有样本进行PCR-RFLP分型,分型后对不同基因型进行测序,测序与酶切分型结果一致。研究显示,斯布(SB)、申扎(SZ)、类乌齐(LWQ)3个牦牛类群中杂合型(CT)为优势基因,表现出杂合优势,与张润峰[13]在牛MRF家族基因变异及其与生长性状的相关分析中,黄牛群体MyoD基因突变位点基因型杂合型均高于纯合型结果一致;帕里(PL)牦牛纯合型(CC)为优势基因,与田璐等[20]在MyoD基因对肉牛胴体性状影响的分析中,AA型呈现优势基因情况相似,说明MyoD基因在不同物种中突变位点的优势基因型与关联性状、分析个体及突变位点本身有关,除此之外,可能有以下的原因:①所研究的样本量太小,没有反应出真实的水平,在一定范围内样本量大小与所观测到的等位基因的检出率呈正相关,同时杂合度较低的位点随样本变化波动较大[24]。②该位点的选择可能存在一些性状的影响因素或与之连锁的基因,有证实FoxO1基因和MyoD1基因有着相互调控的关系,共同发挥其生物学功能[25,28]。 突变位点经卡方适合性检验得到,χ2分别为0.245、0.371、0.202、2.255,均处于Hardy-Weinberg平衡状态(P>0.05)。由此可知,在有突变的情况下,经自然选择,加上人为选育的干扰,最终各种因素相互抵消,使得群体仍处于遗传动态平衡状态。通过对C1710T突变位点多态性指标的分析可知,多态信息含量(PIC)均处于中度多态(0.25 利用候选基因多态性与西藏牦牛生长性状关联分析,148头牦牛划成一个整体进行多重比较,结果发现在身高、体重、体斜长、管围和胸围上的均值CT型均大于CC和TT型,且对4个群体单独分析时,帕里牦牛在体重、体斜长、胸围和管围上的均值CC型均大于CT、TT型,斯布牦牛体高和体斜长CC型大于CT和TT型,申扎牦牛在体斜长CC型长于CT和TT型,类乌齐牦牛在5项生长性状指标上CT型均高于CC和TT型,但以上指标差异均不显著,类乌齐牦牛基因型与生长性状的相关性与多重比较分析一致。原因可能有:①部分种群的数量采集的不够充足,基因型在群体中分布不均。在对不同品种牛的研究上已验证过[29]。②4个类群分布区域、海拔高度及地域文化、经济发展程度、人工选育程度均存在差异,使其遗传特性不同,以致在体型外貌、血液蛋白、染色体特征及DNA分子等多个不同层次上存在差异,研究显示以上类群均具有丰富的遗传多样性[30]。 申扎牦牛MyoD1基因外显子3上的多态位点与体尺性状关联分析,得到TT和CT基因型与胸围存在着相关性,差异显著(P<0.05),可能和申扎所处地理位置及气候条件有关。申扎县位于西藏西部,平均海拔达4750 m,高山、丘陵和盆地交错,为高原亚寒带季风性气候,主要分布高山灌丛草甸草场,因海拔较高,生态条件恶劣,植被草场长势较差,使申扎牦牛整体发育情况较其它牦牛类群差,前期对申扎牦牛大群体生长指标测定显示,申扎牦牛是目前西藏自治区现有牦牛类群中个体发育最小的一个类群。相比较其他地区,亚东县帕里镇,帕里牦牛的主要产区,平均海拔达4640 m,冰雪融水量丰富,草场主要分布高寒草甸草场、亚高山草场,牧草充足,是发展牧业好地方。而西藏自治区昌都市类乌齐县,平均海拔达4500 m,俗称“西藏小江南”,这里昼夜温差较大,但光照充足,气候类型为高原温带半湿润性气候,牧草产量丰富,同时类乌齐牦牛膘肥体壮、肉质鲜嫩,被列为地理标志保护产品。斯布牦牛分布于西藏自治区拉萨河流域周围,平均海拔约4000 m,气候温暖而湿润,牧草长势良好,牦牛于斯布河谷周围终年放牧,耐粗饲,繁殖力较高,人为选育的因素较小。总之,申扎牦牛分布区域的气候条件与帕里,斯布,类乌齐相比更加的恶劣,牧草资源匮乏,总能量存在着夏季富余、冬季不足的现象,生态系统脆弱,抗干扰能力差。长期以往,牧草长势好坏直接影响牦牛体格,形成表观遗传学,适应当地的气候和生态条件。同时申扎县多农牧产业相结合,牦牛选育程度较高,现拥有建成的牦牛育肥实验基地。人为选育的作用不同[31],同时生态气候因子对牦牛的体型有着直接的影响[32],这两个因素共同影响其遗传选择[33]。 Verner等[34]报道猪的MyoD基因多态性与大理石花纹性状具有极显著相关性;田璐等[20]在3个不同品种的黄牛(鲁西牛、晋南牛、秦川牛)和4个杂交牛品种中,对MyoD基因第二内含子SSCP多态位点进行检测,发现多态位点与胴体性状(如胴体重、净肉重、高档肉重、眼肌面积)差异显著;Bhuiyan等[35]研究结果表明MyoD基因与生长和胴体性状具有极显著相关性;在2012年,褚敏等[36-37]在对180头成年甘南牦牛和296头成年大通牦牛的MyoD1基因研究发现,发现多态位点与体尺性状差异显著。通过以上研究显示,MyoD基因可作为影响不同物种生长发育及肉质性状的候选基因。通过对西藏牦牛的MyoD1基因的研究,C1710T多态位点与申扎牦牛胸围存在相关性,为后续研究提供了依据,可进一步扩大样本量,广泛开展对不同品种的研究,增加调控区段的多态性位点的研究,进一步了解基因的遗传效应,为选育自己有特色的地方牦牛品种提供贡献以及带来经济效益,为少数民族地区带来福祉。 综合西藏牦牛MyoD1基因结构和生物学功能的基础资料,MyoD1基因内含子2上未发现突变位点,外显子3上发现一个SNP(C1710T),为XmaI酶切位点。基因型与生长性状关联分析可知,申扎牦牛CT型和TT型基因型个体存在显著差异(P<0.05),3种基因型与胸围显著相关,其他牦牛类群差异均不显著。4个群体MyoD1外显子3上的C1710T突变位点多态性高,遗传变异大。申扎牦牛C1710T多态位点可能是影响体尺性状的重要功能基因座,是一个作为改良生长性状的遗传位点,具有很好的研究价值。2.5 MyoD1基因XmaI位点多态性和生长性状关联分析

3 讨 论
3.1 候选基因多态位点的关联性
3.2 候选基因多态性与西藏牦牛生长性状的相关性讨论
4 结 论

