黄花蒿浸提液对2种蔬菜种子萌发及幼苗生长的化感效应
霍鸿浩,罗世琼,杨占南*,张曲玲,韦小芳,扶 蝶
(1.贵州师范大学 贵州省山地环境信息系统与生态环境保护重点实验室,贵州 贵阳 550001;2.贵州师范大学生命科学学院,贵州 贵阳 550001)
【研究意义】化感作用(allelopathy)早在公元前就被人类所发现,是自然界普遍存在的一种重要的化学生态防御机制[1]。1992年国家科学名词审定委员会把它正式定名为“化感作用”,即植物或微生物通过代谢活动对周围其它植物或微生物所产生的有利或不利的作用[2]。黄花蒿(ArtemisiaannuaL.)又名香蒿、草青蒿、臭青蒿,属菊科艾属1年生草本植物。具有清虚热,除骨蒸,解暑热,截疟,退黄等功效,为我国传统的中草药,是提取青蒿素的唯一原料来源[3]。随着青蒿素被发现可以治疗疟疾,日前成为我国唯一获得国际承认的扰疟新药,因此,药用价值备受关注。【前人研究进展】但黄花蒿作为侵入荒地的先锋植物,也是常见农田杂草,其对周围植物的化感作用多有报导。DELABAYS等[4]研究发现,黄花蒿抑制周围杂草和玉米的生长。王硕等[5]以小麦(TriticumaestivumL.)为受体,研究了黄花嵩水浸提液对小麦幼苗生长和各种抗氧化酶活性有化感效应。【本研究切入点】贵州属于我国黄花蒿的主产区之一[6],而小白菜(Brassicachinensis)和萝卜(Raphanussativus)是当地秋冬季的主要种植蔬菜,属于黄花蒿的后茬作物,埋入土壤中的残体会对作物的生长产生影响,目前有关黄花蒿各部位浸提液对其后茬作物影响的研究报道极少。【拟解决的关键问题】为此,以小白菜和萝卜种子为研究对象,研究黄花蒿植株浸提液对其种子及幼苗生长的影响,以探明土壤连作障碍规律,为黄花蒿的友好栽培及其次生代谢组分的进一步开发利用提供依据。
1 材料与方法
1.1 材料
1.1.1 黄花蒿 黄花蒿植株,采自贵州省贵阳市周边地区,经自然风干,将根、茎、叶分开,分别粉碎过100目筛,分装,常温避光保存。
1.1.2 蔬菜种子 萝卜(Raphanussativus)和小白菜(Brassicachinensis)种子,购于贵阳万东桥种子门市部。
1.2 方法
1.2.1 黄花蒿水浸提液的制备 将粉碎后的黄花蒿根、茎、叶样品各称取 70 g,分别放入1 L三角瓶中,加去离子水 700 mL,密封扎紧后放入振荡器中浸提48 h(振荡温度为25 ℃,转速为 141 r/min),离心后取上清液,得到水浸提母液,置于4 ℃ 冰箱密封保藏备用[7]。
1.2.2 种子处理 选取饱满健康、大小一致的萝卜和小白菜种子,用0.5 % 的H2O2消毒10 min,无菌水冲洗5次[8]。
1.2.3 萌发试验 黄花蒿浸提液共设3个浓度处理,即将黄花蒿根、茎 、叶母液用去离子水分别稀释成浓度(V/V)为10 %(T1)、30 %(T2)和50 %(T3)处理溶液,以等量去离子水处理为对照(CK)。采用室内培养法,在直径为10 cm的培养皿内平铺两层定性滤纸,放入经消毒处理的100粒小白菜和萝卜种子,均匀平铺,每个处理浓度4次重复。每个培养皿分别加入20 mL不同处理浓度的黄花蒿根、茎、叶水浸提液,CK加20 mL去离子水。之后每天加入适量的去离子水,使滤纸保湿,于(25±1) ℃恒温室,自然光照下培养。每天记录发芽率直至发芽结束。
萌发率=(发芽种子总数/供试种子总数)×100 %。
1.2.4 化感效应 参照文献[13]的方法,以化感作用抑制率(Inhibitory rate, IR)作为化感效应的研究指标。
IR=[(Ti-T0)/T0]×100 %
式中,Ti为测试项目的处理值,T0为对照值。IR≥0 表示具有促进作用,IR<0 表示具有抑制作用。IR绝对值越大,表明其化感作用潜力(促进或抑制作用)越大。
1.2.5 指标测定 幼苗生长后15 d,测量不同处理下2种幼苗的根长、茎长、鲜重和干重,以及幼苗的叶片超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和丙二醛(MDA)含量。超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法测定[9],过氧化氢酶(CAT)采用紫外吸收法测定[10],过氧化物酶(POD)活性采用愈创木酚法测定[11],丙二醛(MDA)含量参照文献[12]的方法测定。
1.3 数据处理
采用Excel 2010对数据进行统计分析与作图,SPSS13.0进行方差分析和显著性检验。
2 结果与分析
2.1 黄花蒿浸提液对小白菜及萝卜种子萌发率的影响
从图1 看出,不同浓度黄花蒿根、茎、叶浸提液处理,小白菜种子萌发率的变化趋势与萝卜种子基本一致。黄花蒿根、茎、叶浸提液处理浓度为10 %时,小白菜种子的萌发率较对照分别降低8.0 %、19.8 %和15.3 %,说明其对小白菜种子的萌发率具有显著的抑制作用;萝卜种子的萌发率较对照分别降低15.0 %、7.0 %和10.3 %,说明其对萝卜种子的萌发率也具有显著的抑制作用。黄花蒿根、茎、叶浸提液处理浓度为50 %时,小白菜种子的萌发率较对照分别降低55.5 %、49.5 %和59.0 %,说明其对小白菜和萝卜种子的萌发率具有显著的抑制作用;萝卜种子的萌发率较对照分别降低42.8 %、52.5 %和54.3 %,说明其对萝卜种子的萌发率也具有显著的抑制作用。
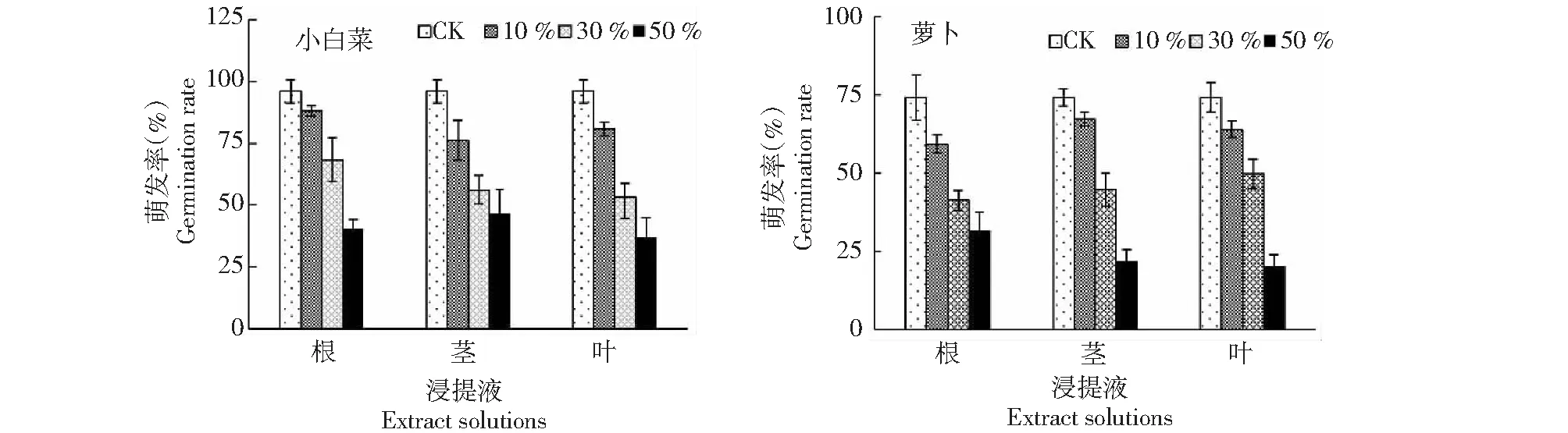
图1 黄花蒿根、茎、叶浸提液处理小白菜及萝卜种子的萌发率Fig.1 Germination rate of B. chinensis(A)and R. sativus(B) seeds treated with different extracts from Artemisia annua roots, stems and leaves
2.2 黄花蒿浸提液对小白菜及萝卜幼苗生长的影响
2.2.1 幼苗生长 从表 1 可知,黄花蒿根、茎、叶浸提液处理浓度为10 %时,小白菜及萝卜幼苗的根长、茎长和整株干重均较对照(CK)差异不显著;其处理浓度为30 %和50 %时,小白菜幼苗根长分别为2.31和0.52 cm、2.87和0.86 cm、2.52和0.66 cm,茎长分别为2.52和 1.47 cm、2.77和1.36 cm、2.76和1.44 cm,整株干重分别为16.9和12.2 mg/株、16.4和12.1 mg/株、20.2和13.9 mg/株,3个指标中除30 %的根浸提液处理的整株干重外均显著低于CK;萝卜幼苗根长分别为3.26和2.83 cm、3.41和1.34 cm、4.15和0.96 cm,茎长分别为3.42和3.12 cm、4.07和2.85 cm、4.18和2.01 cm,整株干重分别为44.5和44.1 mg/株、68.7和23.5 mg/株、48.4和21.3 mg/株,3个指标均显著低于CK。说明,黄花蒿浸提液在低浓度下对小白菜和萝卜幼苗根长、茎长及幼苗生长的抑制作用不显著,而在高浓度下对小白菜和萝卜幼苗根长、茎长及幼苗生长具有显著的抑制作用。
2.2.2 幼苗生长化感效应 从表2看出,黄花蒿根、茎、叶浸提液处理浓度为10 %时,对小白菜幼苗根长、茎长和植株干重化感作用抑制率分别为-17.7 %、9.4 %、10.0 %,5.2 %、9.4 %、11.7 %,-13.5 %、2.1 %、0.7 %,说明低浓度根浸提液对小白菜根长和植株干重有一定的抑制作用,而对茎长有一定的促进作用,而茎和叶浸提液对小白菜根长、茎长和植株干重均有一定的促进作用;对萝卜幼苗根长、茎长和植株干重的化感作用抑制率分别为-14.9 %、6.0 %、13.1 %,7.9 %、10.4 %、-14.7 %,0.8 %、11.7 %、-21.0 %,说明低浓度根浸提液对萝卜幼苗根长有一定的抑制作用,对茎长和植株干重有一定的促进作用,茎浸提液对小白菜根长、茎长和植株干重均有一定的促进作用,叶浸提液对小白菜幼苗根长有一定的促进作用,对幼苗茎长和植株干重均有一定的抑制作用。黄花蒿根、茎、叶浸提液处理浓度为50 %时,对小白菜幼苗根长、茎长和植株干重的化感作用抑制率分别为-81.2 %、-53.2 %和-45.1 %,表明高浓度的黄花蒿浸提液对小白菜幼苗具有较强的抑制化感作用,且对幼苗根长和茎长及整株干重的化感效应存在差异,其作用大小为根>茎>整株;对萝卜化感作用的抑制率分别为-84.3 %、-58.3 %和-74.6 %,表明高浓度的黄花蒿浸提液对萝卜幼苗具有较强的抑制化感作用,且对根长和茎长及整株干重的化感效应也存在差异,其作用大小为根>整株>茎。
表1黄花蒿根、茎、叶浸提液处理小白菜和萝卜幼苗的生长情况
Table 1 Seedling growth status ofB.chinensisandR.sativusseeds treated with different extracts fromArtemisiaannuaroots, stems and leaves

浸提液Extract处理浓度(%)Concentration小白菜幼苗B. chinensis seedling萝卜幼苗R. sativus seedling根长(cm)茎长(cm)整株干重(mg/株)根长(cm)茎长(cm)整株干重(mg/株)根Root0(CK)3.51±0.91 a3.28±0.20 a25.3±4.8 a6.10±1.43 a4.82±0.65 a84.1±8.14 a102.89±0.27 a3.24±0.27 a21.9±3.4 a5.19±0.72 a5.2±0.79 a84.8±6.40 a302.31±0.35 b2.52±0.28 b16.9±2.3 a3.26±0.78 b3.43±0.46 b44.5±6.32 b500.52±0.27 c1.47±0.35 c12.2±1.6 b2.83±1.04 b3.12±0.48 b44.1±4.60 b茎Stem0(CK)3.51±0.91 a3.28±0.20 a25.3±4.8 a6.10±1.43 a4.82±0.65 a84.1±8.14 a103.84±0.48 a3.37±0.29 a25.8±3.1 a6.47±0.77 a5.32±0.55 a93.9±7.62 a302.87±0.41 b2.77±0.30 b16.4±1.3 b3.41±0.45 b4.07±0.77 b68.7±5.01 b500.86±0.29 b1.36±0.22 b12.1±1.0 c1.34±0.37 c2.85±0.55 b23.5±6.43 c叶Leaf0(CK)3.51±0.91 a3.28±0.20 a25.3±4.8 a6.10±1.43 a4.82±0.65 a84.1±8.14 a103.86±0.56 a3.44±0.28 a25.5±2.8 a6.9±1.49 a4.11±0.55 a76.4±8.20 a302.52±0.61 b2.76±0.33 b20.2±2.4 b4.15±0.68 b4.18±0.48 b48.4±5.01 c500.66±0.21 c1.44±0.21 b13.9±1.5 b0.96±0.55 c2.01±0.72 b21.3±4.44 d
注:相同部位浸提液各浓度处理同列不同小写字母表示差异显著(P<0.05)。
Note: Different lowercase letters in the same column indicate significance of difference atP< 0.05 level.
表2黄花蒿根、茎、叶浸提液处理小白菜及萝卜幼苗生长的化感效应
Table 2 Allelopathic effects of different extracts fromArtemisiaannuaroots, stems and leaves on growth ofB.chinensisandR.sativusseedlings
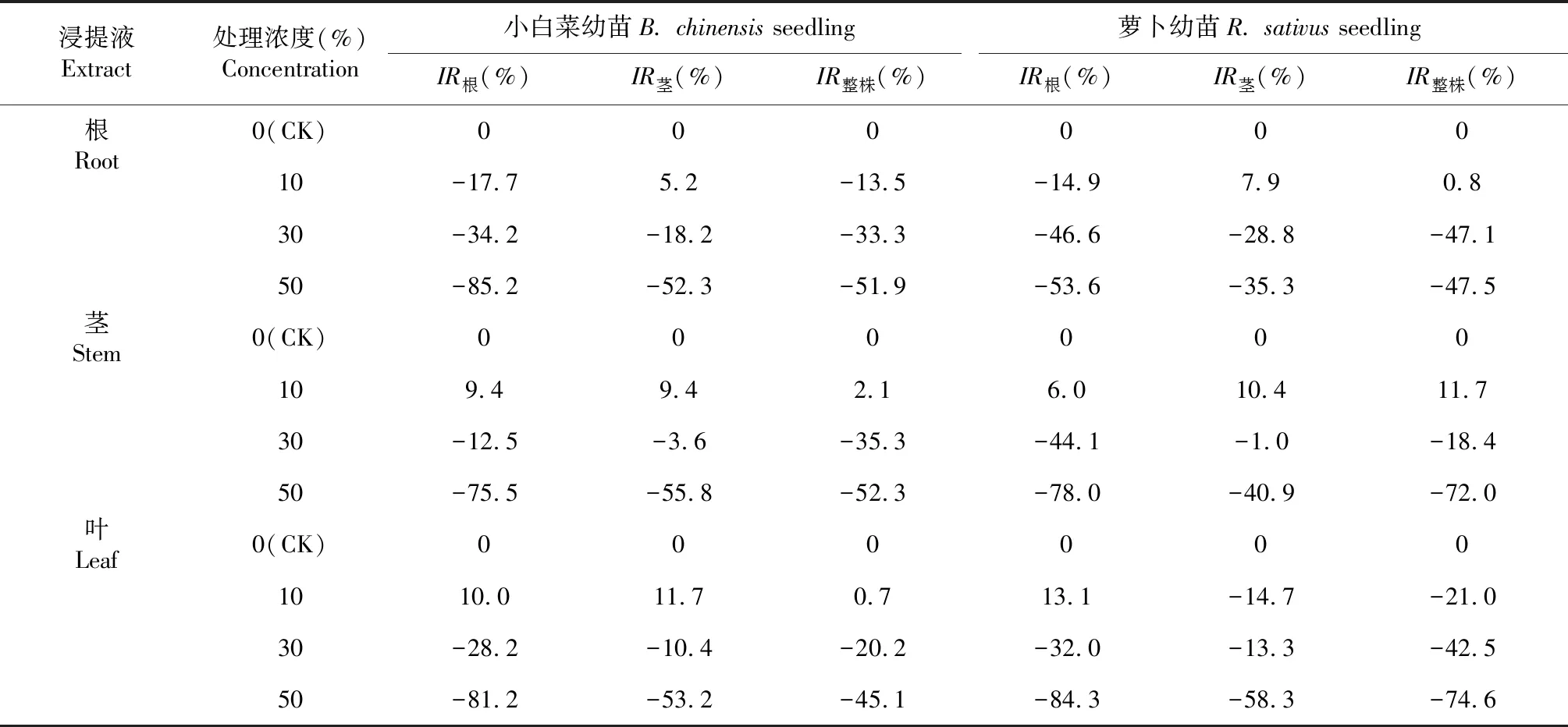
浸提液Extract处理浓度(%)Concentration小白菜幼苗B. chinensis seedling萝卜幼苗R. sativus seedlingIR根(%)IR茎(%)IR整株(%)IR根(%)IR茎(%)IR整株(%)根Root0(CK)00000010-17.75.2-13.5-14.97.90.830-34.2-18.2-33.3-46.6-28.8-47.150-85.2-52.3-51.9-53.6-35.3-47.5茎Stem0(CK)000000109.49.42.16.010.411.730-12.5-3.6-35.3-44.1-1.0-18.450-75.5-55.8-52.3-78.0-40.9-72.0叶Leaf0(CK)0000001010.011.70.713.1-14.7-21.030-28.2-10.4-20.2-32.0-13.3-42.550-81.2-53.2-45.1-84.3-58.3-74.6
2.3 黄花蒿浸提液对小白菜及萝卜幼苗抗氧化物酶活性及丙二醛含量的影响
2.3.1 过氧化物酶(POD) 从图2看出,黄花蒿根、茎、叶浸提液处理浓度为10 %时,小白菜的幼苗叶片POD活性分别为854.5、885.5和930.5 U/(g·min),分别较CK显著提高25.1 %、19.0 %和14.8 %,说明低浓度黄花蒿根、茎、叶浸提液对其POD活性均具有促进作用;萝卜的幼苗叶片POD活性分别为753.5、542.0和814.7 U/(g·min),分别较CK显著提高81.8 %、30.8 %和96.6 %,说明低浓度黄花蒿浸提液对其POD活性均具有较强促进作用。黄花蒿根、茎、叶浸提液处理浓度为30 %时,小白菜幼苗叶片的POD活性分别为812.5、773.5和649.5 U/(g·min),根、茎浸提液处理均显著高于CK,叶浸提液处理显著低于CK,说明,30 %的黄花蒿根、茎浸提液处理对其POD活性具有促进作用,叶浸提液处理对其POD活性具有抑制作用;萝卜幼苗叶片的POD活性分别为626.7、661.5和626.3 U/(g·min),均显著高于CK,说明,30 %的黄花蒿根、茎、叶浸提液处理均对其POD活性均具有促进作用。黄花蒿根、茎、叶浸提液处理浓度为50 %时,小白菜的幼苗叶片的POD 活性分别为662.0、646.0和545.0 U/(g·min),分别较CK显著降低26.5 %、13.0 %和10.9 %,说明,高浓度黄花蒿根、茎、叶浸提液处理对其POD活性均具有抑制作用;萝卜的幼苗叶片的POD 活性分别为458.3、388.7和356.0 U/(g·min),根浸提液处理显著高于CK,茎、叶浸提液处理均显著低于CK,说明,高浓度黄花蒿根浸提液对其POD活性具有促进作用,茎、叶浸提液则对其POD活性具有抑制作用。
2.3.2 过氧化氢酶(CAT) 由图3可知,黄花蒿根、茎、叶浸提液处理浓度为10 %时,小白菜幼苗叶片CAT 活性分别为203.5、238.5和199.4 U/g,均显著高于CK,分别较CK显著提高23.5 %、5.4 %和3.3 %,说明,低浓度黄花蒿根、茎、叶浸提液对其CAT活性具有促进作用;萝卜幼苗叶片CAT活性分别为112.8、113.8和128.3 U/g,根、茎浸提液处理均显著低于CK,叶浸提液处理则高于CK,说明,低浓度黄花蒿根、茎浸提液对其CAT活性具有抑制作用,而叶浸提液对其CAT活性具有促进作用。黄花蒿根、茎、叶浸提液处理浓度为30 %时,小白菜幼苗叶片CAT 活性分别为233.5、236.5和242.5 U/g,均显著高于CK,说明,30 %的黄花蒿根、茎、叶浸提液对其CAT活性均具有促进作用;萝卜幼苗叶片CAT活性分别为171.5、187.0和164.0 U/g,均显著高于CK,说明,30 %的黄花蒿根、茎、叶浸提液对其CAT活性均具有促进作用。黄花蒿根、茎、叶浸提液处理浓度为50 %时,小白菜幼苗叶片CAT 活性分别为219.0、207.5和225.5 U/g,均显著的低于CK,说明,高浓度黄花蒿根、茎、叶浸提液对其CAT活性具有促进作用,且其活性均随浸提液浓度的升高呈先升高后降低趋势;萝卜幼苗叶片CAT 活性分别为162.5、126.3和119.5 U/g,根、茎浸提液处理均高于CK,叶浸提液处理则低于CK,说明,高浓度黄花蒿根、茎浸提液对其CAT活性具有促进作用,而叶浸提液对其CAT活性具有抑制作用。
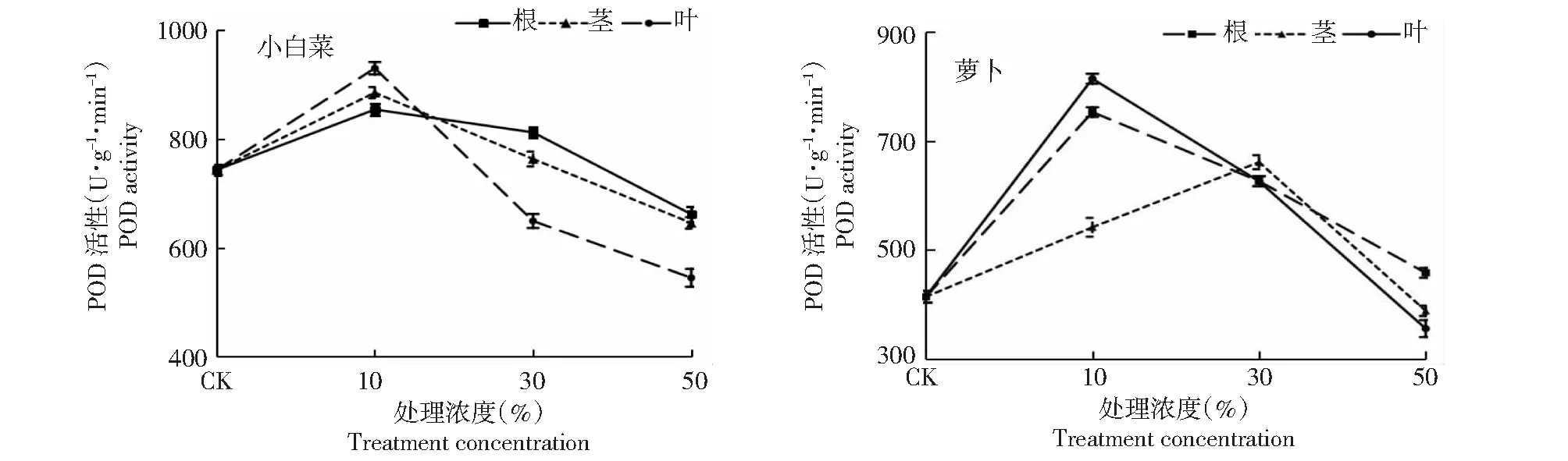
图2 黄花蒿根、茎、叶浸提液处理小白菜和萝卜幼苗的过氧化物酶(POD)活性Fig.2 Leaf POD activity of B. chinensis and R. sativus seeds treated with different extracts from Artemisia annua roots, stems and leaves

图3 黄花蒿根、茎、叶浸提液处理小白菜和萝卜幼苗的过氧化氢酶(CAT)活性Fig.3 Leaf CAT activity of B. chinensis and R. sativus seeds treated with different extracts from Artemisia annua roots, stems and leaves
2.3.3 超氧化物歧化酶(SOD) 从图4看出,黄花蒿根、茎、叶浸提液处理浓度为10 %时,小白菜幼苗叶片SOD活性分别为174.9、178.7和193.6 U/g,均显著高于CK,说明低浓度黄花蒿根、茎、叶浸提液对其SOD活性具有促进作用;萝卜幼苗叶片SOD活性分别为156.6、176.6和175.4 U/g,根浸提液处理显著低于CK,茎、叶浸提液处理均高于CK,说明,低浓度黄花蒿根浸提液对其SOD具有抑制作用,而茎、叶浸提液对其SOD活性具有促进作用。黄花蒿根、茎、叶浸提液处理浓度为30 %时,小白菜幼苗叶片的SOD 活性分别为152.9、209.7和159.9 U/g,均显著高于CK,说明30 %的黄花蒿根、茎和叶浸提液对其SOD 活性均具有促进作用;萝卜幼苗叶片SOD活性分别为179.4、188.2和207.4 U/g,均显著高于CK,说明30 %的黄花蒿根、茎和叶浸提液对其SOD 活性均具有促进作用。黄花蒿根、茎、叶浸提液处理浓度为50 %时,小白菜幼苗叶片SOD 活性分别为134.5、143.0、98.3 U/g,均显著的低于CK,说明高浓度黄花蒿根、茎、叶浸提液对其SOD活性具有抑制作用,且其SOD活性均随处理浓度的升高呈先升后降趋势;萝卜幼苗叶片SOD活性分别为134.1、119.1和69.0 U/g,均显著低于CK,说明高浓度黄花蒿根、茎、叶浸提液对其SOD活性均具有抑作用。

图4 黄花蒿根、茎、叶浸提液处理小白菜和萝卜幼苗的超氧化物歧化酶(SOD)活性Fig.4 Leaf SOD activity of B. chinensis and R. sativus seeds treated with different extracts from Artemisia annua roots, stems and leaves
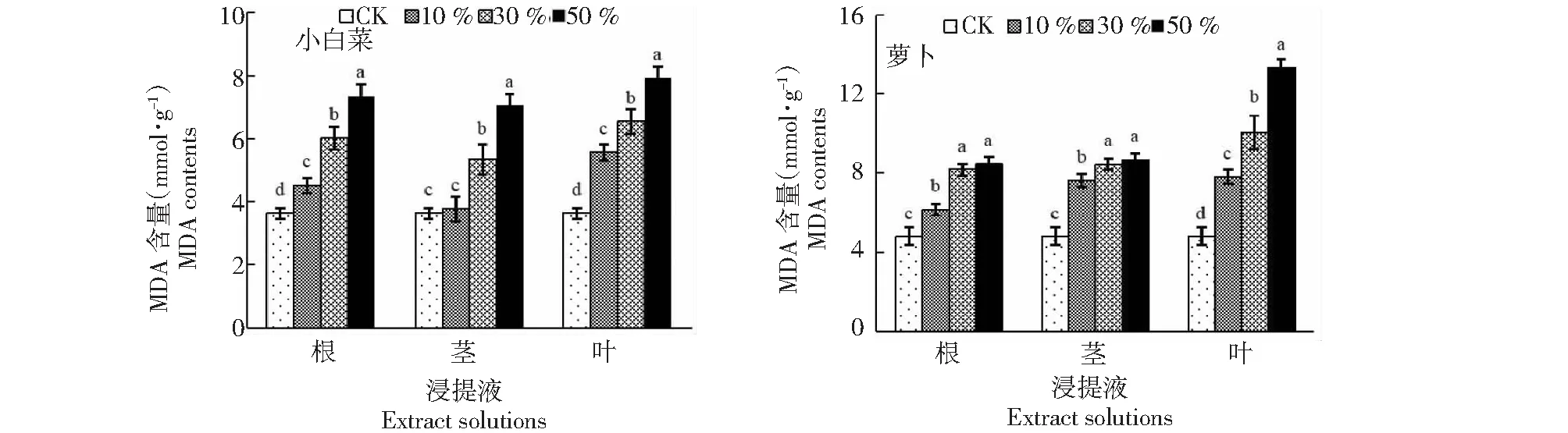
不同小写字母表示相同部位浸提液各浓度处理间差异显著(P<0.05)Different lowercase letters indicate significance of difference at P < 0.05 level between different concentration treatments of the same extract图5 黄花蒿根、茎、叶浸提液处理小白菜和萝卜幼苗的丙二醛(MDA)含量Fig.5 MDA content in leaves of B. chinensis and R. sativus seeds treated with different extracts from Artemisia annua roots, stems and leaves
2.4 丙二醛(MDA)
从图5可知,黄花蒿根、茎、叶浸提液处理浓度为10 %时,小白菜幼苗叶片 MDA 含量分别为4.63、3.78和5.57 mmol/g,均高于CK,说明低浓度黄花蒿根、茎、叶浸提液处理均有利于提高其MDA 含量;萝卜幼苗叶片MDA含量分别为6.14、7.64和7.82 mmol/g,均显著高于CK,说明低浓度黄花蒿根、茎叶浸提液处理均有利于提高其MDA 含量。黄花蒿根、茎、叶浸提液处理浓度为30 %时,小白菜幼苗叶片MDA含量分别为6.02、5.33和6.55 mmol/g,均显著高于CK,说明30 %的黄花蒿根、茎、叶浸提液处理均有利于提高其MDA 含量;萝卜幼苗叶片MDA含量分别为8.18、8.44 和10.05 mmol/g,均显著高于CK,说明30 %的黄花蒿根、茎、叶浸提液处理均有利于提高其MDA 含量。黄花蒿根、茎、叶浸提液处理浓度为50 %时,小白菜幼苗叶片MDA含量分别为7.36、7.05和7.93 mmol/g,均显著高于CK,说明,高浓度黄花蒿根、茎、叶浸提液处理均有利于提高其MDA含量,且MDA含量均随其处理浓度的增大而提高,幼苗叶片内膜脂过氧化程度随处理浓度增大而加重; 萝卜幼苗叶片MDA含量分别为8.48、8.67、13.33 mmol/g,均高于CK,说明高浓度黄花蒿根、茎、叶浸提液处理均有利于提高其MDA含量,其MDA含量均随其处理浓度的增大而提高,幼苗叶片内膜脂过氧化程度随处理浓度增大而加重。
3 讨 论
研究结果表明,黄花蒿根、茎、叶浸提液处理均对小白菜和萝卜种子发芽率和幼苗生长产生显著影响,表明其浸提液中含有化感抑制物质,且具有浓度效应。随处理浓度增加,对小白菜和萝卜种子萌发的抑制率越大。小白菜和萝卜根长化感抑制率均大于茎长,表明小白菜和萝卜幼苗茎对黄花蒿化感物质更加敏感,小白菜和萝卜胚根伸长受到抑制,可能是因为胚根直接与化感物质接触抑制了其细胞分裂和伸长,进而抑制种子萌发和幼苗生长所致,与DAYAN等[14-15]结论一致。
除具有浓度和种间效应外,黄花蒿不同部位(根、茎、叶)浸提液的化感效应也存在差异。其中,叶浸提液的抑制作用最大,可能是黄花蒿的化感物质主要分布在叶片组织中。至少有39个属的菊科植物存在化感作用,其化感物质多为萜类、聚乙炔类、酚类和有机酸类等,这些物质对多种受试植物表现出不同程度的抑制或促进效应[16],所以菊科植物多易形成入侵植物。任艳萍等[17]研究发现,入侵植物黄顶菊叶片的浸提液对白菜发芽的化感效应最显著。颜红果等[18]研究了羽芒菊对4种农作物的化感作用,验证了未来对其作为天然除草剂进行开发利用的可能。菊科植物黄花蒿内含萜类、黄酮类、香豆素类、酚类、类固醇、嘌呤、脂类及脂肪族等多种化合物。其中,萜类和黄酮类物质最为丰富,在叶片中含量最高,是黄花蒿最主要的化感成分[19-21]。白祯等[22]用青蒿素对小白菜种子进行化感试验,同样出现小白菜生长受到严重抑制的现象。

黄花蒿拥有极强的化感物质,通过植株残体腐解、雨水淋溶、根系分泌等多种途径进入土壤和水体中,抑制后茬作物的生长。小白菜和萝卜作为当地有代表性的后茬作物,受黄花蒿化感作用的影响较大,建议种植小白菜和萝卜时应加强田间管理,警惕周围黄花蒿的入侵,播种前充分灌溉、挖除植物残体,育苗移栽也是加速化感物质降解、降低后茬作物化感作用的有效措施。当然,该研究仅为室内试验结果,在复杂田间的环境下,黄花蒿化感物质的释放量对后茬作物的影响还有待进一步深入研究。
4 结 论
黄花蒿根、茎、叶水浸提液中含有化感抑制物质,其浸提液均对小白菜和萝卜种子的发芽率和幼苗生长产生明显抑制作用,且具有浓度效应;其化感效应超过体内POD、SOD和 CAT酶的调节能力,加深幼苗体内膜脂过氧化程度,对小白菜和萝卜种子的萌发与幼苗生长产生影响。

