N-乙酰半胱氨酸对TACE肝癌患者凝血酶原、胆红素和谷丙转氨酶的影响
李文华 刘晓红 朱国艳 戴成艳
肝癌因起病隐匿,早期缺乏明显临床症状,大部分患者就诊时已属中晚期,手术切除者仅占20%左右;而肝动脉化疗栓塞术(Transcatheter arterial embolization,TACE)虽是不宜手术切除患者的关键治疗方法,但对其肝功能会造成可逆性损伤[1]。有资料显示,肝癌患者TACE术前肝功能良好,术后亦存在肝功能损伤风险;而N-乙酰半胱氨酸(N-acetylcysteine,NAC)属L-半胱氨酸乙酰化物,可保护肝脏,在乙酰氨基酚所致急性肝功能衰竭治疗中能获取较为满意的临床效果,但关于其治疗TACE肝癌患者的报道较少[2]。基于此,本文主要深入研究N-乙酰半胱氨酸对TACE肝癌患者脱γ-羧基凝血酶原(Des-γ-carboxy prothrombin,DCP)、总胆红素(Total bilirubin,TBil)、谷丙转氨酶(Glutamic-pyruvic transaminase,ALT)的影响,现报道如下。
资料和方法
一、 一般资料
纳入2016年1月至2018年1月于我院收治的60例TACE肝癌患者为对象。纳入标准:(1)与《原发性肝癌诊疗规范(2011年版)》[3]中原发性肝癌诊断标准相符,均接受TACE术;(2)肝功能Child-Pugh分级为A~B级,肿瘤直径≤10 cm;(3)年龄≥18岁,初次诊断、首次治疗者;(4)获患者知情同意。排除标准:(1)伴心、肺、肾等重要器官疾病;(2)伴门静脉或肝静脉主要分支癌栓形成,或存在远处转移;(3)入组前3个月行外科手术切除治疗或联合经皮无水酒精注射、肝动脉介入化疗等治疗;(4)肝功能Child-Pugh分级为C级;(5)伴重度肝硬化所致肝功能严重异常,或有明显腹水、黄疸者;(6)伴其他部位恶性肿瘤者。采用抽签随机方法将其分为两组,各30例,其中对照组予以常规护肝治疗,观察组在此前提下行NAC治疗。本研究获我院医学伦理委员会批准,两组一般资料比较差异无统计学意义(P>0.05),见表1。
二、方法
(一)手术方法 所有患者均行TACE术。术前完善血常规、肾功能、心电图等相关检查,术前6 h禁水、禁食,建立静脉通道。术前,排空患者膀胱,取平卧位,利用改良Seldinger's穿刺技术,在局麻下经皮股动脉穿刺插管,动脉导管置入后并将其送至肝总动脉,予以诊断性造影。肿瘤供血动脉位置明确后,经导管超选择插入肝动脉内行灌注化疗,待灌注氟尿嘧啶(天津金耀药业,国药准字H12020959)750 mg+奥沙利铂(深圳海王药业,国药准字H20031048)150 mg+多柔比星(常州金远药业,国药准字H20123273)30 mg后,均匀混合奥沙利铂50 mg+多柔比星10 mg+碘海醇(湖南金健药业,国药准字H20084190)3 mL+碘化油(法国加柏公司,注册证号H20050307)5 mL,行栓塞处理。需要注意的是,需按患者体重行剂量调整,部分患者可利用明胶海绵颗粒栓塞剂行栓塞封闭。

表1 两组患者一般资料比较[(±s),n(%)]
(二)治疗方法 对照组予以常规治疗(如维生素C、门冬氨酸钾镁等)。在此前提下,观察组予以NAC治疗,于TACE术前3 d至术后7 d,静滴NAC(Zambon Italia S.R.L,批准文号H20070264)8 g+5%葡萄糖250 mL,1次/d;之后,暂停NAC治疗,若肝功能未恢复至正常状况,酌情予以维持治疗。两组均持续治疗3周。
三、观察指标
(一)凝血酶原及氧化应激指标 于TACE术前1 d及术后第7 d,采用一次性真空采血管,采集晨肘静脉血3 mL,以3 000 r/min速度离心10 min,收集上层血清,送至第三方检验中心(迪安诊断)行DCP、丙二醛(Malonic dialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)水平检测。
(二)肝功能指标 运用罗氏Cobas 8000全自动生化分析仪及相配套试剂,行TBil、ALT、谷草转氨酶(Aspartate aminotransferase,AST)、清蛋白(Albumin,ALB)检测。
四、统计学方法

结 果
一、 两组治疗前后DCP及氧化应激反应因子指标比较
观察组治疗后DCP、MDA显著低于治疗前及对照组治疗后(P<0.05),SOD显著高于治疗前及对照组治疗后(P<0.05),见表2。
二、 两组治疗前后肝功能指标比较
观察组治疗后TBil、ALT、AST水平较术前均无统计学意义(P>0.05),但均显著低于对照组治疗后(P<0.05);观察组治疗后ALB较治疗前及对照组治疗后均无统计学意义(P>0.05),见表3。
讨 论
既往文献显示,中晚期肝癌患者伴有不同程度的肝功能不全,而TACE术会导致肝功能恶化风险增加,其中大约70%的患者存在肝硬化[4]。究其根源,多因TACE属创伤性手术,对肝脏主血管予以栓塞,虽可阻断肿瘤主要供血,断绝肝脏肿瘤营养,使肿瘤缩小、坏死,但会断绝肝脏自身营养供给,影响肝脏血液循环,引起肝功能异常;而基于医师操作经验和肿瘤血管自身特点(如侧支循环较多、伴动静脉瘘等)影响,会导致术中靶动脉超选择不到位、顺流性或反流性误栓、过度栓塞等情况的发生,引起局部组织缺血、缺氧损伤,再加上化疗药物的影响,故肝组织会出现不同程度的损害。但TACE术后肝功能损伤具有可逆性,有资料显示,TACE术后实施常规保肝治疗(如维生素C、门冬氨酸钾镁等),对患者肝功能的恢复具有重要作用,但效果并不显著[5]。
本研究结果显示,观察组治疗后DCP、MDA较对照组低,SOD较对照组高,提示NAC能减轻TACE肝癌患者脂质过氧化反应。DCP为原发性肝细胞肝癌标志物,由肝脏合成凝血酶原过程中前体羧化不完全引起。有资料显示,原发性肝细胞肝癌患者血清中DCP水平显著升高,于甲胎蛋白阴性患者中DCP仍有可能上升,与肿瘤血管侵袭、肝内转移等因素有关[6]。

表2 两组治疗前后DCP及氧化应激反应因子指标比较(±s)
注:与同组治疗前比较,#P<0.05
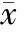
表3 两组治疗前后肝功能指标比较(±s)
注:与同组治疗前比较,#P<0.05
而NAC为琉醇化合物,亦为细胞内还原性谷胱甘肽前体,于肝脏细胞中通过代谢结合蛋白质肽链,形成多种代谢产物,联合常规护肝治疗(维生素C、门冬氨酸钾镁等),可抑制肝癌细胞DCP产生,降低血液中DCP含量,下调HIF-1α合成,诱导肝癌HepG2细胞survivin、VEGF表达受抑,并抑制肝细胞癌生长。正常情况下,大多数体内产生自由基由还原性谷胱甘肽消耗,一旦还原性谷胱甘肽产生不足或消耗过多,会引起肝细胞过氧化损伤。动物实验发现,NAC应用后,于肝门静脉血浆中可见分解及氧化的NAC,形成无机亚硫酸盐、半胧氨酸等代谢产物,保护肝脏[7]。笔者认为,NAC毒性小,可增加机体内还原性谷胱甘肽合成酶含量及细胞内还原性谷胱甘肽含量与活性,快速穿过细胞膜,于细胞内去乙酰化后转变为半胱氨酸,而后者属于体内还原性谷胱甘肽生物合成所必需氨基酸,可诱导肝细胞内还原性谷胱甘肽合成,缓解细胞脂质过氧化程度,诱导SOD活性增强,降低MDA,促使机体清除自由基能力增强;并且,NAC结合氧自由基,产生非酶促反应,抗炎作用显著,可使炎性细胞因子释放受抑,缓解机体炎性损伤,进而发挥保护肝细胞目的。
本研究发现,观察组治疗后TBil、ALT、AST水平较对照组低,提示NAC能有效改善TACE肝癌患者肝功能。有资料显示,NAC可纠正库普弗细胞氧化还原失衡,干扰NF-κB p65活化(核易位),诱导炎性因子(如TNF-α等)基因表达受抑,从而缓解肝损伤[8]。动物实验发现NAC预处理能保护细菌脂多糖与D-氨基半乳糖所致小鼠急性肝损伤,可能与其抗氧化和抗凋亡作用有关[9]。NAC于机体内结合NO,生成亚硝酸基硫醇,诱导收缩微循环血管扩张,调节血液对组织氧输送及释放,改善缺氧,预防肝细胞坏死。本研究认为,NAC通过促进NO与肝脏还原型谷胱甘肽合成,改善TACE肝癌患者肝损伤;另外,NAC能调节淋巴细胞活性,促使T细胞凋亡受抑,逆转T细胞IL-2及IL-2 mRNA活性介导机体免疫应答,改善患者肝细胞功能,预防肝损伤。
综上,NAC对TACE肝癌患者DCP、TBil、ALT均存在重要影响,值得临床积极推广,但因本文样本量偏少,观察时间较短,未涉及NAC对TACE肝癌患者TNF-α等炎症指标的影响及安全性观察,故今后仍需深入调查研究。

