miR-509-3p及XIAP表达与肝癌细胞增殖侵袭能力影响
欧阳考滨 袁霞 何樱
2013年我国肝癌死亡例数达35.81万,占全世界因肝癌死亡人数的43.9%[1]。微小RNA(miRNA)是一类小型内源性非编码RNA调控因子,长度为18~25个核苷酸,目前在人类基因组中发现超过1500个miRNA,其在细胞分化、细胞周期和凋亡的调控过程中发挥重要作用。miRNA的异常表达可以调节数十至数百个靶基因以协调细胞信号传导途径,影响下游靶基因表达,从而促进细胞增殖、侵袭和迁移等生物学过程,参与多种肿瘤的发生发展[2,3]。miR-509-3p作为肿瘤抑制因子,在胶质瘤、卵巢癌、乳腺癌、急性淋巴细胞白血病、肺癌的发展中发挥重要作用[4,5]。尽管已有较多关于肝细胞癌发生发展的分子机制研究,但miR-509-3p及其靶基因在调节肝细胞癌增殖和侵袭中的作用机制还需要进一步探讨。肿瘤细胞凋亡抵抗的机制之一是其高表达凋亡抑制蛋白,该家族包括XIAP、Survivn、Livin等成员,可以通过多种机制发挥抑制凋亡的作用[6]。XIAP为X连锁凋亡抑制蛋白,在胶质瘤研究中发现miR-509-3p具有负性调节XIAP表达的作用[4],而在肝细胞癌中的报道较少。本研究通过观察肝细胞癌中miR-509-3p和XIAP异常表达对肝癌细胞增殖与侵袭能力的影响,初步探索其作用机制。
材料与方法
一、一般资料
选取2013年4月至2015年4月于惠州市中心医院经病理确诊的肝细胞癌患者107例,男71例,女36例,年龄34~67岁,平均(42.1±6.5)岁。所有患者均为初次诊治,手术之前未接受过化疗、放疗等,未合并其他恶性肿瘤。Ⅰ期21例、Ⅱ期32例、Ⅲ期38例、Ⅳ期16例。本研究经医院伦理委员会审核通过,患者及家属均知情同意并签署知情同意书。
二、细胞培养及细胞转染
于培养瓶或细胞培养皿中接种HepG2细胞,内含10%胎牛血清的DMEM培养基,置于37℃,体积分数为0.05的CO2培养箱中,当细胞密度达90%时,利用胰蛋白酶消化细胞并接种传代。转染前24 h,接种适当数量的细胞至6孔板中,使转染时的细胞密度达到70%~80%。将Lipo2000室温静置6 min,然后分别与配好的miR-509-3p类似物、miR-509-3p抑制物及XIAPsiRNA混匀,室温下静置20 min,将其加入接种的6孔板中,混和后置于培养箱,6 h后加新鲜培养基,48 h后收集细胞。每组实验至少重复3次。
三、RT-PCR检测组织及细胞中miR-509-3p及XIAP的表达
Trizol法提取患者癌组织、癌旁组织及细胞中总RNA。以5 μL总RNA为模板,用TaqMan MicroRNA反转录试剂盒进行反转录,总反应体系为15 μL(cDNA 2 μL,TaqDNA聚合酶2.5 μL,上下游引物0.5 μL,双蒸水10 μL),反应条件如下:95 ℃ 10 s,90 ℃ 5 s,60 ℃ 30 s,连续40个循环。用相对Ct值分析数据,目的基因miR-509-3p mRNA的表达相对于内参基因U6的比值为2-ΔΔCt,计算miR-509-3p的相对定量表达水平。miR-509-3p正向引物序列:5′-UGAUUGGUACGUCUGUGGGUAGTT-3′,反向引物序列:5′-CUACCCACAGACGUACCAAUCATT-3′;miR-509-3p类似物正向引物序列:5′-UGAUUGGUACGUCUGUGGGUAGTT-3′,反向引物序列:5′-CUACCCACAGACGUACCAAUCATT-3′;XIAP正向序列5′-GACAGTATGCAAGATGA-GTCAAGTCA-3′,反向序列5′-GCAAAGCTTCT-CCTCTTGCAG-3′;XIAPsiRNA特异性正义链:5′-GUGCUGGACUCUACUACACUU-3′,反义链:5′-GUGUAGUAGAGUCCAGCACUU-3′;XIAPsiRNA非特异性正义链:5′-CUUGUAUGGGCAGAUUGC-CUU-3′,非特异性反义链:5′-GGCAAUCUGCCCA-UACAAGUU-3′;内参基因U6上游序列:5′-GCTT-CGGCAGCACATATACTAAAAT-3′,下游序列:3′-CGCTTCACGAATTTGCGTGTCAT-5′。miR-509-3p及XIAP反转录引物、PCR引物和探针分别来自ABI生物公司。所有反应均在ABI实时定量PCR仪上完成,每个样本重复3次。
四、细胞增殖及细胞侵袭力检测
1.细胞增殖实验:实验过程按试剂盒说明书进行,将细胞以每孔100 μL培养基中含3000个细胞的密度接种到96孔板中,接种24、48、72、96及120 h后,每孔加入10 μL CCK-8试剂后1 h评估450 nm处的吸光度,以确定细胞的增殖能力。细胞增殖能力以活细胞相对于媒介物处理细胞的百分比表示,实验至少重复3次。
2.细胞侵袭能力检测(Transwell小室实验):将转染miR-509-3p类似物的HepG2细胞及无任何处理的HepG2细胞接种到Transwell小室上室,上室每孔接种200 μL不含血清细胞悬液(2×104个),下室加入500 μL含10%胎牛血清的DMEM培养基作为化学诱导剂。于培养箱中培养24 h后结晶紫染色,200倍光学显微镜下随机选取10个视野,观察穿透过滤器的被染色细胞数目,以评估细胞的侵袭和迁移能力,结果取均值,实验至少重复3次。
五、统计学方法
结 果
一、癌组织与癌旁组织miR-509-3p与XIAP mRNA表达及癌组织中二者相关性分析
肝癌组织miR-509-3p与XIAP的相对表达量分别为0.415±0.098、1.657±0.147,癌旁组织miR-509-3p与XIAP的相对表达量分别为1.127±0.126、0.425±0.113,癌组织中miR-509-3p相对表达量较癌旁组织显著较低(t=3.257,P=0.002),而XIAP的相对表达量显著较高(t=4.201,P=0.000)。肝癌组织miR-509-3p与XIAP mRNA表达水平呈负相关(r=0.218,P=0.046),见图1、2。
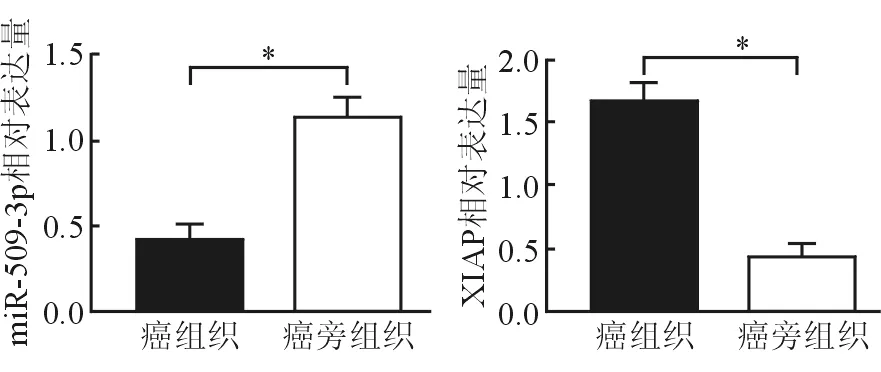
图1 肝癌组织与癌旁组织miR-509-3p、XIAP表达比较

图2 肝癌组织miR-509-3p与XIAP表达相关性分析
二、miR-509-3p表达对HepG2细胞增殖和侵袭能力的影响
与对照组相比,转染miR-509-3p类似物48、72、96及120 h时,HepG2细胞增殖率明显降低(均P<0.05);与对照组相比,转染miR-509-3p抑制剂48 h后HepG2细胞增殖明显增高(均P<0.05),见图3。与对照组相比,转染miR-509-3p类似物后24 h HepG2细胞侵袭数目明显较低(分别为96.32±0.52,51.47±0.45,t=2.263,P=0.021);与对照组相比,转染miR-509-3p抑制剂后24 h HepG2细胞侵袭数目明显较高(分别为94.65±0.42,120.14±0.45,t=2.463,P=0.013)。
三、siRNA沉默XIAP表达对HepG2细胞增殖和侵袭能力的影响
与阴性对照组和空白对照组相比,siRNA沉默XIAP基因表达后48、72、96和120 h,HepG2细胞增殖和侵袭能力均显著较低(P均<0.05)。见表1。
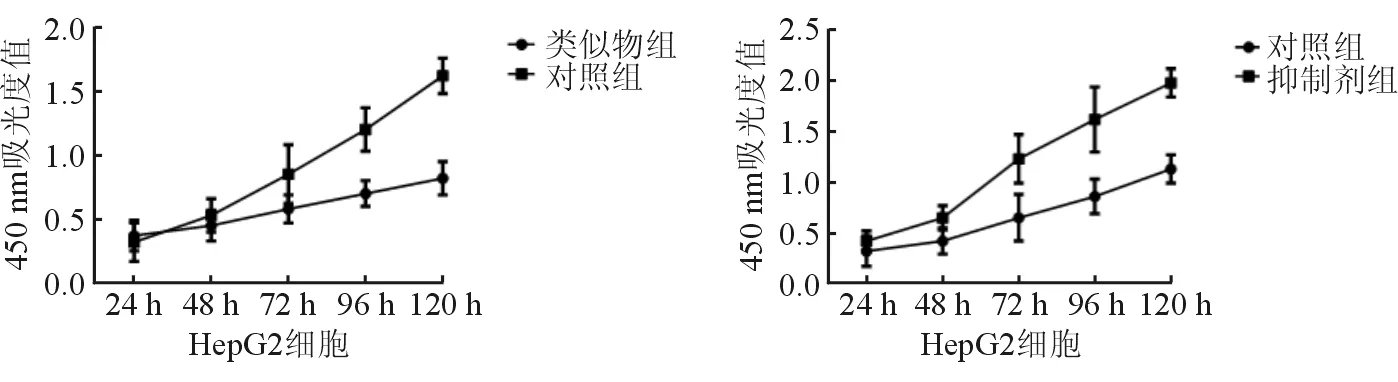
图3 转染miR-509-3p类似物和抑制剂后各时间点HepG2细胞增殖率

表1 siRNA沉默XIAP表达对HepG2细胞增殖和侵袭能力影响
讨 论
miRNA是近年来肿瘤研究的热点,其可通过结合目标基因mRNA的3′非翻译区,诱导mRNA降解或抑制mRNA翻译发挥作用,影响细胞分化、增殖、侵袭和凋亡等过程[7,8]。多种miRNA的异常表达(上调或下调)与肝细胞癌的发生发展相关,miRNA参与多条细胞信号转导通路的调节,如TGF-β通路、JAK/STAT信号通路传导通路等,参与肝癌细胞增殖、凋亡、转移等生物学过程[9-11]。有研究表明,在恶性胶质瘤、卵巢癌、胃癌等组织中均存在miR-509-3p显著下调的现象,并且下调程度可能影响患者长期总体生存率,体外实验中通过上调miR-509-3p的表达后,肿瘤细胞的增殖和迁移能力受到抑制,而敲除或下调miR-509-3p表达后,肿瘤细胞的增殖和迁移能力增强[12]。本研究发现,肝癌组织中miR-509-3p表达量显著低于癌旁组织,表明肝细胞癌的发生可能与miR-509-3p的表达水平降低有关。进一步在体外细胞实验中证实,通过转染miR-509-3p类似物上调miR-509-3p表达后,HepG2细胞增殖和侵袭能力明显降低,而转染miR-509-3p抑制物下调miR-509-3p表达后,HepG2细胞增殖和侵袭能力明显升高。本研究与Yoon等[13]报道的体外实验的数据一致,其机制可能是miR-509-3p的过表达诱导G1细胞周期阻滞,并通过下调CDK2、Rac1及磷脂酰肌醇-4-磷酸3-激酶催化亚基2α的表达,抑制肿瘤细胞的增殖和迁移。有学者在舌鳞癌的研究中发现,miR-509可调节表皮生长因子受体(EGFR)基因的表达,进而影响EGFR信号转导通路中下游基因如p-Akt的表达发挥肿瘤抑制因子的作用[14]。
XIAP是细胞凋亡抑制因子家族中的重要成员,该家族包括XIAP、NAIP、survivin及c-IAP1等成员,由三个BIR结构域和一个环指结构域构成,它能够通过将caspase-3和caspase-7结合到其XIAP BIR2结构域抑制caspase-3和caspase-7活性,并通过将caspase-9结合到其BIR3结构域来抑制caspase-9[15]。XIAP在乳腺癌、非小细胞型肺癌、卵巢癌等许多类型的癌症中表达升高[16-18]。本研究中肝癌组织XIAP表达量与癌旁组织相比显著较高。进一步通过RNA干扰的方法沉默XIAP表达,结果表明siRNA沉默XIAP基因表达后HepG2细胞增殖和侵袭能力均显著降低。其机制可能是肝癌组织中XIAP表达增高,灭活caspase-3、7、9等关键半胱氨酸蛋白酶,细胞抗凋亡能力增强。XIAP还含有一个环指结构,具有泛素连接酶(E3)的活性,XIAP的E3连接酶可通过对c-Jun / AP-1的反式激活作用,上调细胞周期蛋白D1转录,进而影响细胞凋亡、增殖和迁移等信号级联反应,而当下调XIAP表达时,细胞周期蛋白D1表达降低,细胞增殖减弱[19,20]。此外,XIAP通过调节CDK4/CDK6/CyclinD1复合物的表达,进而促进肝癌细胞的增殖,在用embelin(XIAP特异性抑制剂)对肝癌细胞处理后,肿瘤细胞增殖明显受到抑制[21,22]。
miRNA通过结合靶基因的3'-UTR起作用,本研究初步探讨肝癌组织中miR-509-3p表达与癌组织中的XIAP表达的相关性,结果表明miR-509-3P表达与XIAP表达呈负相关,其机制可能与miR-509-3P负性调节靶基因XIAP的表达有关[4],与国内学者报道结果一致[23]。有研究通过荧光素酶报告实验表明XIAPmRNA存在miR-509-3P结合位点,转染miR-509-3P 类型物后肿瘤细胞XIAP蛋白表达明显降低,进一步激活凋亡信号转导等通路,细胞凋亡增多[24]。
综上所述,与癌旁组织相比,miR-509-3p在肝癌组织样本中表达下调,并且miR-509-3p的低表达水平可能增加肝癌细胞的增殖和侵袭能力。miR-509-3p作为一种肿瘤抑制因子,可能通过在肝癌细胞中靶向XIAP来抑制细胞增殖和侵袭,其具体作用机制有待深入研究。

