工厂化和网箱养殖大黄鱼幼鱼消化道微生物群结构与功能分析
■姜 燕 徐永江柳学周* 郑炜强 陈 佳 史 宝王 滨
(1.农业农村部海洋渔业可持续发展重点实验室青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室中国水产科学研究院黄海水产研究所,山东青岛 266071;2.大黄鱼育种国家重点实验室宁德市富发水产有限公司,福建宁德 352103)
大黄鱼(Larimichthys crocea)为我国传统经济鱼类,也是我国主要的海水经济鱼种之一,其养殖业主要集中于我国浙江、福建等地。据统计,2017年大黄鱼苗种产量为391 472万尾,其养殖的年产量高达177 640吨,稳居海水养殖鱼类榜首[1],并被列为我国八大优势出口养殖水产品之一。并且,与2016年相比,其产量明显提高11.35%。伴随养殖规模的不断扩大,养殖过程中的各种问题也逐渐显现,最终导致鱼体处于不完全健康状态,表现出对细菌性、寄生虫性及病毒性等疾病病原的抵抗力逐渐下降[2-5]。
为解决上述问题,大黄鱼产业正在从养殖设施、优质苗种生产、配合饲料使用、病害防控等方面推动养殖模式的转型升级。而关于病害的预防与治疗方面的研究也在不断的开展与深入,其中包括各种有效药物的研发、疫苗的研制及消化道微生物群调控的研究等[6-10]。消化道微生物群调控是近几年提出的热点课题,主要是通过微生物间的相互作用来实现,在生物、环保的基础上有效提高鱼体对环境变化的适应能力。
围绕消化道微生物群开展生物调控,首先要清楚消化道微生物的结构特征,同时还要掌握鱼体消化道微生物群与其生存环境中菌群的相互关系。本研究针对工厂化和网箱养殖大黄鱼幼鱼消化道菌群的组成与分布信息开展研究,明确消化道中的优势物种,为大黄鱼幼鱼内源性益生菌的筛选奠定理论基础。并且,查明大黄鱼幼鱼消化道菌群与环境菌群的相关性,为消化道菌群结构的调控途径提供理论参考。同时,借助于16S rDNA高通量测序方法对大黄鱼幼鱼消化道微生物群基因参与的主要功能进行分析,为大黄鱼幼鱼消化道功能菌群的筛选提供基础数据。
1 材料与方法
1.1 实验用鱼来源
实验所用大黄鱼幼鱼由福建省富发水产有限公司提供,实验中室内工厂化和海上网箱养殖的所有大黄鱼苗种均来自于同一批受精卵孵化的健康幼鱼。其中,工厂化养殖幼鱼体重(0.36±0.133)g,体长(3.66±0.394)cm,养殖密度为1.7万尾/m3;海上网箱养殖幼鱼体重(0.54±0.055)g,体长(4.32±0.22)cm,养殖密度为750尾/m3。
1.2 样品采集与处理
大黄鱼幼鱼样本:随机挑选一个工厂化养殖池和一个海上网箱分别作为两个处理组,对每一个处理组的幼鱼进行取样,每组随机采集20尾。将挑选的幼鱼在灭菌海水中暂养20 min,连续进行3次,之后采用MS-222(Fluka,USA)进行麻醉处理,麻醉后立即进行解剖。解剖过程:75%酒精擦拭体表后采用消毒的解剖工具解剖取其完整消化道,去除内容物,之后用预冷的灭菌生理盐水冲洗并分装,于液氮中保存。整个解剖过程在无菌环境下进行。室内工厂化养殖大黄鱼幼鱼消化道样本采用I0YG表示,I0YG1、I0YG2、I0YG3表示三个平行样本;海上网箱养殖大黄鱼幼鱼消化道样本采用C0YG表示,同样,C0YG1、C0YG2、C0YG3表示三个平行样本。
养殖用水样本:对工厂化养殖幼鱼进行进水口水样的采集,共采集3次,每次3 L水;网箱养殖幼鱼则对网箱中的水进行水样采集,同样采集3次,每次3 L水。水样在现场经0.22 μm孔径滤膜过滤后,保留滤膜至液氮中备用。其中,工厂化养殖用水样本采用IYW表示,IYW1、IYW2、IYW3代表三个平行样本;同样,CYW1、CYW2、CYW3代表的是海上网箱的水样本。
饵料样本:不同模式养殖幼鱼处于同一生长阶段,因此投喂的配合饲料完全相同。准确称取0.1 g配合饲料三份,分装于无菌离心管中,液氮保存备用。采用s0YF代表饵料样本,s0YF1、s0YF2、s0YF3则代表的是三个平行样本。
1.3 微生物总DNA的提取与高通量测序
将液氮中保存的幼鱼消化道样本从液氮中取出,冰上自然解冻,每个处理组随机选取三个样本作为平行组,严格按照QIAamp DNA mini kit(QIAGEN,Ger⁃many)试剂盒说明书进行操作,提取消化道微生物总DNA。将收集的各水样滤膜无菌粉碎后采用OME⁃GA Soil DNA kit(Omega Bio-Tek,USA)进行细菌总DNA的提取。将每个饵料样本按照QIAamp DNA mini kit(QIAGEN,Germany)的说明提取细菌总DNA。之后,采用PCR技术扩增16S rDNAV3-V4高变区序列,扩增基因的正向引物338F:5'-ACTCCTAC⁃GGGAGGCAGCA-3',反向引物806R:5'-GGACTACH⁃VGGGTWTCTAAT-3'。扩增的序列经琼脂糖凝胶电泳检测合格后交由商业测序公司通过Illumina MiSeq PE300平台进行高通量测序。
1.4 数据处理与分析
测序所得的下机数据,采用Trimmomatic(v 0.35)[11]剪切、Flash(v 1.2.11)[12]拼接、Uchime(v 4.2)[13]去嵌合体等一系列处理得到有效序列(effective reads)。然后,采用Vsearch(v 2.4.2)[14]对所有样品的全部有效序列进行归类操作,默认以97%的一致性(Identity)将序列聚类成为一个OTU(Operational Taxonomic Units),并选取OTU的代表性序列。用RDP Classifer(v 2.2)[15]与Silva数据库(v 123)对OTUs代表序列进行物种注释。将测序所得有效tags数目最小值作为标准对其余样本的有效tags进行均一化处理,Alpha和Beta多样性均基于均一化后的数据进行解析。采用tax4fun(0.3.1)对微生物群基因参与的KEGG通路进行比对分析。
采取单因素方差分析(ANOVA)方法进行差异性分析,显著性水平为P<0.05。采用Kruskal Wallis检验对不同养殖模式幼鱼消化道微生物群差异物种进行分析。所有数值均采用“平均值±标准误”(Means±S.D.)表示。
2 结果
所有样本经高通量测序及对测序结果数据的一系列处理后共获得511 291条有效序列和2 230个有效OTU。其中,对所有样本有效tags进行均一化处理的标准为27 487条。
2.1 α-多样性
所有样品的物种数目如图1所示,室内工厂化养殖大黄鱼幼鱼消化道菌群的物种数目平均值为356,低于网箱养殖幼鱼的467.7,但差异不显著(P>0.05)。饵料中的微生物物种数目显著高于工厂化养殖幼鱼消化道微生物物种数目(P<0.05)。两种模式下的幼鱼消化道微生物的物种数目分别与水环境微生物的物种数目差异不显著(P>0.05)。
工厂化和网箱养殖大黄鱼消化道微生物群的香浓指数分别为6.69和6.67,与饵料微生物群之间的差异不显著(P>0.05),但均显著高于两种水环境的(P<0.05)(见图1)。

图1 不同养殖模式下大黄鱼幼鱼消化道及环境微生物群α-多样性(n=3)
2.2 大黄鱼消化道微生物群结构特征
图2显示的是每一个样本相对丰度排列前十的菌群。由图2可以看出,在门水平,两种环境下大黄鱼幼鱼消化道微生物组成比较相似,主要由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)组成,其丰度之和为83.43%~92.84%。

图2 不同养殖模式下大黄鱼幼鱼消化道优势菌门
在属水平,每一个消化道样本中相对丰度高于1%的微生物物种如图3所示。从图3中可以看出,每一个样本中丰度高于1%的菌属的丰度和均低于60%,且物种数目为11或12,相对比较稳定。工厂化和网箱养殖大黄鱼消化道优势菌属主要包括乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、醋菌属(Acetobacte)、芽孢杆菌属(Bacillus)等19个物种。但是,网箱养殖中,发光杆菌属(Photobacterium)和弧菌属(Vibrio)在其中一个消化道样本中丰度高达33.36%、9.16%,与其余两个样本的差异比较明显。
以平行样本共有菌属为基础,工厂化养殖大黄鱼幼鱼消化道菌属水平的物种数目为84,网箱养殖大黄鱼幼鱼消化道中则为95个(图4)。其中,网箱养殖大黄鱼幼鱼消化道特有菌属远高于工厂化养殖的,而两种模式下大黄鱼幼鱼消化道共有的菌属为59个。并且,19个相对丰度高于1%的菌属中,除Flavisolibacter外,其余菌属均为共有均属。因此,将发光杆菌属、乳杆菌属、弧菌属、魏斯氏菌属等18个菌属视为两种养殖模式下大黄鱼幼鱼消化道的共有优势菌群。
图5显示了两种环境条件下大黄鱼幼鱼消化道中丰度差异显著的菌属。其中,网箱养殖幼鱼消化道Flavitalea、海单胞菌属(Marinomonas)、Roseovarius和假单胞菌属(Pseudomonas)等的丰度显著低于工厂化养殖的(P<0.05),而气单胞菌属(Aeromonas)、Esche⁃richia_Shigella、根瘤菌属(Rhizobium)、Psychrilyo⁃bacter和黄单胞菌属(Xanthomonas)的丰度显著高于工厂化养殖的(P<0.05)。

图3 不同养殖模式下大黄鱼幼鱼消化道优势菌属
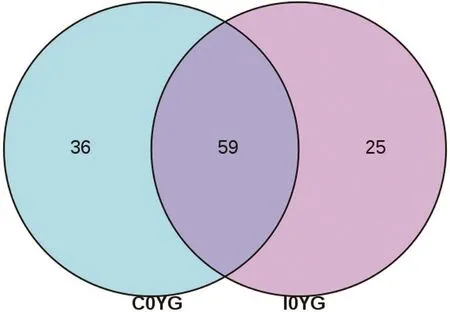
图4 不同养殖模式下大黄鱼幼鱼消化道微生物群韦恩图
2.3 消化道微生物群与环境菌群的相关性
以每个样本三个平行共有菌属为基础,对工厂化养殖大黄鱼幼鱼消化道菌群与环境菌群相关性进行分析。消化道的微生物物种数目为84,与养殖用水共有物种42个,与饵料共有物种55个,三者共有物种34个,而消化道特有物种21个(见图6)。
同样以平行样本共有物种为基础,网箱养殖大黄鱼幼鱼消化道微生物物种数目为95,与水共有物种仅20个,而与饵料共有物种却高达65个,并且三者共有物种仅17个(图7)。

图5 两种养殖模式下大黄鱼幼鱼消化道差异显著菌属(P<0.05)

图6 工厂化养殖大黄鱼幼鱼消化道菌群、饵料菌群与环境菌群的韦恩图

图7 网箱养殖大黄鱼幼鱼消化道菌群、饵料菌群与环境菌群的韦恩图
在大黄鱼幼鱼消化道微生物群与环境菌群的主成分分析中可以看出,主成分1(PC1)贡献率84%,主成分2(PC2)的贡献率为9.6%(图8)。相对于网箱养殖大黄鱼消化道样本,工厂化养殖的消化道样本比较聚集,说明消化道微生物群结构较为稳定。同时,相对与水样本而言,消化道样本与饵料样本相距较近,说明饵料中的微生物群组成与消化道的较为相似。
2.4 大黄鱼消化道微生物群功能分析
基于各样本的KEGG比对,共获得299个功能途径,对基因丰度排列前十五的进行分析,可以看出两种模式下大黄鱼幼鱼消化道微生物群功能在第一层级主要由环境信息处理、遗传信息处理、新陈代谢和细胞过程四大类组成(图9)。其中,三级水平下,参与环境信息加工的转运蛋白功能的基因数目最多,ABC转运蛋白的次之。另外,参与肽酶、氨基酸相关酶功能的基因数目也相对较高,为35~56万个。在这些优势的代谢通路中,网箱养殖大黄鱼消化道微生物群基因丰度明显低于工厂化养殖的,但差异均不显著(P>0.05)。
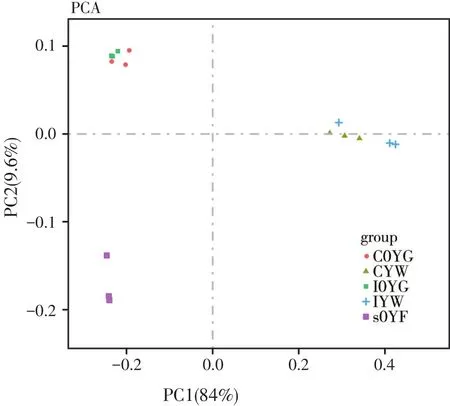
图8 大黄鱼幼鱼消化道菌群与环境菌群PCA分析

图9 大黄鱼幼鱼消化道菌群功能注释
针对第一层级通路中的新陈代谢通路进行对比分析,在第二层级水平,大黄鱼消化道微生物群参与的功能按照基因丰度由高到低的顺序主要包括碳水化合物代谢、氨基酸代谢、能量代谢、辅酶因子和维生素代谢、核苷酸代谢、脂类代谢、异生物质生物降解与代谢、多糖生物合成与代谢、酶家族等(见图10)。在所有的新陈代谢通路中,网箱养殖大黄鱼消化道微生物群基因丰度同样低于工厂化养殖的,差异不显著(P>0.05)。

图10 大黄鱼幼鱼消化道菌群新陈代谢功能的分类注释
3 讨论
3.1 大黄鱼幼鱼消化道微生物群结构特征及其与环境微生物的相关性
本研究中,属水平下,所有消化道样本的优势物种的丰度和比较相近,且均低于60%,反映出物种组成的均一性比较高。同时,网箱养殖大黄鱼幼鱼消化道菌群的物种数目及香浓指数均高于工厂化养殖模式的,说明网箱养殖大黄鱼消化道微生物群的多样性比较高,但差异不明显。在两种养殖模式下,大黄鱼幼鱼消化道微生物群在门和属水平的主要组成基本相似,并且工厂化养殖大黄鱼消化道微生物结构相对稳固。在物种共有性分析时,发现本研究中18个丰度高于1%的菌属为两种模式养殖大黄鱼消化道的共有优势物种,说明这些菌群可能始终存在于大黄鱼消化道中,受环境和自身因素的影响,其丰度会出现一定的变化,导致其中一些菌属(气单胞菌属、假单胞菌属等)的丰度产生显著性差异,但其丰度并不是很高。李存玉等[16]在对工厂化和池塘养殖牙鲆肠道菌群结构对比分析中,同样发现,工厂化养殖的牙鲆肠道微生物多样性比较低;并且,两种模式下养殖牙鲆肠道优势物种组成在门和属水平上基本相似,只是物种丰度存在一定的差异。关于仿刺参肠道菌群结构对比分析中,有研究指出,池塘养殖和海上吊笼养殖的肠道菌群的结构存在较大差异[17]。这可能与养殖动物的种类、摄食习性等有关[18]。
通过PCR与克隆技术相结合,王程程等[19]对同一养殖海区的1龄大黄鱼进行研究,发现拟杆菌属为其肠道内的最优势菌属。而本实验中,在工厂化和网箱两种模式下大黄鱼幼鱼消化道中,拟杆菌属虽为优势物种,但是丰度并不是最高的。这可能与生存环境、营养水平、鱼体自身的生理阶段及研究方法有关[9,18,20-24]。
水产养殖中,水和饵料是外源性物质的良好载体,包括益生菌和病原菌在内的微生物均可借助于这两种介质进入养殖动物体内形成相应的效应[25-28]。本实验中,分别对两种环境因素与消化道菌群的相关性进行了分析。两种模式养殖大黄鱼消化道与饵料共有菌属的数目明显高于水环境的;并且,与水环境相比,大黄鱼消化道菌群的组成与分布与饵料的更为相似,揭示了对两种模式养殖大黄鱼幼鱼而言,饵料中微生物群对消化道菌群的影响较为明显。同时,大黄鱼消化道也有自己的特有物种,推测其可能与亲本、授精过程或者微生物间的相互作用有关。相关报道指出,大菱鲆、牙鲆苗种繁育阶段,与水中微生物相比,饵料微生物与仔稚幼鱼肠道菌群的结构更相关[29-30]。但是,Bakke等[7]在对鳕鱼幼鱼消化道菌群的研究中发现,与饵料相比,消化道菌群结构与水中的微生物组成比较相似,这可能与研究的方法、鱼的种类及生存环境有关。
3.2 大黄鱼幼鱼消化道微生物群功能
消化道微生物群是一个复杂的群体,通过相互间的各种作用使整个群体处于动态的平衡状态,有效预防外源菌群的定植[31]。因此,针对消化道菌群调控方面的研究逐步开展内源性菌群的挖掘与深入研究。从而,粪菌移植、“菌群-肠-行为轴”等成为医学界研究的焦点[32-35]。Shabat等[36]通过研究证实反刍动物能量的吸收依赖于消化道特异的微生物组。还有报道指出,消化道微生物组能够在机体能量获取与消耗方面协同宿主更好的适应高海拔的生活环境[37]。本研究中,两种模式养殖大黄鱼幼鱼消化道主要菌群结构基本相似,仅有少数丰度较低的菌属存在一定差异。因此,消化道微生物群的主要功能也基本相似,在新陈代谢中,参与碳水化合物代谢、氨基酸代谢等功能占据主要优势地位。另外,参与能量代谢、辅酶因子和维生素代谢、脂类代谢等的微生物基因丰度也比较高。说明消化道微生物群在满足自身生长发育需要的同时,对宿主营养代谢也发挥着重要的作用。两种模式养殖大黄鱼幼鱼来源于同一批受精卵孵化的仔鱼,并且取样过程完全随机,投喂的饵料也相同,最终体重存在一定差距,这可能与养殖密度差距悬殊相关。在工厂化养殖模式下,幼鱼的养殖密度为网箱养殖的22.7倍,相比较而言对幼鱼的各种生长机制形成一定的胁迫。为了弥补养殖密度对鱼体自身的生长机制的不足,消化道菌群通过对结构的细微调整来形成一种对鱼体生长代谢的补偿作用,最终表现为参与主要代谢通路及新陈代谢各通路的消化道微生物群基因的丰度均高于网箱养殖幼鱼的。
4 结论
工厂化和网箱养殖大黄鱼幼鱼消化道微生物群优势物种组成基本相似,其中,假单胞菌属、气单胞菌属和Escherichia_Shigella在两种养殖模式幼鱼消化道中的丰度差异显著(P<0.05)。并且,幼鱼消化道菌群与饵料中的相关性比较大。两种模式养殖幼鱼消化道菌群基因参与的主要功能相近,但是工厂化模式养殖幼鱼消化道菌群参与这些主要功能的基因丰度高于网箱模式养殖幼鱼的,这可能是对幼鱼生长代谢在密度胁迫中的一种补偿作用。

