丁酸梭菌及其代谢产物对畜禽肠道健康影响的研究进展
■林华林 秦颖超 周加义 王修启
(华南农业大学动物科学学院广东省动物营养调控重点实验室国家生猪种业工程技术研究中心,广东广州 510642)
近几十年来,为了降低集约化养殖模式下畜禽疾病的发生率,提高生产性能,抗生素被广泛应用于畜牧生产的各个环节。抗生素的大量使用虽在一定程度上抑制了有害菌的生长,增强了机体的免疫力,但由于监管难度大,不可避免造成了抗生素的滥用,增加了抗生素的残留以及超级细菌的产生和扩散机率[1],严重威胁着人类健康。鉴于此,世界卫生组织倡议慎用抗生素,1986年,瑞典便开始全面禁止在饲料中添加抗生素,近十五年,欧盟、韩国和美国也出台相关禁抗政策。2016年,农业部删除了附录1产品中的硫酸黏菌素预混剂,2018年在13号文——《兽用抗菌药使用减量化行动试点工作方案(2018~2021年)》中明确指出,药物饲料添加剂将在2020年全部退出。
我国微生态学奠基人魏曦先生曾预言:抗生素之后的时代将是微生态制剂时代[2]。微生态制剂作为一种抗生素代替物,具有更绿色、健康、安全的特点。微生态制剂类的药品、保健食品正逐渐涌入市场并形成产业[3]。丁酸梭菌作为微生态制剂类的饲料添加剂,可有效改善畜禽肠道健康,增强机体免疫,促进畜禽生长。因此,本文以丁酸梭菌及其代谢产物对肠道健康,包括对机体肠道屏障和免疫的影响及其可能的作用机制做一综述,以期为丁酸梭菌产品升级和开发更加高效的复合型微生态制剂提供思路。
1 丁酸梭菌代谢产物的营养功能
丁酸梭菌在肠道中通过发酵作用能产生多种物质,包括各种酶类、维生素、短链脂肪酸等,这些物质不仅可以补充机体的营养需要,而且能促进肠道对饲料中营养物质的消化、吸收和利用,提高畜禽的生长性能。王润之等[4]发现,日粮中添加丁酸梭菌可显著提高种番鸭蛋的受精率,且这种作用是通过丁酸梭菌在肠道内代谢产生的多种维生素和酶类等物质加强了种番鸭对钙、磷、锰、锌、铜和铁等矿物质的吸收以满足番鸭繁殖性能的需要实现的。
1.1 酶类
丁酸梭菌在肠道无氧环境中代谢,产生了蛋白酶、淀粉酶、脂肪酶、糖苷酶、纤维素酶等消化酶,与肠道中分泌的肠酶体系共同作用,把进入肠道的大分子碳水化合物、蛋白质和脂肪等酶解成单糖、短肽或氨基酸、甘油-脂或甘油等小分子物质,能被小肠直接吸收和利用,从而显著提高了饲料中的营养吸收效率。Takahashi等[5]研究证实,补充丁酸梭菌能显著提高仔猪和肉鸡的饲料转化率(Feed Conversion Rate,FCR)和平均日增重(Average Daily Gain,ADG)。Liao等[6]在肉鸡上的试验和李玉鹏等[7]在断奶仔猪上的试验与上述结果一致。此外,Nakajima等[8]发现,丁酸梭菌在大肠中产生的外切和内切果胶裂解酶以及果胶甲酯酶,能通过协同作用参与果胶等物质的消化,产生4,5-不饱和二半乳糖醛酸,然后在其它酶的作用下进一步被分解成一些短链脂肪酸[9],为肠道上皮细胞发育提供能量。
1.2 维生素
丁酸梭菌在肠道中能产生多种B族维生素(如核黄素、烟酸、吡哆醇、泛酸和叶酸等[10])和维生素E等[11]。维生素B以辅酶的形式参与体内碳水化合物、蛋白质和脂肪代谢,维持机体正常生理活动。其中核黄素和烟酸经磷酸化作用与蛋白质结合成的脱氢酶对于维持机体生物氧化和细胞呼吸至关重要;吡哆醇磷酸化后作为脱羧酶和转氨酶的辅酶参与氨基酸代谢;泛酸可与焦磷酸等生成辅酶A,参与三大营养物质的代谢和生物转化过程;而叶酸作为一碳单位的载体,主要参与嘌呤和嘧啶的合成。维生素E则有助于肠黏膜损伤的修复,促进伤口愈合。Cadir等[12]发现,给大鼠口服维生素E可降低缺氧造成的肠道形态学损伤。此外,提前用维生素E干预能够减轻电离辐射所致的肠道炎症,且这种作用与维生素E的抗氧化性有关[13]。
1.3 短链脂肪酸
丁酸梭菌在厌氧发酵过程中能产生大量的短链脂肪酸(Short-Chained Fatty Acid,SCFA),包括乙酸、丙酸、丁酸等,它们均能被结肠上皮细胞吸收利用[14],为细胞提供能量来源[15],其中有超过70%的能量来自丁酸的氧化。除此之外,丁酸梭菌也能为肠道中的其它益生菌,包括双歧杆菌和乳酸菌等的生长繁殖提供能量[16]。丁酸梭菌是最有效的丁酸生产者[17],且在所有的SCFA中,丁酸的代谢率最高。因此,丁酸梭菌的功效部分依赖于丁酸的作用。
1.3.1 丁酸的产生、吸收与利用(见图1)
丁酸梭菌主要利用肠道中的谷氨酰胺和葡萄糖等营养物质生成丁酰CoA,丁酰CoA则通过丙酮酸途径在磷酸转丁酰酶作用下生产丁酰磷酸盐,最后经丁酸激酶作用生成丁酸。此外,丁酰CoA还可在乙酸参与的情况下通过丁酰CoA-乙酰CoA转移酶的作用生成丁酸和乙酰CoA。但究竟哪种是丁酸梭菌产生丁酸的主要途径目前还存在争议。
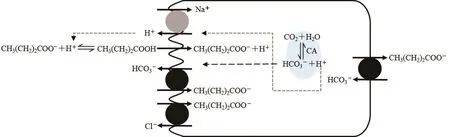
图1 结肠上皮细胞中丁酸的吸收机制模型
丁酸主要在大肠中产生,经被动扩散与特异性载体运输被盲肠和结肠上皮细胞吸收[18]。丁酸在肠道中存在解离和非解离形式,非解离的丁酸质子化(与H+结合)后是脂溶性的,能够以被动扩散的方式进入上皮细胞内,并释放出H+,导致细胞质酸化。此时Na+/H+交换系统(Na+-H+Exchanger,NHE)被激活,增加H+的转出和Na+的转入,以保持细胞内外pH值的稳定[19-20]。因此肠上皮细胞以质子化扩散的方式吸收丁酸与细胞上的NHE活性之间存在功能性偶联关系。而解离状态的丁酸主要通过载体介导的丁酸阴离子与HCO3-进行交换,这些载体包括腺瘤下调因子(Down Regulated in Adenoma,DRA)和假定阴离子1(Putative Anion 1,PAT1)等[21]。DRA和PAT1能转进解离的SCFA,同时转出HCO3-。此外,当上皮细胞内的pH值上升时,阴离子交换剂2(Anion Ex⁃changers 2,AE2)被激活,也能将HCO3-转运出细胞外。肠上皮细胞的顶端和基底外侧膜均存在阴离子交换方式,但其对丁酸和HCO3-的转运方向恰好相反[20]。
丁酸被细胞吸收后,首先在细胞质中经丁酰CoA合成酶活化为丁酰CoA,然后在脱氢酶、水合酶以及硫解酶的作用下生成乙酰CoA,进入三羧酸循环产生ATP[22],为肠上皮快速提供能量。此外,丁酸产生的乙酰CoA以及通过羟甲基戊二酸单酰CoA途径产生的酮体(乙酰乙酸、β-羟丁酸和丙酮)可作为肠上皮细胞合成其它物质的底物。
1.3.2 提高肠道屏障功能
肠道是机体与外界进行物质交换的场所,不可避免会接触大量有毒有害物质。肠道上皮屏障能有效抵御这些微生物或毒素的入侵,而肠道完整性是肠上皮发挥屏障功能的基础。丁酸有助于改善绒毛形态结构,保护肠道屏障功能。
丁酸的高效利用能促进结肠上皮细胞的增殖和分化,增加蛋白质合成,抑制细胞凋亡[23],加快肠上皮的更新,增加细胞间紧密连接[24-25]。增强肠道屏障功能。不仅如此,在损伤刺激的条件下,丁酸盐还可促进肠上皮再生,修复破损的肠黏膜。研究表明,仔猪早期断奶会破坏肠道完整性,而日粮中添加丁酸能降低隐窝深度,提高绒毛高度与隐窝深度比值[26],降低肠道通透性[27]。此外,丁酸还可逆转脂多糖诱导的紧密连接蛋白和闭合蛋白表达的降低,增强肠道屏障功能,这可能与丁酸加快了紧密连接蛋白的迁移和装配速度有关[28]。然而,肠道中高浓度的丁酸会促进细胞凋亡,诱导肠黏膜损伤[29]。Kaiko等[30]研究发现,丁酸可降低斑马鱼肠道干细胞活性,而对小鼠结肠干细胞则无明显作用。隐窝的特殊细胞结构一定程度上能够保护干细胞免受肠腔中某些因子的刺激。由于斑马鱼肠道中不存在隐窝结构,丁酸可直接接触肠道干细胞。值得深思的是,肠道干细胞是肠上皮更新或再生的动力来源,丁酸的促生长可能并非是它作为一个信号分子刺激肠道干细胞的增殖和分化,那么这种作用是通过什么样的途径实现的呢?这一问题需待更进一步的研究去解析。
2 调节肠道菌群平衡
肠道定植的菌群之间保持着相对平衡,它们共同维护了肠道微生态系统的稳定。但这种动态的平衡状态易受外部因素和机体自身生理状况的影响。尤其是幼年动物,由于肠道发育不完全,微生态系统比较脆弱,致病性大肠杆菌等有害菌易于在肠道中繁殖,导致机体发生腹泻等肠道疾病[31]。研究表明,丁酸梭菌能够通过竞争、排斥、替代以及改变肠道微环境来有效调节肠道微生态的菌群平衡,抑制有害菌生长[32],从而有效降低动物腹泻率,大幅提高其成活率[33]。
1975年,Clarke等[34]首次在丁酸梭菌NCIB 7423菌株中分离纯化一种多肽——丁酸梭菌素7423,这种丁酸梭菌素能够有效抑制致病菌生长繁殖。赵熙等[35]对植入丁酸梭菌的小鼠肠道内容物进行检测,发现其中的双歧杆菌和乳杆菌的数量相较于对照组明显增加,而肠球菌、肠杆菌等致病菌的数量则显著降低。体外试验同样很好地说明丁酸梭菌的抑菌效果[36]。
丁酸抑菌机理除了它通过各种方式抑制有害菌的黏附外[37],还可通过调节肠道pH值达到抑制有害菌繁殖的目的。肠道中大多益生菌生活的最适pH值是偏酸性,而大部分致病菌为弱酸性偏碱性[38],丁酸可微调肠道环境的pH值,从而促进益生菌的生长,抑制有害菌的生长。而益生菌数量的增加会进一步压缩有害菌的生存空间,加剧了有害菌的脱落和死亡。
3 增强调节免疫机制
肠道是机体最大的免疫器官,其功能的发挥主要依赖于肠道相关黏膜免疫细胞的作用。丁酸梭菌能加强机体免疫应答,增加免疫活性细胞的数量,降低肠道炎症反应。
肠道中Toll样受体(TLR)可介导微生物分子的识别以消除病原体[39],因此,其活性高低对于机体的免疫应答的灵敏度至关重要[40]。研究发现,丁酸梭菌能提高肠道中TLR2 mRNA丰度,当TLR2被敲除后,丁酸梭菌诱导细胞产生的免疫应答能力降低[41],说明TLR2介导了由丁酸梭菌加强的免疫应答反应。
肠道相关黏膜免疫细胞包括肥大细胞和淋巴细胞等是机体抵抗感染的第一线细胞。研究表明,日粮中添加丁酸钠可增加肠道中肥大细胞和淋巴细胞的数量[42],说明丁酸钠可增强肠道免疫能力。丁酸梭菌能够在机体出现炎症反应时通过影响免疫细胞分泌某些抗炎因子抑制炎症反应,其中白细胞介素-10(IL-10)是丁酸梭菌588发挥抗炎作用的重要因子。相关研究发现,丁酸梭菌588能诱导肠巨噬细胞产生IL-10,且TLR2信号传导可正向诱导IL-10的产生[43-44],而IL-10的增加会抑制促炎性细胞因子IL-4的表达[45]。此外,有研究表明,TReg细胞在免疫稳态的建立和维持以及抑制炎症性免疫反应和自身免疫中同样起到了重要作用[46],IL-10产生能增加TReg细胞的积累,达到保护结肠效果[47]。血液中的抗体水平也可间接说明肠上皮黏膜的炎症反应程度。丁酸梭菌能显著提高樱桃谷肉鸭血清中C3、C4(补体系统重要组成部分)[6],以及鸡[48-49]和断奶仔猪[50]血清中IgA、IgG和IgM的含量,表明丁酸梭菌增强了机体的免疫力,降低了炎症反应。NF-κB信号通路介导了炎症反应过程,其中,NF-κB是调节免疫和炎症反应的枢纽。有研究表明,丁酸钠可抑制NF-κB的活性[51]。丁酸钠还可通过抑制LPS应答机制下调NF-κB通路表达,从而缓解炎症反应[52]。
4 提高抗氧化能力
丁酸梭菌代谢产生抗氧化酶,通过减少反应性氧代谢物来调节氧化应激[53-54],从而提高机体的抗氧化能力。谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)是机体内重要的抗氧化酶,而丙二醇(MDA)是一种脂质过氧化产物,反映了机体氧化应激的程度。Liao等[6]研究表明,日粮中补充丁酸梭菌能显著提高肉鸡肠道中GSH-Px含量,同时降低肠黏膜MDA水平。丁酸梭菌也能产生具有清除活性氧的酶,即NADH和NADPH氧化酶。Kawasaki等[55]在丁酸梭菌的胞质部分中检测到了NADH/NADPH氧化酶以及SOD活性,机体通过它们清除肠道中活性氧来提高抗氧化能力。
5 小结
综上所述,丁酸梭菌不仅能依靠自身调节肠道菌群平衡,通过TLR介导机体的免疫应答反应增强局部免疫力,而且其代谢产物对于提高营养物质的消化吸收和机体抗氧化能力以及改善肠道屏障功能也起到了积极的正向作用。尤其是其产生的丁酸,作为结肠上皮细胞的主要能源物质,可促进肠道发育。由于丁酸在干细胞暴露的情况下会抑制它的增殖,那么丁酸作用于肠上皮细胞与肠道干细胞存在着怎样的差异,以及它如何影响肠上皮细胞的增殖和分化过程都值得深入挖掘。鉴于丁酸梭菌及其代谢产物广泛而有效的作用,因此有必要充分解析其促进肠道发育、增强机体免疫的机制,为其在畜牧生产中的应用,包括抗生素替代以及新产品的研发提供理论依据。

